皮肤是人体重要的保护屏障,在保护身体免受微生物感染、辐射或化学腐蚀等方面有着不可或缺的作用[1-2]。皮肤通常具有一定的自我修复能力。然而,一些重大创伤(如大面积烧伤)或疾病(如糖尿病)导致的慢性伤口往往难以愈合,常在皮肤表面形成瘢痕或溃疡,严重时甚至需要截肢,对患者造成巨大负担[3-4]。伤口愈合是一个多步骤的过程,涉及复杂的病理生理机制,主要包括止血、炎性细胞浸润、血管生成和肉芽组织形成、组织再生和重塑[3]。其中,血管向损伤部位的细胞增殖和分化等行为提供营养和氧气等必需物质,在伤口愈合的早期阶段起关键作用。相反,血管的缺乏和血液流动不足则是导致伤口愈合延迟最重要的因素之一[3,5]。许多策略已被开发用于促进新生血管形成,包括干细胞疗法或生长因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)和缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)等,然而干细胞和生长因子储存困难且成本高昂,并且存在生长因子从递送部位快速扩散并产生异位副作用等风险[6]。因此,为了满足临床需求,迫切需要一种成本低廉、简便快速的基于现成生物材料的可替代性方案。
水凝胶是一种具有三维交联网络结构的软材料,因其力学模量与软组织相似且具有高含水量,被广泛用于组织工程中[7]。与传统水凝胶相比,自愈合可注射性水凝胶展示出了更大的优势,因其在受到外部挤压刺激的作用下,能够以微创的形式原位填充到体内靶向部位,并进行自修复以嵌合不规则组织缺陷,避免手术引起的二次伤害的同时也降低了异位风险,大大地提高了药物利用率。透明质酸(hyaluronic acid,HA)是一种天然多糖,也是细胞外基质(extracellular matrix,ECM)的重要组成成分之一,存在于皮肤、结缔组织等生物组织中。分子结构方面,HA富含羧基和羟基等多个反应活性位点,允许通过多种手段制备水凝胶。例如,HA除了能够用来制备具有反应性的甲基丙烯酸化透明质酸(hyaluronic acid methacryloyl,HAMA)外,还能通过加成或缩合与硫醇、卤代乙酸、二酰肼、醛和酪胺等基团反应[8-9]。此外,多个研究表明,铜离子(Cu2+)可以通过刺激内皮细胞促进血管生成。比如,LI等[10]将含铜生物活性玻璃与蛋壳膜结合构建了纳米复合薄膜(Cu-BG/ESM),体外结果表明5%Cu-BG/ESM能够通过促进VEGF和HIF-1α等相关蛋白及基因的表达来刺激血管生成。LIU等[11]制备了多酚-铜纳米胶囊,并通过自组装制备了多功能水凝胶伤口敷料,这种胶囊的形式实现了水凝胶中Cu2+的不断释放并在大鼠皮肤缺损模型中验证其促成血管的特性。基于以上研究,构建基于Cu2+的可注射性HA水凝胶体系是一种有前途的替代方案。在这个方案中,可注射性HA-Cu复合水凝胶体系兼具良好生物相容性和促血管特性,适用于临床上不规则的创面修复。
鉴于此,在本研究中,我们首先制备了巯基化透明质酸(thiolated hyaluronic acid,HASH),并在蓝光的诱发下进一步与丙烯酸化双膦酸盐(acrylated bisphosphonate,Ac-PD)发生巯基-烯点击反应得到双膦酸盐改性的透明质酸(bisphosphonated hyaluronic acid,HAPD),最后利用HAPD分子结构中双膦酸基团与Cu2+之间的金属配位作用构建自愈合可注射性水凝胶HAPD-Cu。设计不同浓度的Cu2+,观察水凝胶形态及性能变化;将骨髓干细胞和人脐静脉内皮细胞与不同Cu2+浓度水凝胶共培养,观察其细胞毒性,并检测不同Cu2+浓度水凝胶对成血管性能的影响;建立体外伤口模型,观察不同Cu2+浓度水凝胶治疗软组织修复的功能差异。
1 材料与方法
1.1 实验试剂与仪器
1.1.1 实验试剂
帕米膦酸二钠(pamidronate disodium,PD;CSN,美国),氢氧化钠(sodium hydroxide,NaOH;阿拉丁,规格≥97%),丙烯酰氯(阿拉丁,规格≥ 99.5%),二甲氧基-1, 3, 5-三嗪-2-基-4-甲基吗啉[4-(4, 6-dimethoxy-1, 3, 5-triazin-2-yl)-4-methylmorpholin-4-ium chloride,DMTMM;阿拉丁],HA(山东弗鲁伊达),3, 3′-二硫代双(丙酸二酰肼)[3, 3'-dithiobis (propionohydrazide),DTP;阿拉丁],二甲基亚砜(dimethyl sulfoxide,DMSO;麦克林),三(2-羧乙基)膦盐酸盐[tris (2-carboxyethyl)phosphine,TCEP-HCl;麦克林,规格98%],2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮[2-hydroxy-4'-(2-hydroxyethoxy)-2-methylpropiophenone,Irgacure 2959;阿拉丁,规格≥98%],氯化铜(阿拉丁,规格99.99%),calcein/PI细胞活性与细胞毒性检测试剂盒(货号C2015M,Beyotime),多聚甲醛(paraformaldehyde,PFM;货号P0099,Beyotime),基质胶(货号354230,康宁),鬼笔环肽(phalloidin;货号C2205S,Beyotime),牛血清白蛋白(bovine serum albumin,BSA;货号V900933,Sigma),4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole,DAPI;货号C1002,Beyotime),CD31(货号NB100-2284,Novus)。
1.1.2 实验仪器
微量注射泵(兰格,LSP01-1A),365 nm蓝光固化仪(3535-ZFX;UVGO),场发射扫描电子显微镜(scanning electron microscope,SEM;日立,S4800),能量色散X射线光谱(energy dispersive spectroscopy,EDS;日立,S4800),核磁共振氢谱仪(nuclear magnetic resonance,1HNMR,Ascend 600),傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR;Nicolet),TA流变仪(沃特世,ARES-G2,美国),高效液相-电感耦合等离子体质谱仪(inductively coupled plasma spectrometer,ICP;NexION 2000,美国),荧光显微镜(尼康,日本),酶标仪(Infinite F50,TECAN,瑞士),激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM;蔡司,德国)。
1.2 Ac-PD的制备与表征
1.0 g PD溶于30.0 mL NaOH(质量浓度为2%)溶液中,冰浴下,用微量注射泵将1.0 mL丙烯酰氯以20.0 μL/min的推进速度添加到反应体系中。完成后恢复到室温,继续搅拌1.5 h。最后用乙酸乙酯萃取3~5次,将水相进行冷冻干燥。随后,用冰乙醇洗涤3次,真空抽干得到产物Ac-PD。分子结构通过1HNMR验证。
1.3 HASH的制备与表征
将500.0 mg HA溶解在40.0 mL MES缓冲液(0.01 mol/L)中。准备A液和B液,A液为1.0 mL的DTP溶液(25.3 mg,DMSO),B液为1.0 mL DMTMM溶液(122.4 mg,去离子水)。将A液和B液加入到上述反应体系中,室温下反应12 h。然后,将151.2 mg TCEP-HCl添加到混合体系中,继续搅拌3 h。最后,将体系转移到截留相对分子质量为3 500的透析袋中,分别用0.1 mol/L NaCl水溶液和去离子水透析1~2 d。冷冻干燥,得到HASH。通过FTIR和1HNMR确认了分子结构。经1HNMR测定,-SH的取代度约为10%。
1.4 HAPD的制备与表征
利用巯基-烯点击反应制备了HAPD。将213.5 mg Ac-PD和5.5 mg Irgacure 2959加入HASH溶液(0.01 g/mL,溶剂为去离子水)中。完全溶解后,将整个反应体系在惰性气氛中暴露于蓝光固化仪25 min。随后,将体系转移到截留相对分子质量为3 500的透析袋中,并在pH=3.5的水溶液中透析3 d。冷冻干燥,得到HAPD。采用FTIR和1HNMR确认了化学结构。经1HNMR测定,PD取代度为~65%。
1.5 HAPD-Cu水凝胶的制备与表征
1.5.1 HAPD-Cu水凝胶的制备与结构表征
HAPD溶解在去离子水中,得到预凝胶体系(质量浓度为8%)。然后将HAPD溶液分别与不同浓度(4、8、12和20 mmol/L)的Cu2+充分混合均匀,分别得到自愈合可注射水凝胶HAPD-Cu1、HAPD-Cu2、HAPD-Cu3、HAPD-Cu4。随后,将制备好的水凝胶冷冻干燥,并分别采用SEM和EDS分析了各组水凝胶的表面形貌和元素分布。各组水凝胶的孔径进一步通过Photoshop软件进行半定量分析,由Origin 2018软件进行绘制。
1.5.2 HAPD-Cu水凝胶的自愈合及可注射性能测试
500 μL规格的水凝胶用于自愈合测试。4组水凝胶预先加了不同颜色的染剂,即HAPD-Cu1(橘色)、HAPD-Cu2(紫色)、HAPD-Cu3(绿色)和HAPD-Cu4(蓝色)。在各组水凝胶的中央制造出直径约为5 mm大小的空白区域,并分别在0、5、15 min的时间点记录凝胶形态,图像于自然光下由相机拍摄。
选择1 mL规格的注射器和200 μL规格的水凝胶用于可注射性测试,图像于自然光下拍摄。
1.5.3 HAPD-Cu水凝胶的流变学测试
采用TA流变仪对200 μL规格的水凝胶在室温下利用40 mm平行板进行流变学研究。对于应力-应变测试,用恒定频率(0 Hz)将扫描应变从0.1%扫描到800%以确认水凝胶临界点,即储能模量(G′)与损耗模量(G″)曲线相交时的临界应变值。同样条件下,阶跃应变循环的测定则经过多步骤:10%应变60 s,800%应变60 s,重复4次。
1.5.4 HAPD-Cu水凝胶的溶胀实验
在37 °C的去离子水中评估凝胶的溶胀率,水凝胶规格为200 μL。将各组样品置于去离子水中,在每个时间点(0、3、6、8、12、16、20、24、28、48、96 h)记录水凝胶的重量。溶胀比计算如下:
其中,W0代表初始水凝胶重量;Wt 代表t时刻的水凝胶重量。
1.5.5 HAPD-Cu水凝胶的降解实验
类似地,将水凝胶(200 μL)浸入37 °C的1 mL去离子水中,然后置于恒温振荡器。在一定的时间点(0、4、8、14、20 h和1、2、3、4、5、6、7 d)进行测定。降解率计算如下:
其中,W0代表初始水凝胶重量;Wt 代表t时刻的水凝胶重量。
1.5.6 HAPD-Cu水凝胶的离子释放实验
在37 °C的去离子水中检测Cu2+的释放情况。取200 μL规格的水凝胶浸入1 mL去离子水中,然后置于恒温振荡器。在选定的时间点(0、4、8、20 h和1、3、5、7 d)取出,然后加入等量的新鲜去离子水。收集的清液中的Cu2+的含量通过ICP测定,离子的累计释放计算如下:
其中,Mn 代表在第n时刻的累计释放量;Cn 为第n时刻的离子的质量浓度;Vs 和V分别为样品体积和透析液总体积。
1.6 细胞实验
1.6.1 细胞培养
分别选择大鼠骨髓间充质干细胞(bone marrow stem cells,BMSCs)和人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)来评估材料的生物相容性和促成血管性能,细胞来源由上海交通大学医学院附属瑞金医院提供。细胞培养箱的条件设置为37 °C,95%的相对湿度和5%的CO2浓度。培养基的组成为90%Dulbecco的改良鹰培养基(DMEM;Gibco,美国),10%胎牛血清(FBS;Gibco,美国)和1%青霉素-链霉素(PS;Gibco,美国)。实验过程中,培养基每2 d更换1次。整个细胞实验中,各组水凝胶的规格为200 μL。
1.6.2 HAPD-Cu的生物相容性实验
BMSCs被用来评估材料的生物相容性。收集HAPD-Cu1、HAPD-Cu2、HAPD-Cu3以及HAPD-Cu4的浸出液,并以各组浸出液为基础配置各组的细胞培养基。将BMSCs于24孔板中以4×104个/孔的密度分别培养在各组浸出液中,以普通培养基培养的BMSCs作为对照组。分别培养1、3、5d后,每孔加入300 μL活/死细胞染色溶液,室温避光孵育20 min。然后,用PBS轻缓洗涤3次后,在荧光显微镜下进行观察并采集图像。其中,活细胞被标记为绿色,死细胞被标记为红色。
采用CCK-8法检测各组BMSCs的增殖情况。将各组细胞接种在96孔板中,密度为4×103个/孔,分别培养1、3、5 d。在各个时间段,每孔加入100 μL CCK-8试剂,并于培养箱中孵育2 h,用酶标仪在450 nm波长处检测细胞的光密度(D)值。由Origin 2018软件进行绘制。
1.6.3 成小管实验
HUVECs被用来评估材料的促成血管特性。首先将200 μL基质胶加入到24孔板中,并于培养箱中孵育60 min。然后,将HUVECs以4×104个/孔的密度接种到基质胶涂层板中。孵育6 h后用4% PFM进行固定。固定完成后,每孔加入200 μL的鬼笔环肽染色试剂,室温避光孵育60 min。然后移除鬼笔环肽试剂,每孔加入200 μL的DAPI试剂,室温避光孵育5 min。移去DAPI,PBS轻缓洗涤2次后,于荧光显微镜下对新形成的管状结构进行观察并采集图像。其中,鬼笔环肽将细胞骨架标记为红色,DAPI将细胞核标记为蓝色。通过Image J软件定量分析结点数和管的总长度,并由Origin 2018软件进行绘制。
1.7 组织染色实验
1.7.1 动物模型的建立
采用24只平均体质量为180 g的3周龄雄性SD大鼠用于构建感染伤口缺损动物模型,以评估HAPD-Cu水凝胶对体内促成血管的能力。SD大鼠购自上海昇敞生物科技公司,于腹膜内注射戊巴比妥钠进行麻醉后,剃掉大鼠背部的皮毛,构建对称的2个直径为1 cm的全层皮肤伤口,并用碘伏对周围进行消毒。
1.7.2 CD31免疫荧光染色
选取12只SD大鼠并随机分为4组:对照组、HAPD-Cu1、HAPD-Cu2以及HAPD-Cu3组。对照组未接受治疗,而实验组则被用无菌1 mL规格注射器均匀地注射水凝胶,每组200 μL。每次注射水凝胶后,在伤口上覆盖无菌纱布,水凝胶每3d更换1次,术后第7天处死大鼠,收集组织标本。选择CD31作为免疫荧光标记物以评估体内血管生成情况。CD31阳性染色被标记为红色,使用LSCM对组织切片的染色结果进行观察并采集图像。
1.7.3 创面修复
选取12只SD大鼠并随机分为4组:对照组、HAPD-Cu1、HAPD-Cu2,以及HAPD-Cu3组。建立好动物模型后,将各实验组200 μL水凝胶通过无菌1 mL规格注射器均匀地注射在伤口缺陷部位,每3d更换;对照组未进行任何处理。所有组均在实验期间定期进行碘伏消毒,并分别于术后第0天和第14天拍照记录。
1.8 统计分析
在研究中,使用3个独立实验的x±s来表示所有分析数据。数据分析使用单因素方差分析计算组间差异。所有统计量化均在高分辨率图像的基础上通过Image J软件和Origin软件得到。P<0.05表示差异具有统计学意义。
2 结果
2.1 HAPD-Cu水凝胶的制备
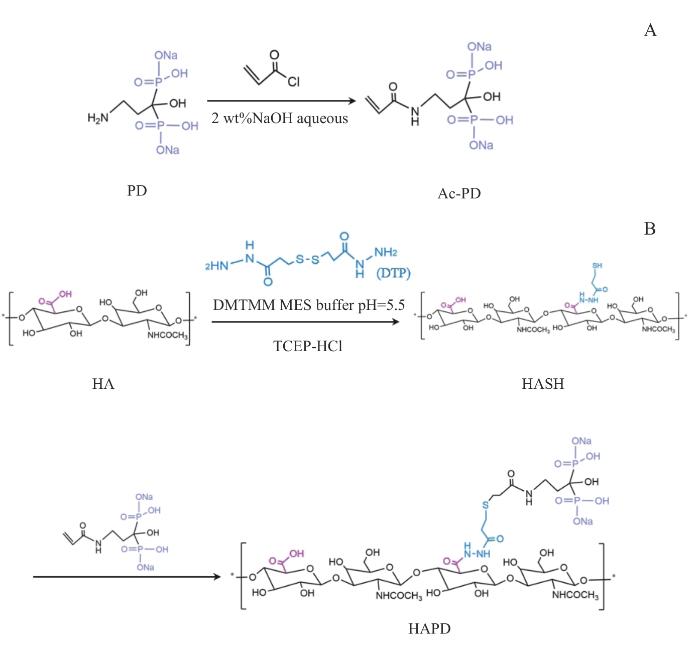
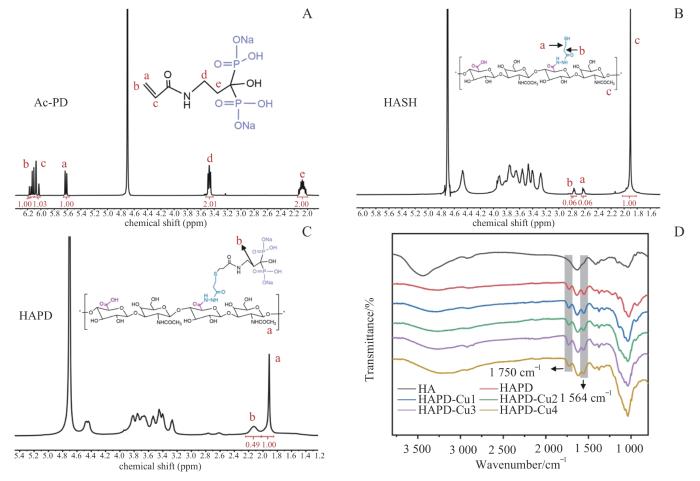
图1为本研究的反应方程式。图2A显示了Ac-PD的1HNMR结果,在5.6~6.2 ppm(1 ppm=10-6)处发现了丙烯基(-C=C-C)的特征峰,证明成功将活性双键引入到磷酸盐分子结构中[12]。图2B显示了HASH的1HNMR结果,在2.6~2.8 ppm处观察到了-CH2-CH2-SH的特征峰,证明成功向HA分子结构中引入了巯基(-SH),经积分计算,-SH取代度为~10%[13]。图2C显示了HAPD的1HNMR结果,在2.0~2.2 ppm处出现了磷酸根旁亚甲基[-CH2C(OH)(PO3H2)2]的特征峰,证明成功得到HAPD,经积分计算,得到双磷酸根的修饰率为~74%[2]。上述结果证明了Ac-PD、HASH和HAPD的成功制备。
图1
图1
Ac-PD、HASH和HAPD的化学反应方程式
Note: A. Reaction equations of Ac-PD. B. Reaction equations of HASH and HAPD.
Fig 1
Chemical reaction equations of Ac-PD, HASH, and HAPD
图2
图2
Ac-PD、HASH、HAPD和HAPD-Cu的化学表征分析
Note: A. 1HNMR of Ac-PD. B. 1HNMR of HASH. C. 1HNMR of HAPD. D. FTIR of samples (HA, HAPD, HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4).
Fig 2
Chemical characterization analysis of Ac-PD, HASH, HAPD, and HAPD-Cu
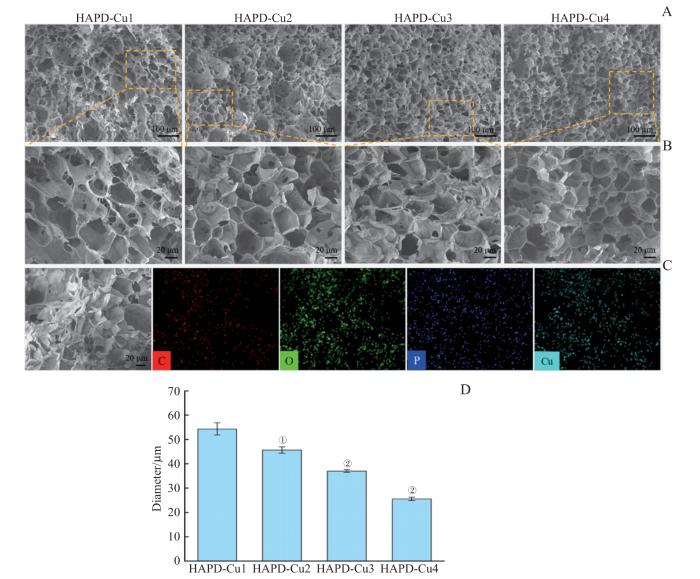
2.2 HAPD-Cu水凝胶的微观结构
图3
图3
HAPD-Cu的微观结构
Note:A. ×150 SEM images of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4). B. ×400 SEM images of the local areas of A. C. Elemental mapping images of HAPD-Cu1 hydrogel samples. D. Semi-quantitative analysis of the pore diameter of hydrogels. ①P = 0.004, ②P = 0.000;compared with the HAPD-Cu1 group.
Fig 3
Microstructure of HAPD-Cu
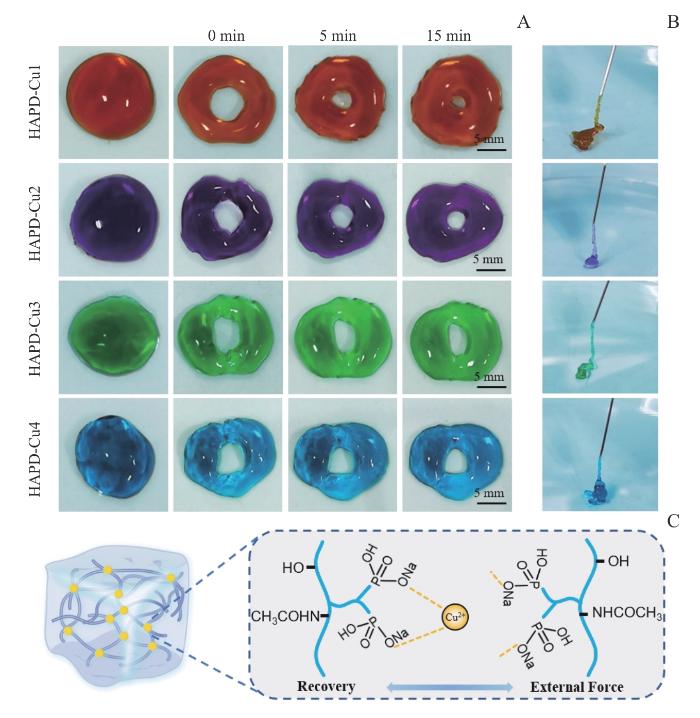
2.3 HAPD-Cu水凝胶的自愈合和可注射特性
图4
图4
HAPD-Cu的自愈合和可注射性能
Note:A. Self-healing photographs of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4) at various time points (0, 5, 15 min). B. Injectable photographs of samples from each group (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4). C. Self-healing mechanism of HAPD-Cu hydrogels.
Fig 4
Self-healing and injectable properties of HAPD-Cu
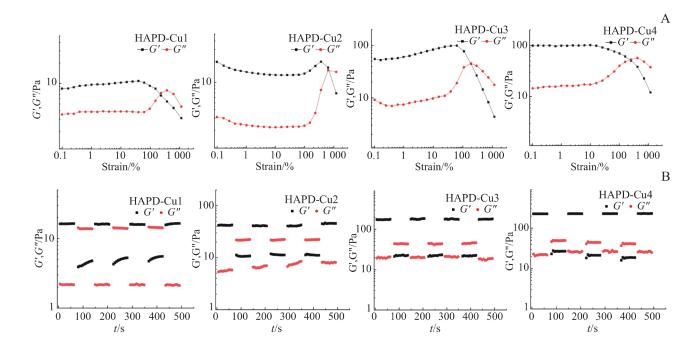
2.4 HAPD-Cu水凝胶的流变力学
图5
图5
HAPD-Cu的流变力学
Note:A. Strain scan curves of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4) with amplitudes of oscillatory strain scanned from 0.1% to 800% at constant frequency (0 Hz). B. Strain cycling curves of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4): high strain (800%) for 60 s and low strain (10%) for 60 s, cycled 4 times.
Fig 5
Rheology of HAPD-Cu
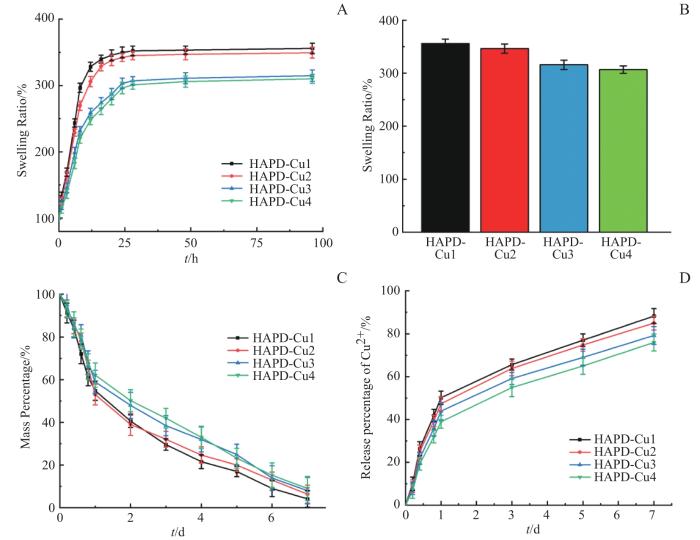
2.5 HAPD-Cu水凝胶的溶胀、降解和离子释放
图6A显示了各组水凝胶的溶胀曲线,图6B为平衡状态下的溶胀率。各组均具有很强的吸水能力,溶胀率高达300%。而且,HAPD-Cu3和HAPD-Cu4组的溶胀程度显著低于其他2组,这是由于Cu2+浓度的增加,增强了聚合物的交联网络,导致吸水性降低[15]。图6C为各组水凝胶的降解曲线,各组水凝胶在第一天质量均损失了约30%,而后降解速率减缓,直到第7天基本完全降解。降解过程中Cu2+的释放情况如图6D所示,类似地,Cu2+在第1天时的累计释放总量达到了约30%,而后释放速率减缓,与降解过程相匹配,并在第7天时最大释放总量能达到约79%。这些结果表明,HAPD-Cu水凝胶降解周期约为7d,并在早期存在离子突释行为。
图6
图6
HAPD-Cu的溶胀、降解和离子释放
Note:A. Swelling-time curves of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4). B. Equilibrium swelling rate of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4). C. Degradation-time curves of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4). D. Cumulative Cu2+ release curves of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4).
Fig 6
Swelling, degradation and ion release of HAPD-Cu
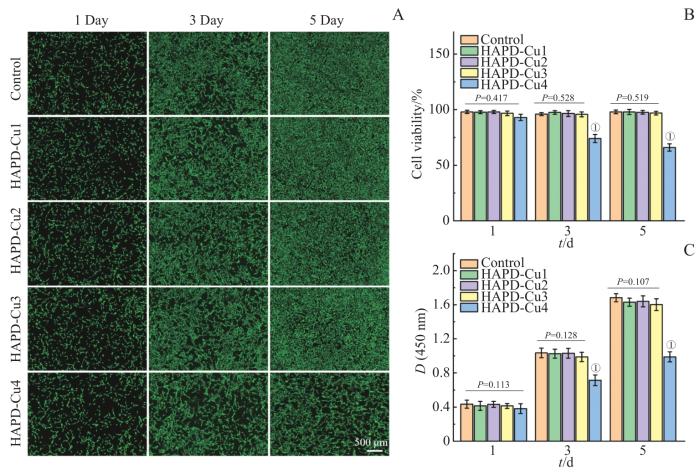
2.6 HAPD-Cu水凝胶的生物相容性
分别使用活/死细胞染色和CCK-8法检测了BMSCs的活力和增殖行为。图7A为活/死细胞染色结果,图7B为细胞存活率的量化表征。与对照组相比,HAPD-Cu1、HAPD-Cu2以及HAPD-Cu3组无明显差异,图像中均呈现大量绿色,表明具有良好的生物相容性。然而,在第3天时,HAPD-Cu4组的细胞存活数量与其他组相比有所降低,第5天时的差异更甚,而死细胞的数量明显增加,其细胞存活率约为63%,说明HAPD-Cu4组存在潜在的细胞毒性。图7C为CCK-8检测结果,与活/死细胞染色结果一致:与对照组相比,HAPD-Cu1、HAPD-Cu2和HAPD-Cu3组的OD值无统计学差异,而HAPD-Cu4组的OD值明显下降,说明高浓度的Cu2+对BMSCs的生存产生了毒副作用,抑制了细胞增殖行为。另外,由于HAPD-Cu4的毒副作用,接下来的相关测试均不包含该实验组。
图7
图7
HAPD-Cu的生物相容性
Note:A. Images of live/dead staining of BMSCs co-cultured with extracts from each group of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4) for 1, 3 and 5 days. B. Cell viability of BMSCs co-cultured with extracts from each group of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4) for 1, 3 and 5 days (①P = 0.000, compared with the control group). C. CCK-8 results of BMSCs co-cultured with extracts from each group of samples (HAPD-Cu1, HAPD-Cu2, HAPD-Cu3 and HAPD-Cu4) for 1, 3 and 5 days (①P = 0.000, compared with the control group). Controls were cells cultured in normal medium.
Fig 7
Biocompatibility of HAPD-Cu
2.7 HAPD-Cu水凝胶的促成血管作用
图8
图8
HAPD-Cu的管形成实验
Note:A. Tube formation images of HUVECs co-cultured with the extracts of each group of samples (HAPD-Cu1, HAPD-Cu2 and HAPD-Cu3) for 6h. B. Junctions of HUVECs co-cultured with the extracts of each group of samples (HAPD-Cu1, HAPD-Cu2 and HAPD-Cu3) for 6h (①P = 0.018, ②P = 0.010, ③P = 0.034). C. Total length of HUVECs co-cultured with the extracts of each group of samples (HAPD-Cu1, HAPD-Cu2 and HAPD-Cu3) for 6h (①P = 0.000, ②P = 0.004, ③P = 0.001); controls were cells cultured in normal medium.
Fig 8
Tube formation experiments of HAPD-Cu
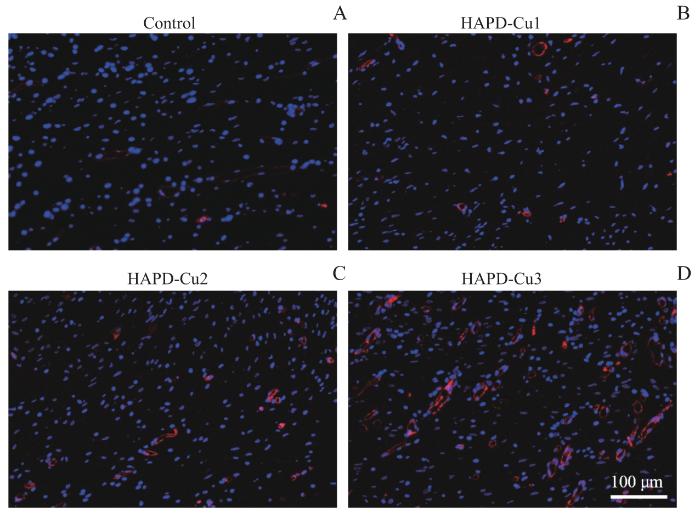
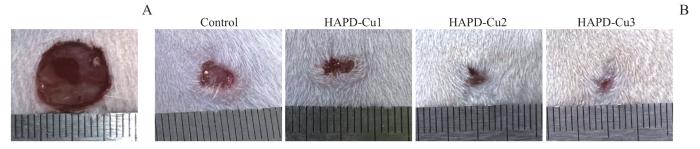
上述实验结果证明了HAPD-Cu水凝胶在体外对HUVECs的促成管作用。另外,为了进一步研究对体内的实际成血管效果以评估对软组织损伤的修复情况,建立了大鼠伤口模型,并收集组织切片对其进行CD31免疫荧光染色。图9A—D为各治疗组的染色结果。如图所示,对照组中呈现大片的蓝色,CD31的阳性(红色)表达极少。而随着实验组Cu2+浓度的增加,在HAPD-Cu1、HAPD-Cu2以及HAPD-Cu3组中均能清楚地观察到CD31的阳性表达,特别是HAPD-Cu3组,显示出了最佳的促进血管生成的潜力。这些实验结果表明,尽管高浓度的Cu2+会对细胞产生毒副作用,但中等浓度的Cu2+会促进血管生成。伤口创面修复实验结果如图10所示,各组创面均未见明显感染,且与对照组相比,各实验组愈合情况良好,特别是HAPD-Cu3组,基本完全愈合。
图9
图9
HAPD-Cu的CD31免疫荧光染色
Note:A. CD31 staining image of Control. B. CD31 staining image of HAPD-Cu1. C. CD31 staining image of HAPD-Cu2. D. CD31 staining image of HAPD-Cu3.
Fig 9
CD31 immunofluorescence staining and optical photographs of wound repair of HAPD-Cu
图10
图10
HAPD-Cu的创面愈合观察实验 (n=3)
Note:A. Original wound healing model. B. Wound healing at day 14.
Fig 10
Observation of diabetic wound healing of HAPD-Cu (n=3)
3 讨论
自愈合可注射性水凝胶由于具备微创治疗和局部靶向性等优势而具有独特的临床应用前景。金属配位是构建自愈合水凝胶的最常用方法之一,因为其设计参数广泛且可调节性高,而且其内在的物理化学性质和离子的特性均可以由所得的生物材料赋予(如抗菌、成骨、成血管)等[18-20]。本研究以铜离子作为中心金属,双膦酸基团作为螯合配体,通过金属配位作用制备了HAPD-Cu水凝胶,并在体外表现出了良好的自愈合和可注射特性(图4A、B)。而且流变学的测试表明,在循环施加低剪切速率和高剪切速率时,4种水凝胶的G’和G”均能在几秒钟内恢复100%(图5B)。有研究指出,松散多孔的网络结构有利于细胞粘附和迁移,保持湿润环境,吸收伤口渗出物并加速伤口愈合等[11]。SEM结果表明(图3A、B),4组HAPD-Cu水凝胶均具有内部相连的多孔结构,有利于细胞浸润和营养交换。此外,理想生物材料的降解速率须与组织的再生过程相匹配。如果降解太快,则不足以支持组织的向内生长;若降解太慢,则会促使纤维化阻碍组织的正常再生过程[21]。通常,伤口愈合的周期为1~2周,HAPD-Cu的降解实验(图6C)和离子释放实验(图6D)表明,HAPD-Cu的降解周期约为7 d,并在前期存在离子突释行为,这有利于促进早期血管网络的建立,从而为后续伤口愈合奠定坚实的生物学基础。
综上,本研究制备一种基于金属配位作用的自愈合可注射性水凝胶,通过促成血管以加速创面愈合。本研究中,金属配位键源自Cu2+和双膦酸基团之间的动态非共价作用,并在体外表现出了优异的自愈性和可注射性,允许其以微创形式注射到损伤部位。体外及体内实验均表明,除去高浓度铜离子的实验组(HAPD-Cu4)外,低浓度和中浓度铜离子的HAPD-Cu水凝胶(HAPD-Cu1、HAPD-Cu2、HAPD-Cu3)具有良好的细胞相容性和促成血管特性,可以更好地应用于不规则皮肤创面的修复,具有较大的临床转化潜力。
作者贡献声明
杨淑、蔡正伟参与了实验设计,杨淑参与了论文的写作,魏杰、崔文国、蔡正伟参与了论文的审查和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by YANG Shu and CAI Zhengwei. The manuscript was drafted by YANG Shu. The manuscript was reviewed and revised by WEI Jie, CUI Wenguo and CAI Zhengwei. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献