大脑皮层在正常发育和老化过程中产生的沟回形态有多种表现,沟回形成的褶皱能够容纳更多的大脑皮层[1]。随着研究的深入,不同的沟回结构指标相继出现。与此同时,在地学研究领域,起伏的地表形态也备受关注,研究者已经建立了完善的地形起伏分析指标体系,提出了特有的地形因子提取方法,并构建了成熟的数字地形分析(digital terrain analysis,DTA)理论。考虑到地表三维起伏结构与人脑沟回起伏结构的相似性,能否将DTA理论、方法和指标运用于人脑沟回结构的研究中,是一个值得探讨的问题。
AD于19世纪90年代初期首次被提出[4],它是由神经元之间的间接性损伤造成的中枢神经系统退行性疾病,主要表现为患者认知与记忆功能以肉眼可见的速度发生退化。同时,AD也是影响大脑形态发育的一个重要因素,正常人的大脑与AD患者的大脑在形态上存在着诸多差异[5],因此分析AD患者大脑皮层变化规律,是本研究的重点之一。相关研究[6-7]表明,在AD发病初期,患者脑区开始出现不同程度的退化萎缩现象;而随着AD病情加重,患者全脑性萎缩症状会不断加剧,脑沟加深变宽。正常衰老的大脑是相对饱满的,而AD患者的大脑容量比正常的小很多,像一个干缩的核桃内核,这表明大脑皮层的形态和结构差异能够很好地反映AD患者的病情[8-9]。
1 对象与方法
1.1 研究对象
从阿尔茨海默病神经成像倡议(Alzheimer′s Disease Neuroimaging Initiative,ADNI)数据库(
1.2 大脑点云的生成
1.2.1 大脑MRI影像预处理
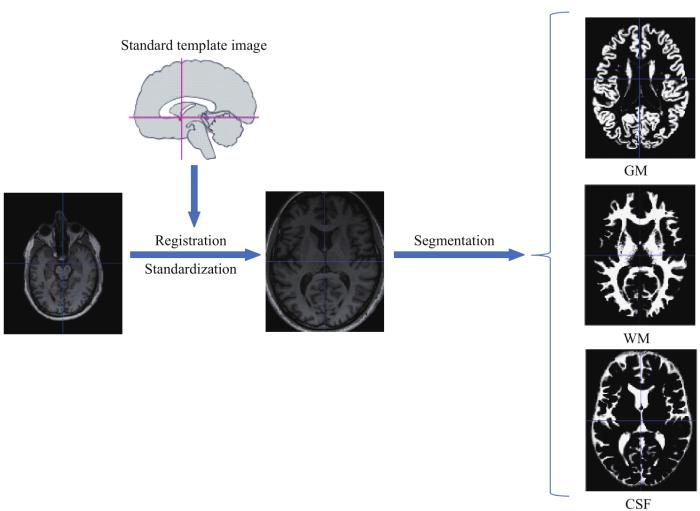
在本研究中,采用SPM 12和其附带的cat 12软件包对大脑影像进行预处理,流程如图1所示,具体步骤如下:① 影像配准。保持标准模板影像不变,对待配准影像进行变换。② 影像标准化。将所有样本大脑影像放置于一个公共的标准空间中,以实现对不同大脑皮层位置的精确衡量和对比。③ 影像分割。将影像分割产生灰质、白质以及脑脊液文件,进一步提取研究所需的灰质文件。
图1
图1
预处理流程图
Note: The brain MRI image data in the figure was from the ADNI public database. GM—gray matter; WM—white matter; CSF—cerebrospinal fluid.
Fig 1
Pretreatment flow chart
1.2.2 大脑点云生成
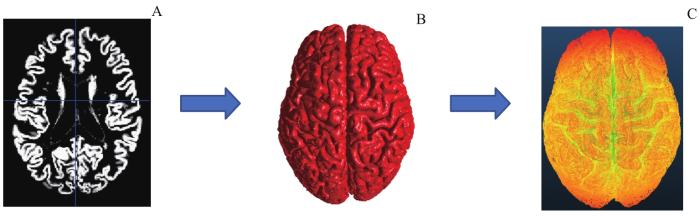
点云是指目标表面特性的海量点集合,是基于某个三维坐标系统下,以点的形式记录的数据集。将大脑MRI影像转为大脑点云,是生成大脑DEM的重要一步。本研究根据移动立方体算法提取等值面,获取大脑重建后的顶点和面片数据,其中的顶点数据,即为大脑皮层的表面点云。本研究中采用基于MATLAB的Marching Cube模块提取等值面,具体提取过程如图2所示。
图2
图2
大脑点云生成示意图
Note: The brain MRI image data in the figure was from the ADNI public database. A. MRI image of gray matter obtained after pretreatment. B. Brain model after three-dimensional reconstruction. C. Extracted brain point cloud data. The color in the picture transits from green to yellow and then to red representing the elevation from low to high.
Fig 2
Schematic diagram of brain point cloud generation
1.3 大脑DEM
1.3.1 概念
通过对DEM的邻域分析,可以提取地表面上的不同地形因子,从而对地表面进行深层次分析。本研究将这种方法映射至大脑表面,对大脑皮层表面进行分析,拟构建大脑的DEM。
基于地表DEM的定义方法,本研究将大脑DEM定义为通过经纬格网确定大脑皮层的空间位置,根据蒙特利尔神经研究所(Montreal Neurological Institute,MNI)空间坐标轴的坐标原点到大脑皮层的距离计算高程,而实现的大脑皮层数字化模拟的一组有序数值阵列。
1.3.2 构建方法
(1)大脑高程
海拔高程(elevation)是地形表面最基本的属性,也是DEM的根本。在地球上,高程的定义是地表上某一点沿铅垂线到达绝对基面的距离;这里的绝对基面通常定义为大地水准面。基于此,我们将大脑高程定义为:以MNI空间坐标轴的原点作为球心,将大脑某一点与坐标原点的距离视为该点的高程。
本研究基于医学领域已臻成熟的MNI模板[14],将不同MRI影像置于统一的MNI空间,用该模板的坐标原点作为球心以计算高程,从而实现对不同MRI影像的对比研究。
大脑点云的坐标原点位于大脑中心,因此在大脑中心附近的高程较低,呈绿色;在大脑皮层中,脑沟的高程低于脑回的高程,在图上呈现出了红色到黄色的过渡趋势,反映了大脑高程由高转低的过程;大脑的前额以及枕叶部分距离原点较远,因此部分呈红色(图2C)。
(2)大脑点云经纬化
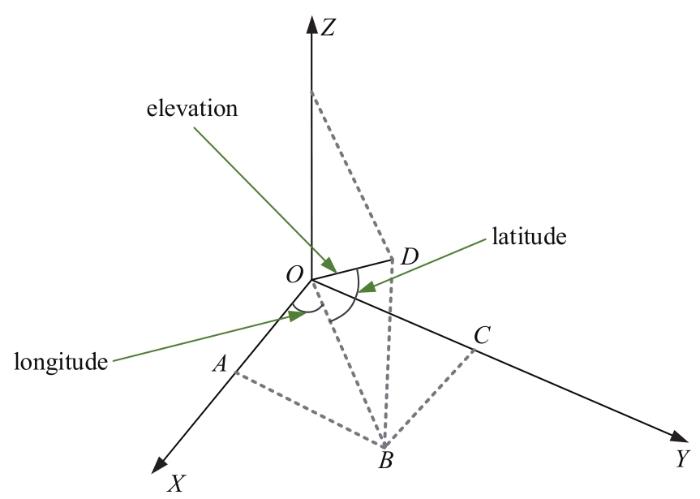
将大脑点云的三维坐标转换为经纬度坐标,是能够顺利进行后续分析的前提。如图3所示,某点的三维坐标转换为经度和纬度的过程具体如下:将该点与坐标原点的连线投影到XOY面上,以该投影线与X轴的夹角(∠XOB)作为经度,投影线与该点的坐标连线的夹角(∠DOB)作为纬度,OD连线长度即为高程。在MNI坐标系中,Y轴正方向指向前额,X轴正方向指向右脑,Z轴正方向指向顶叶;以此作为参考,将XOY面作为赤道面,Z轴正方向作为北半球方向,Z轴负方向作为南半球方向,以ZOY面与大脑在Y轴负方向的交线作为零度经线,以X正轴为东经方向,以X负轴为西经方向。具体的转换公式如下:
图3
图3
三维坐标转换经度及纬度示意图
Fig 3
Schematic diagram of 3D coordinates turning to longitude and latitude
式中,R代表的是高程值,lat代表纬度(latitude),lon代表经度(longitude)。在地学分析中,DEM属于栅格数据,栅格数据就是将空间分割成有规律的格网,每一个格网代表一个单元,并在各格网上赋予相应的属性值来表示实体的一种数据形式。每一个格网的位置由它的行列号定义,所表示的实体位置隐含在格网行列位置中。对于大脑DEM而言,需以高程值作为其属性值,但为进行后续的地学相关分析,研究还需确定其基本单元格网大小与行列信息,并为其基本单元格网确定唯一高程属性值。
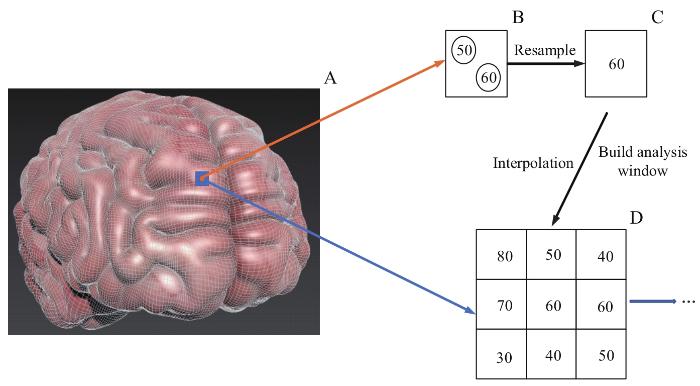
(3)构建基本格网单元
如图4A所示,根据经纬网分幅,基于360条经线、180条纬线,本研究将大脑共划分360×180个格网,从而确定大脑某点的位置信息。接着为每个基本格网单元确定唯一的高程属性值。如图4B、C所示,研究采用降采样的方法来解决格网单元高程数据的冗余问题,方法参考点云降采样的操作原理来判断每个体素中是否存在点,若存在,则用一个点代表该体素的值。图4B带圈数据即为落在同一单元内的所有点数据,取所有点中的高程最大值为该基本单元赋值;如图4C、D所示,对于基本单元没有值的情况,则采用线性插值法在格网范围内均匀分配数据[15],最终完成栅格数据的构建,即大脑DEM。最后基于所构建的大脑DEM,采用3×3的分析窗口提取地形因子并进行量化分析。
图4
图4
大脑格网化示意图
Note: A. The brain was divided according to longitude and latitude. B. Multiple points in the cell network. C. Cell net after downsampling. D. The final 3×3 analysis window.
Fig 4
Schematic diagram of brain grid
1.4 地形因子的选取
地形因子是一系列用于有效描述与揭示地貌形态特征的参数。本研究基于DEM信息源引入一系列地形因子将大脑皮层的外在形态进行量化描述,并结合皮层厚度传统指标,分析其随年龄、性别等变量的变化规律。
1.4.1 地形粗糙度
地形粗糙度(roughness)是反映地形表面粗糙程度的一个宏观指标,是地表单元的曲面面积与其在水平面上的投影面积之比。地形粗糙度越大,说明地形表面越粗糙;地形粗糙度越小,说明地形表面越平滑,其计算公式[16]为:
式中,R为粗糙度,S为坡度。
1.4.2 地形起伏度
地形起伏度(relief amplitude)是反映一个区域地形起伏特征的宏观指标,定义为在指定分析区域内所有栅格中最大高程值与最小高程值的差值。可用以下公式[17]表示:
式中,Q表示地形起伏度,
1.5 皮层厚度
1.6 统计学方法
采用SPSS 26.0软件进行统计学分析。正态分布的定量资料采用x±s描述,使用独立样本t检验进行2组间的差异性分析。协方差分析用于分析不同地形因子和分组的年龄差异结果,其中各因子均通过了主体间效应(组别×年龄)与Levene方差齐性检验。P<0.05表示差异有统计学意义。
2 结果
2.1 研究对象基本信息
研究对象基本信息如表1所示,AD组和NC组的MMSE值差异具有统计学意义(P<0.05),而年龄和性别的差异均无统计学意义。
表1 研究对象基本信息
Tab 1
| Item | AD (n=84) | NC (n=85) | χ2 /t value | P value |
|---|---|---|---|---|
| Gender/n | 0.006 | 0.940 | ||
| Male | 43 | 44 | ||
| Female | 41 | 41 | ||
| Age/year | 75.44±8.64 | 74.13±8.49 | 0.995 | 0.321 |
| MMSE/score | 22.87±3.09 | 29.12±1.15 | -17.394 | 0.001 |
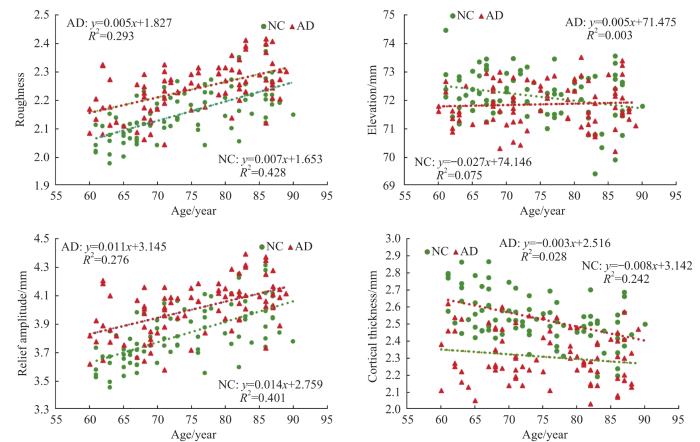
2.2 年龄差异
结合样本的总体分布散点图(图5)与各因子协方差分析表(表2),可得出以下结果:① 年龄组为探究协变量分析中协变量(年龄)与因子的线性回归是否具备统计学意义。由图5可知,随着年龄的增大,AD与NC的粗糙度数值都随之上升,且年龄与粗糙度之间的线性回归关系具有统计学意义(F=92.267,P=0.000)。因此,将年龄作为协变量进行方差分析是合理的。而2组间的差异具有统计学意义(P=0.000),说明AD能够影响大脑皮层的粗糙度。② 高程值随着年龄的增长,总体变化趋势并不明显,其线性回归关系不具有统计学意义(F=1.526,P=0.127),说明大脑高程对年龄的变化并不敏感。AD与NC组间高程值的差异具有统计学意义(P=0.033),说明AD能影响大脑皮层高程值。③ AD组与NC组的起伏度与年龄具有线性关系(F=84.103,P=0.000),且AD与NC均呈正相关关系。而2组间起伏度差异具有统计学意义(P=0.000),且其走势与粗糙度具有一定的相似性。④ 皮层厚度指标随着年龄的增加其数值总体上呈下降的趋势,AD组与NC组的皮层厚度与年龄具有线性回归关系(F=22.545,P=0.000);同时,2组在大脑皮层厚度上的差异也具有统计学意义(P=0.000)。⑤ 除去与年龄线性回归不具备统计学意义的高程因子,其余指标R2由高到低的排序为粗糙度、起伏度与皮层厚度,该现象同时存在于NC与AD组,且NC组的R2均大于AD组。
图5
表2 各因子协方差分析
Tab 2
| Item | NC | AD | Age-factor | Between-group | ||
|---|---|---|---|---|---|---|
| F value | P value | F value | P value | |||
| Roughness | 2.154±0.088 | 2.238±0.087 | 92.267 | 0.000 | 48.884 | 0.000 |
| Elevation/mm | 72.115±0.852 | 71.832±0.761 | 1.526 | 0.127 | 4.647 | 0.033 |
| Relief amplitude/mm | 3.828±0.193 | 4.002±0.187 | 84.103 | 0.000 | 42.894 | 0.000 |
| Cortical thickness/mm | 2.534±0.142 | 2.384±0.152 | 22.545 | 0.000 | 44.318 | 0.000 |
2.3 性别差异
由表3可知:① 对于粗糙度和起伏度而言,无论男女,AD与NC组间的粗糙度与起伏度差异均具有统计学意义(均P=0.000),表现出AD的均值大于NC,且男性的粗糙度均值皆大于女性。② 对于平均高程而言,男性的大脑平均高程指标在AD与NC组间的差异不具有统计学意义,而女性的大脑高程指标在AD与NC组间差异则有统计学意义(P=0.043),且男性的平均高程数值均要大于女性。③ 不同性别中皮层厚度在AD与NC组的组间差异均具有统计学意义(均P=0.000),且无论AD还是NC,女性的皮层厚度要比男性更厚。
表3 各因子性别分组对比
Tab 3
| Item | Male | Female | ||||||
|---|---|---|---|---|---|---|---|---|
| AD | NC | t value | P value | AD | NC | t value | P value | |
| Roughness | 2.254±0.085 | 2.166±0.091 | 4.626 | 0.000 | 2.221±0.087 | 2.140±0.083 | 4.284 | 0.000 |
| Elevation/mm | 71.929±0.811 | 72.132±0.821 | -1.159 | 0.250 | 71.730±0.701 | 72.096±0.894 | -2.060 | 0.043 |
| Relief amplitude/mm | 4.033±0.180 | 3.847±0.202 | 5.946 | 0.000 | 3.969±0.190 | 3.808±0.184 | 3.902 | 0.000 |
| Cortical thickness/mm | 2.344±0.158 | 2.475±0.115 | -4.514 | 0.000 | 2.426±0.142 | 2.597±0.141 | -5.476 | 0.000 |
2.4 左右半脑差异
各样本左右半脑的地形因子平均值见表4,结合该表可得出以下结果:① 对于NC组而言,粗糙度、起伏度与高程的左半脑指标普遍高于右半脑,差异具有统计学意义(均P<0.05)。② 对于AD组而言,只有高程的左右半脑指标差异具有统计学意义(P=0.000),而粗糙度与起伏度的差异并不具有统计学意义。
表4 左右半脑地形因子指标比较
Tab 4
| Item | Right brain | Left brain | t value | P value |
|---|---|---|---|---|
| Roughness | ||||
| NC | 2.139±0.085 | 2.169±0.097 | 2.171 | 0.031 |
| AD | 2.228±0.086 | 2.247±0.094 | 1.431 | 0.154 |
| Relief amplitude/mm | ||||
| NC | 3.788±0.189 | 3.868±0.216 | 2.574 | 0.011 |
| AD | 3.977±0.190 | 4.027±0.202 | 1.633 | 0.104 |
| Elevation/mm | ||||
| NC | 71.800±0.890 | 72.429±0.846 | -4.722 | 0.000 |
| AD | 71.513±0.780 | 72.151±0.779 | -5.309 | 0.000 |
3 讨论
目前,AD发病率呈逐年上升趋势。本研究拓展了DTA的理论和方法在大脑皮层形态研究中的应用,从地学角度深化了对大脑皮层形态变化规律和发育机制的认识,不仅为大脑皮层的建模和量化表达提供了新的视角和切入点,也为大脑皮层表面形态的研究提出了一种行之有效的方法。
基于本研究所得出的年龄差异结果进行分析后发现,粗糙度和起伏度均与年龄变化呈线性关系。其中,粗糙度用于描述物体表面局部范围内坡度的正割值,粗糙度越大,说明物体表面越粗糙,反之则亦然。粗糙度与年龄呈正相关,说明随着年龄的增大,大脑皮层愈发不平滑。而粗糙度在AD与NC组间的差异具有统计学意义,且AD组大于NC组,说明大脑皮层的粗糙度不仅受年龄的影响,也受AD病理因素的影响,即AD患者大脑皮层与同年龄段的正常人相比,大脑皮层表面更加粗糙。而起伏度用于描述局部范围内最大高程与最小高程之差,说明了物体表面起伏程度。研究[6-7]发现大脑皮层起伏度与年龄呈正相关关系,且该趋势与粗糙度相似,其主要的原因是粗糙度与起伏度都属于宏观地形因子。一般物体表面越不平滑,粗糙度与起伏度的数值便越高,而随着年龄的增加以及AD病情的加重,患者全脑范围内会出现萎缩现象,其脑回愈发不平滑以及脑沟加深变宽。受限于3×3的分析窗口,脑沟脑回形态改变同时会导致固定分析窗口内坡度和极差增大,这是造成粗糙度与起伏度变化趋势相似且均与年龄和病变程度呈正相关的主要原因。
高程是大脑皮层某点与MNI坐标系原点的距离,高程值的减少在一定程度上说明了大脑的萎缩情况。本研究发现,高程数据在AD组与NC组之间的差异具有统计学意义,这说明AD患者相较于NC而言,其大脑萎缩情况更加明显;而该指标对于年龄的变化并不敏感,猜测其主要原因可能是该指标在降采样步骤影响了精度,而样本中AD组的萎缩程度较年龄变化而言更加明显,表明该指标可能对AD的病理变化更为敏感。皮层厚度是大脑形态学的常用指标,根据研究结果可知,皮层厚度随着年龄的增加其数值总体上呈下降趋势,其主要原因可能是正常的衰老会使大脑皮层厚度变薄,这与PINI等[8]的结论一致;而AD患者的大脑皮层厚度要小于NC的皮层厚度,这说明AD会加剧大脑萎缩,并且使大脑皮层变薄,这与DU等[21]的研究结论一致。
基于本研究所得出的半脑差异结果进行分析后发现,NC组粗糙度与起伏度的左半脑指标均高于右半脑,这说明了左半脑对粗糙程度的反应更明显。对高程值而言,NC组与AD组左半脑的高程值均大于右半脑,说明了左半脑的脑容量相较于右半脑更大。这揭示了大脑的左右半脑并不是完全对称的,而是具有不对称性,这与TOGA等[24]的结论相一致。
本研究存在以下局限性。首先,研究范围基于全脑,没有针对局部病变区域展开具体分析,而发生大脑皮层形态变化的并不局限于AD,其他疾病也可能导致脑萎缩或大脑皮层形态改变。因此未来可以尝试对大脑不同分区进行研究,从而有针对性地探讨关于AD病变区域指标变化的规律性。其次,地学仍有许多描述地貌形态的指标,且不同分析窗口大小也可能带来不同的效果,研究尚未分析完全。
综上所述,本研究基于大脑起伏形态和大脑皮层曲折结构的耦合性,提出了大脑DEM的概念模型,从地学的角度对大脑皮层形态进行建模和表达,探究了地学视角下大脑地形指标的地学内涵,构建了基于DTA的大脑建模和表达的理论和方法体系。本研究成果能够有效量化和反映大脑皮层褶皱情况,有望为医学影像判读提供地学的辅助手段,并为通过机器学习进行AD相关诊断提供指标参数和科学基础。尽管研究仍处于初级阶段,但不可否认该研究的创新性与可行性。该方法是DTA方法和大脑皮层形态学的有机融合,也是DTA理论用于挖掘深层次医学问题的一次成功实践。
作者贡献声明
杨子豪主要完成方法研究、数据分析处理与文章撰写的工作,林偲蔚主要负责技术指导,陈楠主要负责总体研究思路和论文整体构思。所有作者均阅读并同意了最终稿件的提交。
YANG Zihao completed the work of method research and data analysis and wrote the manuscript. LIN Siwei was responsible for technical guidance. CHEN Nan designed and supervised the overall research ideas and the overall conception of the paper. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
参考文献