冠心病(coronary heart disease,CHD),又称冠状动脉性心脏病、缺血性心脏病,是世界范围内引起死亡的主要因素之一[1-2]。目前主要通过改变生活方式、药物治疗、介入治疗、冠状动脉旁路移植术(coronary artery bypass grafting,CABG)来改善CHD患者的症状。CABG使用自体动脉作为桥血管,可将血液转移到大动脉狭窄部位周围。常见桥血管包括乳内动脉、桡动脉和大隐静脉[3]。移植物的通畅率与CABG的成功直接相关。由于结构和功能上的差异,动脉移植物比大隐静脉移植物有更好的长期通畅率,具有明显的应用优势[4-5]。然而,自体动脉血管有获取不便以及动脉粥样硬化性疾病所致无法获得等问题[6]。
支架材料是构建组织工程血管的基础,包括高分子可生物降解聚合物材料以及脱细胞生物材料[7]。单种分子的高分子聚合物血管支架无法达到细胞外基质的复杂成分和结构,在体内容易形成血栓而导致堵塞[8]。脱细胞生物材料不仅保留了天然组织的多糖、蛋白、胶原等细胞外基质成分,还具有三维结构完整、力学适配以及生物活性等优点。生物血管经脱细胞后能够彻底去除细胞及DNA,降低了免疫原性。然而,虽然脱细胞血管免疫原性降低了,但血流流速降低会导致吻合口处的血栓形成及内膜增生[9],这是人工小血管移植后失败的最主要原因[10]。与大鼠相比,兔血管的血栓形成机制、通畅率和内皮化率[11]等与人类更相似。因此,为提高支架材料的血液相容性,使小口径组织工程血管保持长期通畅,本研究拟采用氟化脱细胞兔主动脉作为新型人工小血管进行体外实验,探索全氟化碳内膜涂层生物材料小口径组织工程血管的应用可能,以期为临床解决小口径人工血管提供依据。
1 材料与方法
1.1 实验动物、试剂与仪器
新西兰大白兔(安徽医科大学动物实验中心)18只,体质量2.5 kg左右,按清洁标准喂养。戊巴比妥钠[西格玛奥德里奇(上海)贸易有限公司],磷酸盐缓冲溶液(phosphate buffer saline,PBS;普诺赛),聚乙二醇辛基苯基醚[Triton X-100;柯意哲(上海)机电工程有限公司],脱氧胆酸钠(sodium deoxycholate,SD;上海麦克林生化科技有限公司),十二烷基硫酸钠(sodium dodecyl sulfate,SDS;上海麦克林生化科技有限公司),苏木精-伊红染色(hematoxylin-eosin staining,H-E染色)试剂盒(上海碧云天生物技术有限公司),Masson染色试剂盒及Verhoff-von Gieson染色试剂盒(珠海贝索生物技术有限公司),DNA酶(Worthington Biochemical Corporation,美国),RNA酶(Worthington Biochemical Corporation,美国),25%戊二醛溶液(赛默飞世尔科技公司,美国),4%多聚甲醛固定液(上海碧云天生物技术有限公司);场发射扫描电镜(field emission scanning electron microscope,FSEM;ZEISS GeminiSEM 300,卡尔蔡司,德国),临界点干燥仪(QUORUM K850,Quorum,英国),离子溅射仪(Cressington 108Auto,Cressingfton,英国)扫描电子显微镜(scanning electron microscope,SEM;JSM-5600LV,JEOL,日本),能谱仪(energy disperse spectroscopy,EDS;IE300X,Oxford,英国)等。
1.2 脱细胞血管制备及分组
利用戊巴比妥钠将兔麻醉,经腹中线剖开完全暴露腹主动脉,从髂总脉分支一直游离到膈肌下方;切开左侧胸肋骨,彻底暴露腹主动脉,将其游离;将主动脉上的各个分支结扎,分别夹闭主动脉近心端,将主动脉取下。用PBS液对主动脉灌洗4~5遍,冲去血管腔内血凝块,同时去除外表面多余结缔组织。
1.2.1 脱细胞组
脱细胞组(n=6)采用联合脱细胞法。首先进行脱细胞液准备,包括化学试剂溶液(0.375% SD、0.375%SDS、0.375%Triton X-100的PBS溶液)和生物酶制剂溶液(15 μg/mL RNA酶及150 μg/mL DNA酶的PBS溶液)[12]。
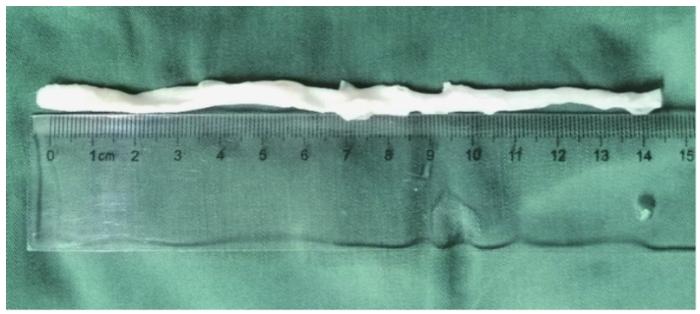
冲洗修剪好的兔血管置入化学试剂溶液内,放入4 ℃摇床中持续冲洗震荡48 h,每24 h更换脱细胞液1次,共2个循环。然后将血管置于生物酶试剂PBS溶液中,放入37 ℃摇床中持续冲洗震荡2 h。将处理完毕的血管(图1)放入PBS溶液中置4 ℃冰箱,在7 d内进行下一步实验。
图1
1.2.2 未脱细胞组
未脱细胞组(n=6)将上述方法中的脱细胞液全部替换为PBS缓冲液,其余处理方法同“1.2.1”。
1.2.3 氟化组
氟化组(n=6)脱细胞处理方法同“1.2.1”。随后对血管进行氟化涂层处理,处理方法见“1.4”。
1.3 血管组织学观察
分别在脱细胞组和未脱细胞组的血管远端部位取小块组织4%多聚甲醛固定,石蜡包埋后切片进行H-E染色、Masson染色及Verhoff-von Gieson染色,观察2组血管组织的形态学变化。同样在2组相同部位血管取小块组织用2.5%戊二醛溶液固定,脱水、浸泡、包埋、修块、超薄切片、镀金,用FSEM观察并拍照。
1.4 脱细胞兔主动脉的氟化处理
取脱细胞兔主动脉血管8段,放入-20 ℃冰箱中冷冻24 h,转至-80 ℃冰箱中冻干48 h。将1H,1H,2H,2H-全氟辛基三氯硅烷与无水乙醇配置成5% V/V溶液,将冷冻干燥后脱细胞血管浸于此溶液中1 h。随后捞起脱细胞血管,用无水乙醇和超纯水漂洗,然后用无水乙醇冲洗3次。氮气吹干后,在干燥剂存在下置烘箱(60 ℃)一夜,获得拴系全氟化碳(tethered perfluorocarbon,TP)涂层。将有TP涂层样本浸渍全氟萘烷后获得液态全氟化碳(liquid perfluorocarbons,LP)涂层;在浸涂法平衡时,全氟萘烷的含量为4~6 mL/cm2,最终获得栓系液态全氟化碳(tethered-liquid perfluorocarbon,TLP)含氟涂层血管。将未氟化处理脱细胞兔主动脉进行冷冻干燥处理与氟化血管进行比较。
取冷冻干燥脱细胞兔主动脉和氟化脱细胞兔主动脉,裁剪长宽为4 mm的样品。对血管内表面进行SEM测试,分析处理前后的血管内表面形貌结构;通过EDS定性且定量检测含氟涂层特征基团。确定处理后内膜涂层有效且稳定。
1.5 血管爆破压力测试
取脱细胞组、未脱细胞组和氟化组血管,在腹主动脉末端5 cm处,使用球囊扩张压力泵进行爆破压力测试。用注射器抽取适量的PBS溶液并连接上灌胃针,用5-0的缝线将样品的一端固定于灌胃针上,另一端同样固定,以防止泄漏。缓慢增加压力,直到发生破裂或泄漏。将爆破压记录为结构破坏或泄漏前的最大压力(图2)。
图2
1.6 氟化血管的疏水性测试
氟化血管的疏水性是通过血液在血管内表面的滚动性实验进行模拟来测试的。将5 cm长的氟化脱细胞和脱细胞兔主动脉沿轴向剖开,内表面朝上平整地固定于亚克力玻璃平板上,水平放置。将水滴在血管内表面,观察水滴的状态和维持时间。将平板倾斜45°,将水滴滴在血管内表面的上端,观察液体的流动情况并记录流动所需的时间。对比分析氟化内膜的疏水性及低表面能对液体流动的影响。
1.7 人工血管的血小板黏附试验
为检测经过氟化涂层修饰的人工血管的抗凝特性,我们对未氟化脱细胞血管和氟化内膜处理的脱细胞兔主动脉进行了血小板黏附试验。选择健康志愿者,抽取其静脉血30 mL,440×g离心10 min,吸取上层富含血小板的血浆(platelet-rich plasma,PRP)备用。采用扫描电镜观察血小板的黏附情况,将脱细胞组和氟化组的兔主动脉剪成大小一致的小块,置入含有5 mL PRP的离心管中,将离心管放入37 ℃孵箱中孵育1 h,对照观察。
1.8 统计学分析
采用SPSS 21.0软件进行统计学分析。定量资料采用x±s表示,组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 脱细胞血管的组织学表征
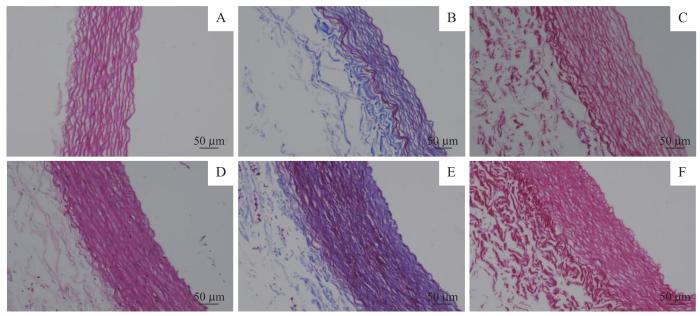
通过H-E染色、Masson染色以及Verhoff-von Gieson染色来观察联合脱细胞法的脱细胞效果以及胶原蛋白和弹性纤维情况(图3)。H-E染色显示未脱细胞组血管中存在大量细胞核,而脱细胞组血管中细胞被完全去除,且保留了完整的细胞外基质结构。通过Masson染色和Verhoff-von Gieson染色发现,血管经过脱细胞处理后保留了胶原蛋白纤维和弹性纤维,且未破坏纤维的结构。
图3
图3
脱细胞效果组织学观察(×200)
Note: A. H-E staining of the decellularized group. B. Masson staining of the decellularized group. C. Verhoff-von Gieson staining of the decellularized group. D. H-E staining of the undecellularized group. E. Masson staining of the undecellularized group. F. Verhoff-von Gieson staining of the undecellularized group
Fig 3
Histological observation of the decellularized group and non-decellularized group (×200)
2.2 血管FSEM扫描结果
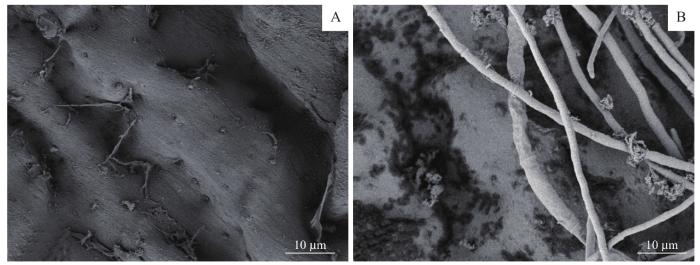
通过FSEM扫描观察血管的内腔表面,发现与对照组相比,经过脱细胞后的血管内膜表面去除了纤维蛋白,内膜表面较为光滑,未见细胞残留;而对照组血管腔内可见到较多的纤维及血管内皮细胞残留(图4)。
图4
图4
脱细胞组和未脱细胞组FSEM观察结果
Note: A. The decellularized vessel group. B The undecellularized vessel.
Fig 4
FSEM scanning electron microscopy observation in the decellularized and undecellularized group
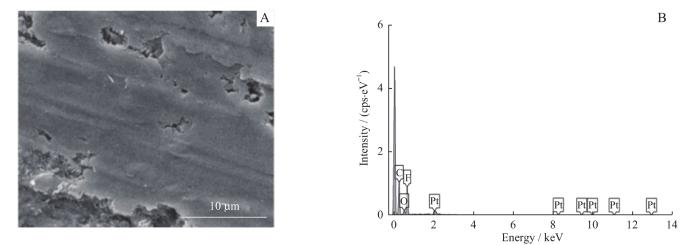
2.3 血管氟化涂层的表面结构分析
图5
图5
血管内含氟涂层的表面形貌结构和元素分析
Fig 5
Surface morphology and elemental analysis of fluorine-containing coatings in blood vessel
表1 含氟小血管内膜的元素分析
Tab 1
| C | 59.18 | 69.05 |
| O | 6.04 | 5.29 |
| F | 34.79 | 25.66 |
| 100.00 | 100.00 |
2.4 血管机械性能测试结果
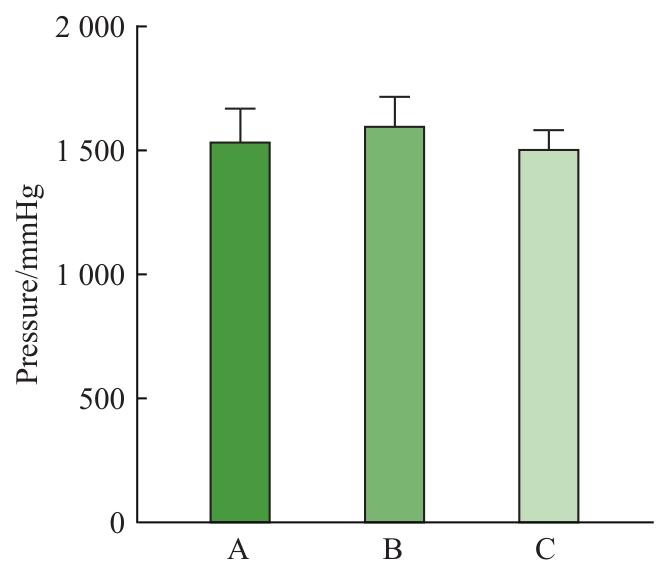
通过对3组血管爆破压力测试分析比较发现,脱细胞组[(1 580±91)mmHg]、未脱细胞组[(1 662±70)mmHg]和氟化组[(1 542±83)mmHg]间血管爆破压比较差异无统计学意义(图6,1 mmHg=0.133 kPa),说明脱细胞和氟化涂层并不会对血管的机械性能造成较大的影响。
图6
图6
血管压力爆破测试结果
Note: A. The decellularized group. B. The undecellularized group. C. The fluorinated group.
Fig 6
Results of the vascular pressure burst test
2.5 氟化内膜疏水性测试结果
脱细胞组的水滴在内膜表面呈现平铺状;氟化组的水滴停留在内膜表面呈现水滴状,水滴维持时间超5 min。平板倾斜45°时,脱细胞组的水滴在滑落过程中,水滴逐渐消散且留下明显水迹;相比之下,在氟化组中,水滴几乎立即从表面滑落。表明氟化内膜具有较低的表面能,具有一定疏水性(图7)。
图7
图7
血管内膜表面疏水性的结果
Note: A. Water dropped in the decellularized blood vessel group. B. Water dropped in the fluorinated blood vessel group. C. Water dropped in the fluorinated vessel group with a 45° tilt. E. Water dropped in the the decellularized vessel group with a 45° tilt.
Fig 7
Results of hydrophobicity of the intimal surface of the vessel
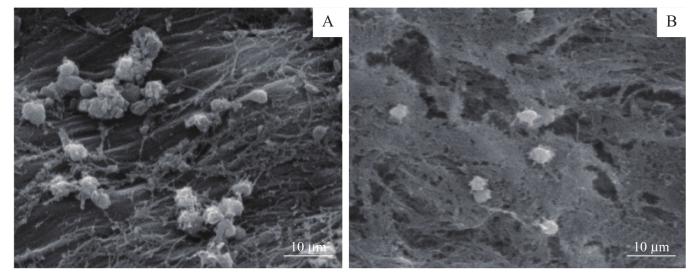
2.6 血小板黏附性试验结果
图8
图8
血管抗血小板黏附检测结果
Note: A. The decellularized vessel group. B. The fluorinated vessel group.
Fig 8
Results of the vascular antiplatelet adhesion test
3 讨论
大口径血管移植物在临床应用中的远期通畅率较好[13],而小口径人工血管由于容易造成血栓形成、内膜增生、顺应性降低和动脉瘤形成等因素而导致临床应用有限[14]。因此,在生物或合成材料开发的小口径血管移植中,移植血管的抗栓性是一个主要问题[15]。如何实现人工血管内膜的表面改性修饰,使其具有抗凝、抗血小板富集功能,对组织工程血管很关键[16]。本实验旨在研究内膜表面修饰的小口径组织工程血管。化学制剂可以有效去除细胞,但是会降低血管的生物活性,同时化学制剂残留会使其生物相容性降低。生物酶制剂可以特异性去除细胞和抗原成分,但会使蛋白质的微观结构产生不良影响[8]。本实验通过探究不同浓度化学制剂和生物酶制剂的复合脱细胞液来消除小口径异种动脉中的细胞外基质,在消除细胞成分的同时,尽可能保留血管的生物和力学性能。本研究在完全消除细胞的同时,保留了胶原纤维和弹性蛋白且结构并未破坏,拥有了维持机械性能的基础。在电镜下,脱细胞后的血管内膜表面依旧较为光滑,并未受到明显的损害(图4A)。
全氟化碳是一种碳原子数目超过6个,氢原子被氟原子完全取代的氟碳化合物,20世纪中叶即研制成功并作为化工、生物等领域的应用材料。全氟化碳的生物安全性已得到证明[17-18],是目前得到美国食品药品监督管理局许可应用于临床的化学类血氧载体。近来有研究发现,利用“液体束缚全氟化碳表面”的新型涂层技术,可以提高医用设备的表面光滑程度,减少血液在管道内的血栓形成,保持通畅性[19]。本研究利用脱细胞后的兔主动脉作为动脉化人工小血管支架,用全氟化碳涂层修饰脱细胞后血管内膜,制作了一种新型人工小血管。这种复合小血管具有与天然血管相似的细胞外基质结构和生物活性成分,有利于植入血管后的再生与重塑。氟化血管因为保留了胶原纤维完整性,使其力学强度几乎没有下降,从而保证了植入后血管动力学的稳定,并与宿主原位血管两端相匹配。此外,氟化血管的内层有致密、光滑、具一定疏水性的全氟化碳涂层,具有一定的抑制血小板聚集的能力。
综上,本研究提示了氟化脱细胞兔主动脉作为人工小血管的良好应用前景。未来我们将进行动物体内实验,进一步阐明此人工小血管内皮再生和抗血栓机制,并对复合血管在生物体内的长期变化进行研究。
作者贡献声明
龚文辉负责课题设计及指导;张如杰负责论文写作;张如杰、王建博、翁光东参与实验操作;雷东负责实验材料学设计与分析;周广东参与论文的修改。所有作者均阅读并同意最终稿件的提交。
GONG Wenhui was responsible for the design and guidance of the project. ZHANG Rujie was responsible for the writing of the paper. ZHANG Rujie, Wang Jianbo, and WENG Guangdong participated in the experimental operation. LEI Dong was responsible for the design and analysis of experimental materials, and Zhou Guangdong participated in the revision of the paper. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
All the authors declare no conflicts of interest.
参考文献