帕金森病(Parkinson′s disease,PD)是老年人中常见的神经衰退性疾病,我国65岁以上人群PD的患病率高达1.7%,其病理复杂且不可逆。其临床症状主要表现为震颤、动作迟缓、肌强直以及步态不稳等 [ 1]。该病是一种长期慢性病,且随着病程发展,病情不断恶化。目前尚无有效的预防措施阻止疾病的发生和进展,只能一定程度上减缓症状。该病严重影响患者的生活质量,给社会与居民造成沉重负担,已成为重大的公共卫生问题。该病的病理学标志为大脑灰质核团(主要是黑质)多巴胺神经元损失 [ 2],以及神经元内α突触核蛋白异常聚集 [ 3]。多项研究表明,PD患者的黑质以及基底节等灰质核团的铁含量高于正常人 [ 4],且随着病程增加,铁沉积越多 [ 5]。SIAN-HÜLSMANN等 [ 6]详细介绍了帕金森病中铁介导下的神经细胞坏死过程:黑质中过多的铁会引发过氧化氢与铁的芬顿反应(Fenton reaction),进而引起氧化应激(oxidative stress,OS),产生大量具有生物毒性的氧自由基(reactive oxygen species,ROS),导致神经细胞退化甚至坏死 [ 7]。目前,对于早期、晚期的PD均尚未有准确的诊断方法,只能依赖于临床评分——统一帕金森病评定量表(Unified Parkinson′s Disease Rating Scale,UPDRS)。因此,寻求准确有效的反映脑铁含量的影像学定量技术方法对帕金森病的诊断具有重要临床价值。
铁相对脑脊液具有一定顺磁性,在外磁场的作用下会产生附加磁场,因此引起信号相位离散,进而体现在弛豫时间和弥散时间的变化上。所以从原理上讲,测量脑铁含量的常规磁共振成像(magnetic resonance imaging,MRI)方法,如纵向弛豫时间(T1)、扩散张量成像(diffusion tensor imaging,DTI)、弛豫率(R2与R2*)以及相位(phase)等,只是间接反映了脑铁分布,并且还会受到水、组织环境以及铁分布不均匀等多重因素的影响,造成图像伪影 [ 8- 11]。与其他MRI技术相比,定量磁化率成像(quantitative susceptibility mapping,QSM)技术能更好地反映组织间的磁化率差异,能够直观体现人体磁化率分布,尤其是铁等磁性较强的金属物质,其组织对比更加明显,且可进行较为准确的定量分析 [ 12- 14]。得益于对磁化率变化的高敏感性,QSM可定量测量帕金森病患者灰质核团的磁化率平均值,进而反映脑铁含量 [ 15- 16]。然而有研究表明,PD病理可能与灰质核团结构的空间异质性变化有关 [ 17]。因此核团磁化率平均值可能会隐藏异质性信息,而图像的纹理特征可能有助于反映灰质核团的异质性信息。
基于上述文献分析,本研究推测:PD病理可能与灰质核团结构的空间异质性变化有关,而纹理分析方法能够提供更多隐藏在平均值中的异质性信息,故QSM的纹理分析方法能够提供更多有助于区分病灶与正常组织的磁化率信息,为QSM在评估PD中的应用提供更多参考信息。因此,本研究采用基于相位线性度拟合的磁化率定量成像技术,定量化PD脑铁含量,并结合纹理分析方法,多参数、多维度定量分析PD患者脑灰质核团磁化率分布特征,并结合临床评分评估纹理特征的敏感性,为临床诊断提供更多参考信息。
1 对象与方法
1.1 研究对象
该项研究已得到上海交通大学医学院附属仁济医院伦理委员会批准,且实验前要求被试认真阅读并签署磁共振检查知情同意书。对20名PD患者以及20名健康志愿者的磁共振数据进行回顾性分析。严格遵循国际通用的英国帕金森疾病协会脑库临床诊断标准(the criteria of the United Kingdom Brain Bank)筛选PD被试。PD被试的排除标准如下:① 有其他神经和精神疾病史。② 继发性PD患者。③ 非典型性PD患者。健康对照组的纳入标准如下:① 无神经性疾病、糖尿病、高血压病史。② 接受MRI常规疾病扫描检查以排除其他疾病。病程与运动障碍程度由一位运动障碍专家根据UPDRS-III评定。
1.2 扫描序列
在3T磁共振成像设备系统(德国西门子MAGNETOM Presmar 3T)上采集原始数据,采用20通道头线圈作为信号接收线圈。对三维多回波(gradient echo,GRE)序列参数进行以下优化,以期得到高信噪比、高对比度的数据:重复时间(repetition time,TR)=60 ms,第一回波时间(echo time,TE1)=6.0 ms,回波间隔(ΔTE)=6.0 ms,回波数(echo number,EN)=12,翻转角(flip angle,FA)=15˚,视野(field of view,FOV)=240 mm×180 mm,像素大小=0.5 mm×0.5 mm×2 mm,层数(slice)=96。为减少采样时间,在相位编码方向(被试左右方向)采用并行采样技术,加速因子为2。为避免个别被试患有脑血管疾病从而影响数据分析,对所有被试进行T1加权、T2加权以及FLAIR等常规序列的扫描,以筛查患有脑血管疾病的被试。扫描参数如下:① T1加权:TR=137 ms,TE=2.5 ms,FOV=220 mm×200 mm,像素大小=0.7 mm×0.7 mm×5 mm,层数=22。② T2加权:TR=3900 ms,TE=99 ms,FOV=220 mm×206 mm,像素大小=0.7 mm×0.7 mm×5 mm,层数=22。③ FLAIR:TR=8000 ms,TE=98 ms,FOV=220 mm×200 mm,像素大小=0.7 mm×0.7 mm×5 mm,层数=22。每名被试扫描时间总计13.5 min。
1.3 感兴趣区的选择
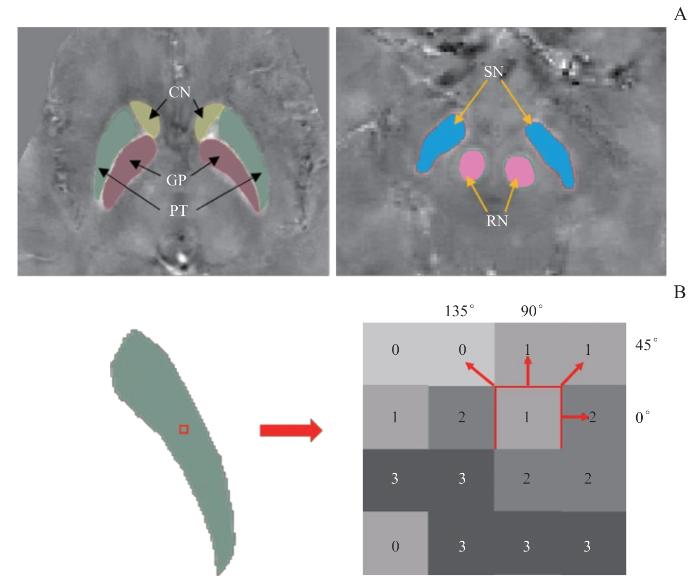
2名双盲研究者利用ITK-SNAP软件在QSM图上手动画出深灰质核团的感兴趣区(region of interest,ROI),分别为尾状核(caudate nucleus,CN)、苍白球(globus pallidus,GP)、壳核(PTamen,PT)、黑质(substantia nigra,SN)、红核(red nucleus,RN)( 图1)。
图1
图1
灰质核团感兴趣区定义示意图以及灰度游程矩阵的图示
Note: A. Regions of interest were manually drawn on transverse quantitative susceptibility images. B. Illustration of the process for generating gray-level run-length matrices, considering a 4×4 image represented with four gray-scale values ranging from 0 to 3. A single neighboring pixel (d=1) was considered along four possible directions—0°, 45°, 90°, and 135°—with in the same slice, and 0° in the Z-direction between slices.
Fig 1
Schematic representation of the definition of regions of interest in gray matter nuclei and an illustration of the generation of gray-level run-length matrices
1.4 基于灰度游程矩阵的纹理分析方法
灰度游程矩阵(gray level run-length matrix,GLRLM)特征是常用的纹理分析方法之一。该方法通过对灰度图像进行游程编码,来统计图像中连续相同灰度级别像素的长度和数量 [ 22]。使用MACKAY [ 22]报道的MaZda软件(
表1 基于 GLRLM的纹理参数的方程描述
Tab 1
| Feature | Description | Equation |
|---|---|---|
| RLNonUni | run length non-uniformity | |
| GLevNonU | gray-level non-uniformity | |
| LngREmph | long-run emphasis | |
| ShrtREmp | short-run emphasis | |
| Fraction | fraction of image in runs |
1.5 统计学分析
使用SPSS for Windows 23.0版(IBM SPSS Statistics,Chicago,IL)软件进行统计分析。人口统计学和临床特征描述为定量数据,以 x± s表示,使用Shapiro-Wilk正态性检验方法评估变量的正态性,使用单因素方差分析(one-way ANOVA)进行组间比较。定性数据以 n(%)表示,采用 χ2检验进行组间比较。为避免个体差异造成的误差,使用相对差值D(|PD-HC|/HC)作为最终统计值。采用双侧皮尔逊线性相关系数( r),以研究纹理参数与临床评分UPDRS-III的相关性。皮尔逊相关系数 r的绝对值范围分别为0.81~1.00(相关性良好)、0.51~0.80(相关性中等)、0.31~0.50(相关性一般)和≤0.30(相关性较差)。采用受试者工作特征(receiver operating characteristic,ROC)曲线对各定量参数在PD与HC的鉴别性进行特异性与敏感性分析。使用曲线下面积(area under the curve,AUC)评估纹理特征的预测能力。AUC的范围为0.5~1.0,AUC值越高则区分2组的能力越强。使用2名研究人员的组内相关系数(intra-class correlation coefficient,ICC)评估观察者之间的分割差异。ICC范围为0.81~1.00(相关性优秀)、0.61~0.80(相关性良好)、0.41~0.60(相关性中等)、0.21~0.40(相关性一般)和≤0.20(相关性较差)。 P<0.05表示差异具有统计学意义。
2 结果
2.1 基线资料
表2 受试者的人口统计信息
Tab 2
| Item | PD ( n=20) | HC ( n=20) | χ2/F value | P value |
|---|---|---|---|---|
| Age/year | 62.15±10.15 | 61.58±9.24 | 0.941 | 0.534 |
| Gender/ n(%) | 0.100 | 0.752 | ||
| Male | 11 (55.0) | 10 (50.0) | ||
| Female | 9 (45.0) | 10 (50.0) | ||
| Height/cm | 164.68±8.76 | 162.72±7.77 | 1.858 | 0.494 |
| Weight/kg | 71.17±8.84 | 60.83±10.23 | 2.049 | 0.152 |
| BMI/(kg·m -2) | 21.48±1.83 | 22.73±1.65 | 1.414 | 0.427 |
表3 PD患者 UPDRS评分
Tab 3
| Patient | UPDRS-III/score |
|---|---|
| 1 | 8 |
| 2 | 9 |
| 3 | 7 |
| 4 | 33 |
| 5 | 36 |
| 6 | 12 |
| 7 | 21 |
| 8 | 24 |
| 9 | 19 |
| 10 | 23 |
| 11 | 36 |
| 12 | 7 |
| 13 | 40 |
| 14 | 5 |
| 15 | 34 |
| 16 | 44 |
| 17 | 37 |
| 18 | 50 |
| 19 | 41 |
| 20 | 55 |
2.2 重测信度分析
ICC分析结果如 表4所示,显示了测量值的观察者间相关系数。所有指标的相关系数均为优秀(≥0.89)。
表4 组内、组间一致性评价
Tab 4
| Item | Measurement | Inter-reader correlation coefficient (95% CI) |
|---|---|---|
| Mean | Magnetic susceptibility value | 0.91 (0.88—0.95) |
| GLRLM feature | RLNonUni | 0.92 (0.88—0.97) |
| GLevNonU | 0.90 (0.87—0.95) | |
| LngREmph | 0.91 (0.85—0.95) | |
| ShrtREmp | 0.93 (0.89—0.94) | |
| Fraction | 0.89 (0.86—0.92) |
2.3 纹理多参数分析
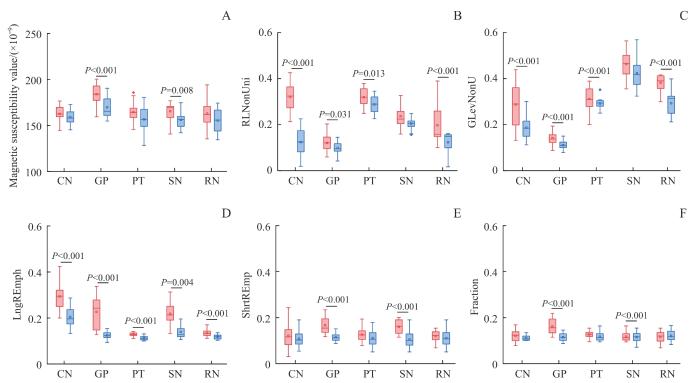
表5为各核团的GLRLM纹理参数和磁化率均值在PD组与HC组中的比较结果。2组灰质核团的磁化率平均值比较结果( 图2)显示,在GP和SN核团,PD组的磁化率平均值显著高于HC组,而其他灰质核团未发现2组磁化率平均值有显著性差异。而纹理特征参数分析表明,PD组与HC组在灰质核团存在诸多差异性:PD组的RLNonUni在CN、GP、PT以及RN核团中均显著高于HC组,PD组的GLevNonU在CN、GP、PT以及RN核团中均显著高于HC组,PD组的LngREmph在CN、GP、PT、SN以及RN核团中均显著高于HC组,PD组的ShrtRenp在GP以及SN核团中均显著高于HC组,PD组的Fraction特征在GP以及SN核团中均显著高于HC组。特别地,在GLRLM的所有纹理特征参数中,LngREmph在所测量的5个灰质核团中,均显示PD组与HC组具有显著性差异。
图2
图2
磁化率的平均值和纹理参数的相对 D值的比较
Note: A. Mean values of magnetic susceptibility. B. RLNonUni. C. GLevNonU. D. LngREmph. E. ShrtREmp. F. Fraction. Red is the PD group, and blue is the HC group.
Fig 2
Comparisons of mean values of magnetic susceptibility and the relative D values of texture parameters
表 5 PD组与 HC组纹理参数与磁化率均值的比较
Tab 5 Comparisons of texture parameters and mean magnetic susceptibility values in the PD and HC groups
| Gray Matter Nuclei | Measurement | PD ( n=20) | HC ( n=20) | P value | |
|---|---|---|---|---|---|
| CN | Mean | Magnetic susceptibility value/(×10 -9) | 162.58±8.97 | 158.95±7.25 | 0.178 |
| GLRLM feature | RLNonUni | 0.32±0.06 | 0.12±0.06 | <0.001 | |
| GLevNonU | 0.29±0.09 | 0.19±0.05 | <0.001 | ||
| LngREmph | 0.29±0.12 | 0.21±0.08 | <0.001 | ||
| ShrtREmp | 0.12±0.06 | 0.11±0.03 | 0.406 | ||
| Fraction | 0.12±0.02 | 0.11±0.01 | 0.089 | ||
| GP | Mean | Magnetic susceptibility value/(×10 -9) | 183.95±10.50 | 169.73±10.83 | <0.001 |
| GLRLM feature | RLNonUni | 0.11±0.06 | 0.10±0.03 | 0.031 | |
| GLevNonU | 0.14±0.03 | 0.11±0.02 | <0.001 | ||
| LngREmph | 0.19±0.09 | 0.12±0.02 | <0.001 | ||
| ShrtREmp | 0.16±0.04 | 0.11±0.02 | <0.001 | ||
| Fraction | 0.16±0.03 | 0.11±0.02 | <0.001 | ||
| PT | Mean | Magnetic susceptibility value/(×10 -9) | 164.71±12.16 | 156.66±13.63 | 0.063 |
| GLRLM feature | RLNonUni | 0.31±0.06 | 0.29±0.04 | 0.013 | |
| GLevNonU | 0.32±0.04 | 0.29±0.02 | <0.001 | ||
| LngREmph | 0.13±0.02 | 0.11±0.01 | <0.001 | ||
| ShrtREmp | 0.13±0.03 | 0.11±0.04 | 0.178 | ||
| Fraction | 0.13±0.01 | 0.11±0.02 | 0.126 | ||
| SN | Mean | Magnetic susceptibility value/(×10 -9) | 165.04±10.50 | 156.19±8.89 | 0.008 |
| GLRLM feature | RLNonUni | 0.24±0.06 | 0.22±0.06 | 0.057 | |
| GLevNonU | 0.46±0.06 | 0.42±0.03 | 0.064 | ||
| LngREmph | 0.16±0.05 | 0.14±0.05 | 0.004 | ||
| ShrtREmp | 0.15±0.03 | 0.11±0.04 | <0.001 | ||
| Fraction | 0.16±0.02 | 0.12±0.02 | <0.001 | ||
| RN | Mean | Magnetic susceptibility value/(×10 -9) | 162.98±14.46 | 155.31±12.73 | 0.091 |
| GLRLM feature | RLNonUni | 0.19±0.11 | 0.12±0.04 | <0.001 | |
| GLevNonU | 0.39±0.02 | 0.26±0.04 | <0.001 | ||
| LngREmph | 0.13±0.05 | 0.13±0.03 | <0.001 | ||
| ShrtREmp | 0.12±0.03 | 0.11±0.04 | 0.441 | ||
| Fraction | 0.12±0.02 | 0.12±0.02 | 0.528 | ||
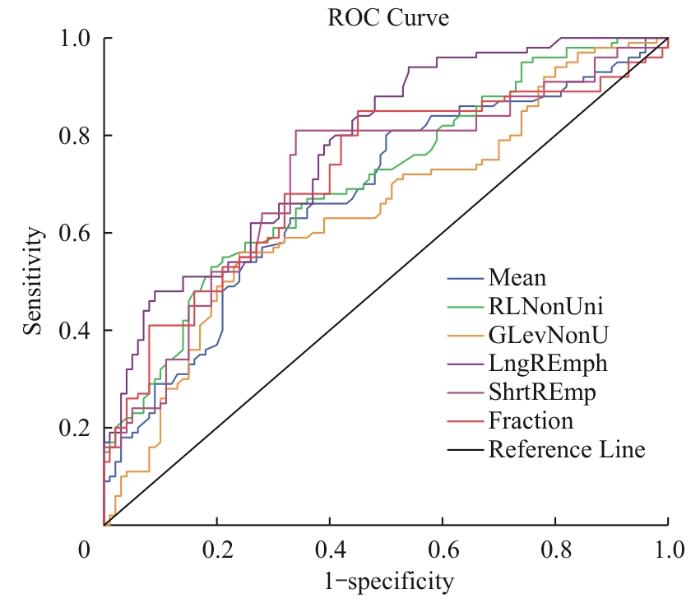
2.4 受试者工作特征曲线分析
表6 PD组与 HC组之间纹理参数和平均磁化率值的 ROC曲线分析结果
Tab 6
| Item | Measurement | AUC | P value |
|---|---|---|---|
| Mean | Magnetic susceptibility value | 0.678 | <0.001 |
| GLRLM feature | RLNonUni | 0.708 | <0.001 |
| GLevNonU | 0.646 | <0.001 | |
| LngREmph | 0.777 | <0.001 | |
| ShrtREmp | 0.714 | <0.001 | |
| Fraction | 0.716 | <0.001 |
图3
图3
PD组与 HC组之间纹理参数和平均磁化率值的受试者工作特征曲线
Note: The average magnetic susceptibility of gray matter nuclei and GLRLM texture parameters denonstrate a good ability to distinguish PD from HC (AUC>0.5), among which the AUC values of RLNonUni, LngREnch, ShrtRImp, and Fraction are all greater than that of the average magnetic susceptibility. PD, Parkinson′s disease; HC, healthy controls.
Fig 3
Receiver operating characteristic curves of texture parameters and average magnetic susceptibility values between the PD group and HC group
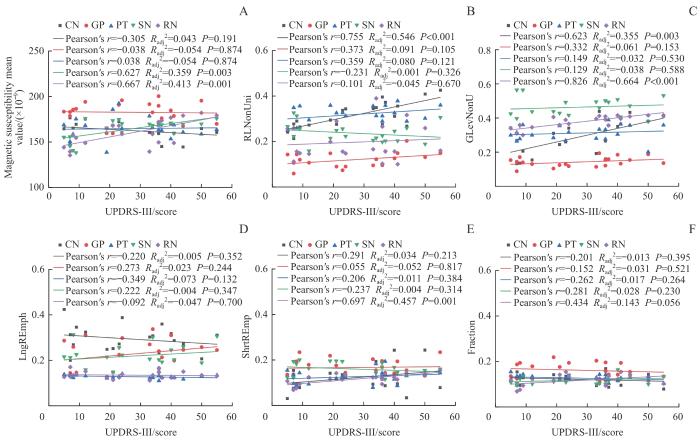
2.5 特征参数与临床评分的相关性分析
与PD患者临床评分UPDRS-III的相关性分析结果( 表7、 图4)显示,只有SN与RN的平均磁化率值与UPDRS-III评分具有一定相关性(SN: r=0.627, P=0.003;RN, r=0.667, P=0.001),其余灰质核团磁化率均值与UPDRS-III均没有显著相关性。各灰质核团的GLRLM纹理特征参数与UPDRS-III评分的相关性分析结果显示,CN的RLNonUni( r=0.755, P<0.001)和GLevNonU( r=0.623, P=0.003)以及RN的GLevNonU( r=0.826, P<0.001)和ShrtRenp( r=0.697, P=0.001)均与UPDRS-III评分具有显著相关性,其余特征参数未发现显著临床评分相关性。
表7 PD组平均磁化率值和纹理特征与 UPDRS-III评分之间的相关性
Tab 7
| Gray Matter Nuclei | Measurement | r | radj2 | P value | |
|---|---|---|---|---|---|
| CN | Mean | Magnetic susceptibility | -0.305 | 0.043 | 0.191 |
| GLRLM feature | RLNonUni | 0.755 | 0.546 | <0.001 | |
| GLevNonU | 0.623 | 0.355 | 0.003 | ||
| LngREmph | -0.220 | -0.005 | 0.352 | ||
| ShrtREmp | 0.291 | 0.034 | 0.213 | ||
| Fraction | -0.201 | -0.013 | 0.395 | ||
| GP | Mean | Magnetic susceptibility | -0.038 | -0.054 | 0.874 |
| GLRLM feature | RLNonUni | 0.373 | 0.091 | 0.105 | |
| GLevNonU | 0.332 | 0.061 | 0.153 | ||
| LngREmph | 0.273 | 0.023 | 0.244 | ||
| ShrtREmp | 0.055 | -0.052 | 0.817 | ||
| Fraction | -0.152 | -0.031 | 0.521 | ||
| PT | Mean | Magnetic susceptibility | 0.038 | -0.054 | 0.874 |
| GLRLM feature | RLNonUni | 0.359 | 0.080 | 0.121 | |
| GLevNonU | 0.149 | -0.032 | 0.530 | ||
| LngREmph | -0.349 | 0.073 | 0.132 | ||
| ShrtREmp | 0.206 | -0.011 | 0.384 | ||
| Fraction | -0.262 | 0.017 | 0.264 | ||
| SN | Mean | Magnetic susceptibility | 0.627 | 0.359 | 0.003 |
| GLRLM feature | RLNonUni | -0.231 | 0.001 | 0.326 | |
| GLevNonU | 0.129 | -0.038 | 0.588 | ||
| LngREmph | 0.222 | -0.004 | 0.347 | ||
| ShrtREmp | -0.237 | 0.004 | 0.314 | ||
| Fraction | 0.281 | 0.028 | 0.230 | ||
| RN | Mean | Magnetic susceptibility | 0.667 | 0.413 | 0.001 |
| GLRLM feature | RLNonUni | 0.101 | -0.045 | 0.670 | |
| GLevNonU | 0.826 | 0.664 | <0.001 | ||
| LngREmph | -0.092 | -0.047 | 0.700 | ||
| ShrtREmp | 0.697 | 0.457 | 0.001 | ||
| Fraction | 0.434 | 0.143 | 0.056 | ||
图4
图4
PD组平均磁化率值和纹理特征与 UPDRS-III评分之间的相关性
Note: Only the mean magnetic susceptibility values of SN and RN showed a certain correlation with UPDRS-III scores, while the average magnetic susceptibility values of other gray matter nuclei were not significantly correlated with UPDRS-III. RLNonUni and GLevNonU in the CN, as well as GLevNonU in the RN, were significantly correlated with UPDRS-III scores. No significant correlation with clinical scores was found for other texture parameters.
Fig 4
Correlations of GLRLM texture parameters with UPDRS-III scores in the PD group
3 讨论
PD患者脑灰质核团的磁化率定量测定一直是近年来研究的热点之一,而灰质核团磁化率图的异质性是影响其定量测定的关键,也受到越来越多的关注。本研究根据磁化率图各核团的异质性特征,采用基于GLRLM的纹理多参数分析方法,并结合临床评分,验证了GLRLM纹理参数在PD的鉴别诊断中的价值。
本研究发现,在GLRLM的5个主要特征参数中,LngREmph在PD组的各灰质核团中均显著高于HC组( 图2D)。这一结果可能与灰质核团磁化率图像中灰度强度值的均匀性有关,高LngREmph值表示非均匀纹理,即异质性 [ 23],表明在磁化率分布图上PD组的各灰质核团均具有较高异质性。在2组核团磁化率均值的比较中,GP与SN的磁化率均值具有显著性差异,即PD组显著高于HC组,这与以往的研究结果一致 [ 21]。而在磁化率图纹理特征参数的比较中,相较于SN,GP表现出更高的游程长度不均匀性、灰度级不均匀性以及颗粒度等特性,这表明GP核团可能在磁化率分布方面具有更高的异质性。并且在所统计的PD相关的5个主要灰质核团中,GP的各个GLRLM纹理特征均显著高于HC组,表明PD组的GP在磁化率分布图上具有较高图像不均匀性与颗粒度,这可能与PD患者的GP核团中铁沉积造成的局部磁化率不均匀有关 [ 24]。
相较于传统的灰质核团的磁化率平均值,GLRLM纹理参数能够更好地区分出PD。受试者工作曲线结果表明RLNonUni、LngREmph、ShrtREmp以及Fraction均具有比磁化率平均值更敏感的特性,尤其是LngREmph,在所有GLRLM纹理特征中对PD表现出较高敏感性与特异性。CHENG等 [ 20]关于PD患者黑质核团磁化率图纹理特征分析结果表明,LngREmph在描述较低灰度值的长程长度时能够区分特发性PD与健康对照组。本研究的结果还表明在5个GLRLM纹理特征参数中,GLevNonU区分PD与HC的敏感性较低(AUC=0.646);然而CHENG等人的研究结果中GLevNonU反而表现出较高敏感性。这可能由于CHENG等人仅统计了黑质核团的磁化率图纹理特征,没有统计其他深灰质核团。以往关于PD的研究大多集中在黑质,近年来其他深灰质核团才逐渐引起研究者的注意。有研究表明除黑质外,其他深灰质核团的铁沉积同样对PD具有重要影响 [ 25- 27],本研究对与PD相关的五大深灰质核团的磁化率GLRLM纹理特征分析表明,五大核团在不同纹理特征上表现出不同的敏感性,尤其是GP,在各个GLRLM纹理特征中均能显著区分出PD与HC,这在以往研究中鲜有关注。
在与临床评分相关性结果中,黑质和红核的磁化率平均值与UPDRS-III评分具有一定相关性( r分别为0.627、0.667),表明黑质和红核的铁沉积与PD的临床症状具有一定相关性,这与以往研究结果一致,即黑质与红核的铁沉积是影响PD患者临床症状的主要因素之一 [ 28- 29]。而GLRLM纹理参数与UPDRS-III评分相关性结果中,尾状核的纹理参数例如GLevNonU,尤其是RLNonUni,均与UPDRS-III评分具有较高相关性( r分别为0.623、0.755);红核的GLevNonU与UPDRS-III评分的高相关性( r=0.826),可能表明红核的磁化率分布图的灰度级不均匀性一定程度上可以反映PD患者的临床症状表现。这一结果提示本研究除了关注灰质核团的磁化率平均值外,灰度图像的纹理特征可能提供更多信息辅助诊断。
本研究存在几个局限性:① 受试者数量相对较少,因此需要鼓励大型随机临床试验。② 在今后的进一步研究中,应综合考虑采集参数、预处理步骤、重建算法和分析参数对纹理信息的影响。③ 本研究没有进行组织学分析。未来的研究应增加组织学数据,以支持纹理参数的组织水平基础。④ 应进行敏感性或亚组分析,以调查不同的参与者特征(如年龄、性别或研究开始时骨关节炎的严重程度)如何影响治疗结果。⑤ 应对比QSM和纹理分析在评估PD患者脑磁化率分布的差异,用以全面评估纹理分析在PD诊断中的应用价值。
综上所述,本研究采用基于GLRLM的纹理分析方法评估了PD患者脑磁化率分布的空间特性,相较于灰质核团磁化率平均值,GLRLM纹理特征参数能够更好地从健康对照组中区分出PD。该方法是QSM技术在多参数定量脑铁含量方面的一个新思路,可为PD的无创诊断提供更多维度的定量信息。
作者贡献声明
赵欣欣负责研究设计、数据分析、撰写论文、审阅并修改;裴孟超负责数据收集与方法学分析。作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
ZHAO Xinxin designed this research. PEI Mengchao participated in data collection and supported the methodological analysis. This article was written, reviewed and revised by ZHAO Xinxin. Both authors have read the final version of paper and approved submission.
利益冲突声明
作者声明不存在利益冲突。
COMPETING INTERESTS
Both authors disclose no relevant conflict of interests.
参考文献