结核病(tuberculosis,TB)是一种慢性传染病,由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起,是全球十大疾病死因之一。2023年,在30个结核病高负担国家中,我国发病数估算排第3位,结核病患者占全球结核病患者总人数的6.8%[1]。巨噬细胞是免疫系统抵御Mtb的第一道防线,在Mtb感染巨噬细胞时,巨噬细胞免疫代谢及抗原提呈功能发生改变,进而影响巨噬细胞存活及胞内Mtb生长[2]。Mtb在人体内的感染进程与机体的免疫识别及应答机制存在密切联系,宿主对结核病的保护性免疫应答是基于先天免疫细胞反应,并协同活化巨噬细胞与特异性T细胞之间的相互作用[3]。目前基于免疫调控的结核病治疗策略已成为抗感染研究的重要方向。
传统藏药红景天(Rhodiola rosea),为蔷薇目景天科红景天属多年生草本或亚灌木野生植物,用于治疗肺病古已有之。红景天最早见于藏医经典著作《四部医典》,藏药名为“索罗玛布”,具有“性凉、清热、滋补元气”的功效,能“治血病、赤巴病、疮疖溃烂”[4]。现代研究表明红景天具有体外抗结核作用[5]。临床试验表明红景天能明显改变肺结核患者的细胞免疫功能,加快肺部病变的吸收速度[6]。红景天苷(salidroside, SAL)作为其主要有效成分,具有抗肿瘤、抗炎、抗氧化、调节机体免疫功能等作用[7]。研究发现SAL可通过调节小鼠体液免疫及细胞免疫发挥免疫佐剂作用[8]。SAL能够提高巨噬细胞吞噬能力,也可能通过促进诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达,刺激NO的合成和释放,从而调节免疫,提高免疫细胞的杀伤活性[9]。SAL调控Mtb感染巨噬细胞免疫功能的机制目前尚未清晰,本研究利用卡介苗(Bacille Calmette-Guérin,BCG)感染的RAW264.7小鼠巨噬细胞模型,探索SAL对BCG感染的巨噬细胞的免疫调节作用及其机制,为评价SAL的抗Mtb作用提供科学依据。
1 材料与方法
1.1 实验材料与主要试剂
1.1.1 细菌与细胞
BCG、小鼠单核巨噬细胞(RAW264.7)为本实验室自存。增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的质粒通过电转至BCG构建表达绿色荧光蛋白的BCG(BCG expressing green fluorescent protein,BCG-GFP)。
1.1.2 主要试剂
SAL购自成都瑞芬思德丹生物科技有限公司,异烟肼(isoniazid,INH)购自上海阿拉丁试剂有限公司;Middlebrook 7H9 Broth(以下简称7H9)肉汤培养基、Middlebrook 7H11 Agar(以下简称7H11)琼脂培养基、油酸-白蛋白-葡萄糖-过氧化氢酶(oleic acid-albumin-dextrose-catalase,OADC)增菌液购自青岛海博生物技术有限公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、小鼠γ-干扰素(interferon-γ,IFN-γ)、小鼠白介素-6(interleukin-6,IL-6)、小鼠IL-10酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒均购自江苏酶免实业有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、胎牛血清(fetal bovine serum,FBS)和DMEM高糖基础培养基均购自武汉普诺赛生命科技有限公司;Annexin V-APC/7-AAD凋亡试剂盒购自杭州联科生物技术股份有限公司(AP105);噻唑蓝(methylthiazolyldiphenyl tetrazolium bromide,MTT)、二甲基亚砜(dimethylsulfoxide,DMSO)均购自北京博奥拓达科技有限公司。
1.2 方法
1.2.1 细胞与细菌的培养
将RAW264.7细胞置于完全培养基(含有10% FBS的DMEM高糖基础培养基)中,在37 ℃、相对湿度为95%以上、5% CO2培养箱中培养,当细胞密度达到70%~80%时进行传代。将冻存的BCG菌株取10 μL,接种于含10% OADC增菌液的7H9液体培养基中,置于37 ℃恒温摇床,以0.1×g的离心力振荡培养,经2~3周连续培养后可见培养基浑浊。待细菌生长状况良好后,每周液体传代1次。选择对数生长期的菌株进行后续实验。
1.2.2 BCG感染巨噬细胞
选择对数生长期的BCG制备BCG单细菌菌液,利用紫外分光光度计计算细菌浓度,用7H9肉汤培养基调零,测细菌悬液的吸光度(D)值,计算菌液菌落形成单位(colony-forming unit,CFU)。D (600 nm)=0.1时,菌液浓度为1×107 CFU/mL。当RAW264.7细胞稳定生长至80%时,确定感染复数(multiplicity of infection,MOI)。以MOI=10(BCG∶细胞=10∶1)对细胞进行感染,充分混匀后置于培养箱中孵育4 h后弃上清,以预温的PBS洗涤3次,每次洗涤5 min以去除未进入细胞内的细菌,荧光显微镜下观察或用无菌水裂解细胞后,取适量裂解液接种至7H11琼脂培养基表面,3~4周后观察是否有菌落生长。在荧光显微镜下看到绿色荧光的BCG或7H11琼脂培养基有菌落生长,感染模型构建即为成功,用此模型进行后续实验。
1.2.3 药物溶液配制
将SAL和INH用PBS分别配置成16 mmol/L和5 mmol/L的高浓度药物母液,经0.22 μm的滤膜过滤后分装并于-20 ℃保存,1个月内使用。实验前将分装的药物母液于4 ℃平衡1 h,用完全培养基稀释至实验所需终浓度,用于后续实验。
1.2.4 MTT比色法
调整细胞密度至1×105个/mL,每孔分配100 μL细胞悬液,种于96孔细胞培养板中,在37 ℃、5% CO2、饱和湿度的培养箱中培养24 h。将不同浓度的SAL(1、25、50、100、200、400、800、1 600 μmol/L)和INH(5、10、25、50、75、100、125、150 μmol/L),每孔100 μL,分别加入96孔细胞培养板中,剩余1列不加药物作为空白对照组。培养24 h后每孔加入10 μL浓度为5 mg/mL的MTT溶液,继续37 ℃培养箱孵育4 h后,用移液器小心吸弃细胞培养板上清,避免吸取底部甲瓒结晶,每孔加入150 μL DMSO充分溶解结晶,以λ=490 nm处的吸光度测算MTT并分析细胞存活率。
1.2.5 分组
实验分为4组,即空白对照组(BCG组)、红景天苷组(SAL+BCG组)、异烟肼组(INH+BCG组)及红景天苷+异烟肼组(SAL+INH+BCG组)。实验组均在感染前用相应药物预处理巨噬细胞36 h。
1.2.6 胞内细菌生存率
在BCG感染4、24 h后吸弃孔内培养基,向细胞培养板中加入0.5%Triton X-100或无菌纯水以裂解巨噬细胞并释放胞内细菌。取裂解液用7H9肉汤培养基分别进行100倍及1 000倍稀释,各吸取100 μL稀释液以无菌玻璃珠滚动辅助铺板,使菌液均匀涂布于7H11琼脂培养基表面,将培养平板用封口膜密封后,置于37 ℃培养箱中培养3周;在BCG感染4、24 h后吸弃细胞培养上清,收集孔内细胞,用预冷PBS清洗2次,用500 μL PBS将细胞重悬于流式检测管中,用流式细胞仪进行检测,用GFP通道检测胞内BCG的存活率。
1.2.7 流式细胞术检测巨噬细胞凋亡
分别在BCG感染巨噬细胞4、24 h后用移液器轻柔吹打收集细胞,4 ℃、500×g离心5 min,弃上清。使用预冷的PBS溶液对细胞进行2次洗涤,加入500 μL 1×Binding Buffer重悬细胞。设置Annexin V-APC和7-AAD单染组以及未染色细胞组,用于检测时电压参数的调节和后续补偿调节。每管细胞悬液中依次加入5 μL Annexin V-APC和10 μL 7-AAD,涡旋振荡混匀,室温避光孵育5 min后,转移至流式检测管中,使用流式细胞仪进行上机检测,用FlowJo软件进行荧光补偿校正及细胞凋亡定量分析。
1.2.8 ELISA
分别在BCG感染巨噬细胞4、24 h后收集各组细胞培养上清液,4 ℃,500×g离心5 min,以去除上清中细胞碎片、蛋白质及微小颗粒等。采用ELISA法检测细胞培养上清中TNF-α、IFN-γ、IL-6、IL-10的水平,严格根据试剂盒说明书要求进行操作。用未加样本和酶标剂的空白孔调零,加入终止剂后15 min内,在λ=450 nm处读取标准品及样本的吸光度数值,使用标准品吸光度绘制标准曲线,统计并分析样本细胞因子水平。
1.3 统计学分析
采用GraphPad Prism 9.5.0软件进行统计学分析。符合正态分布的定量数据以x±s表示。2组间比较采用t检验,多组间比较采用单因素/双因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 SAL和INH对RAW264.7细胞增殖的影响
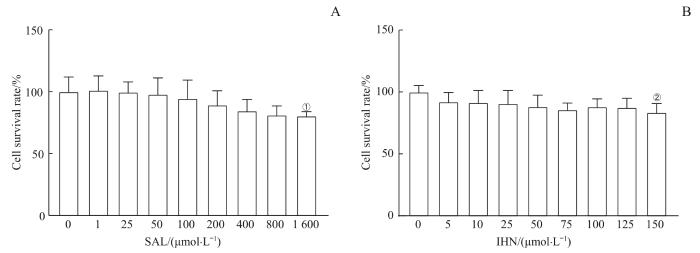
用不同浓度的SAL(1、25、50、100、200、400、800、1 600 μmol/L)和INH(5、10、25、50、75、100、125、150 μmol/L)处理RAW264.7细胞,MTT法检测SAL和INH对RAW264.7细胞增殖的影响,筛选SAL及INH的安全给药浓度。结果显示:800 μmol/L及以下的SAL对RAW264.7细胞无毒性作用,1 600 μmol/L的SAL使RAW264.7细胞活性显著下降(P=0.043),表明该浓度的SAL对RAW264.7细胞有一定的毒性(图1A);与空白对照组相比,125 μmol/L及以下的INH对RAW264.7细胞活性无显著影响(图1B)。查阅相关文献[10-11]并结合本实验结果,选择SAL给药浓度为800 μmol/L、INH给药浓度为10 μmol/L进行后续实验。
图1
图1
SAL和INH对RAW264.7细胞增殖的影响
Note: A. MTT assays were used to detect the proliferation of RAW264.7 cells with SAL treatment. B. MTT assays were used to detect the proliferation of RAW264.7 cells with INH treatment. ①P=0.043,②P=0.024, compared with the control group.
Fig 1
Effect of SAL and INH on the proliferation of RAW264.7 cells
2.2 SAL对BCG感染巨噬细胞胞内细菌存活率的影响
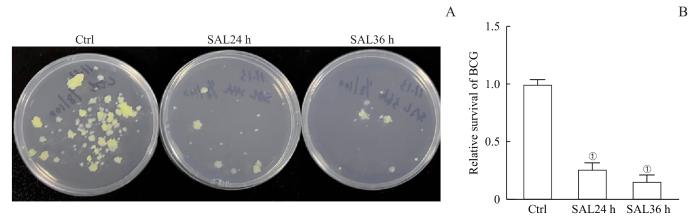
为探究SAL在BCG感染巨噬细胞中的作用,首先验证SAL是否有直接抗结核作用,即在BCG感染后24 h检测SAL对巨噬细胞内BCG生长与存活的影响。细菌铺板计数结果发现与Ctrl组相比,在BCG感染前24、36 h用SAL对巨噬细胞进行预处理,均能够显著抑制巨噬细胞内BCG的存活率,且SAL预处理36 h对BCG胞内存活抑制作用更为显著(图2)。基于上述结果,本研究采用感染前36 h药物预处理进行后续研究。
图 2
图 2
不同时间SAL预处理对BCG感染的巨噬细胞胞内细菌存活率的影响
Note: A. Images show CFU of BCG survival in macrophages after 24 h and 36 h of SAL pretreatment. B. Statistical analysis of the relative amount of BCG survival in macrophages after 24 h and 36 h of SAL pretreatment. ①P<0.001, compared with the control group.
Fig 2
Effect of SAL pretreatment at different time points on intracellular bacterial survival in BCG-infected macrophages
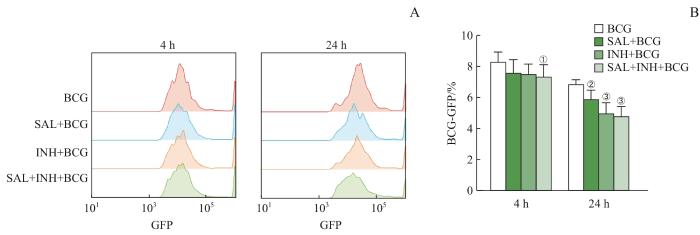
用药物预处理巨噬细胞,再经BCG感染4、24 h,用流式细胞术对各组细胞胞内细菌存活情况进行检测。发现在感染4 h后,给药组与BCG组相比BCG存活率均有所降低,但只有SAL+INH+BCG组差异有统计学意义(P=0.042),表明给药组对巨噬细胞吞噬BCG的作用影响较小。感染24 h后,SAL+BCG组(P=0.041)、INH+BCG组(P<0.001)及SAL+INH+BCG组(P<0.001)与BCG组比较胞内BCG存活均降低,差异有统计学意义;与SAL+BCG组比较,INH单用及SAL+INH联用对巨噬细胞胞内BCG抑制效果更明显(图3)。上述结果表明SAL能够抑制BCG在感染巨噬细胞内的增殖和存活,有利于巨噬细胞清除杀灭BCG,且SAL和INH联用可产生更好的抑制作用。
图 3
图 3
SAL对BCG感染巨噬细胞胞内细菌存活率的影响
Note: A. Representative results of flow cytometry detected intracellular bacterial survival in each group of BCG-infected macrophages. B. Statistical analysis of intracellular bacterial survival in A. ①P=0.042, ②P=0.041, ③P<0.001, compared with the rate of BCG-GFP of the BCG group.
Fig 3
Effect of SAL on intracellular bacterial survival in BCG-infected macrophages
2.3 SAL对BCG感染巨噬细胞细胞因子分泌的影响
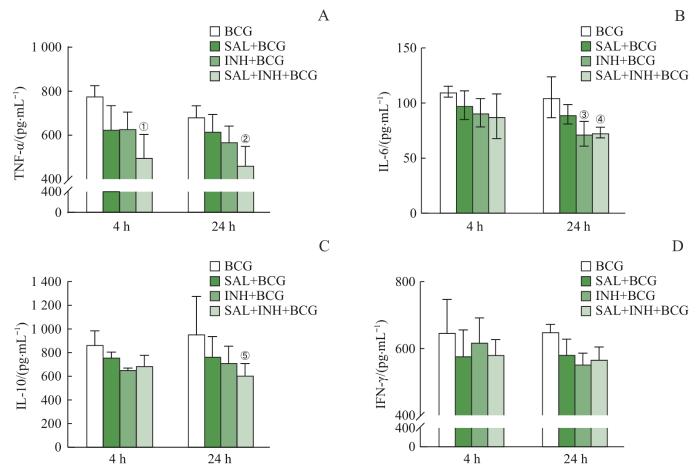
为了研究SAL对BCG感染RAW264.7细胞免疫反应的潜在影响,在BCG刺激RAW264.7细胞4、24 h后,测定细胞因子TNF-α、IFN-γ、IL-6、IL-10的水平(图4)。结果表明:与BCG组相比,在感染24 h后,SAL+BCG组的TNF-α、IFN-γ、IL-6、IL-10水平降低(但差异无统计学意义),SAL+INH+BCG组的TNF-α(P=0.016)、IL-6(P=0.036)及IL-10(P=0.047)水平显著降低,IFN-γ水平有所降低(但差异无统计学意义)。
图 4
图 4
SAL对BCG感染巨噬细胞细胞因子分泌的影响
Note: A, B, C, and D respectively represent the levels of cytokines TNF-α、IL-6、IL-10 and IFN-γ in cell culture supernatants at 4 h and 24 h. ①P=0.003, ②P=0.016, ③P=0.029, ④P=0.036, ⑤P=0.047, compared with the levels of cytokines of the BCG group.
Fig 4
Effect of SAL on cytokine secretion in BCG-infected macrophages
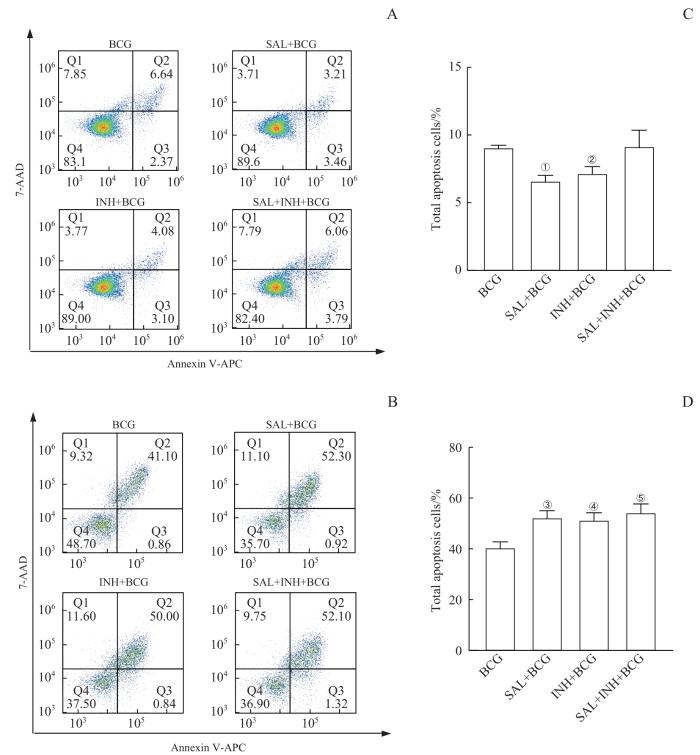
2.4 SAL对BCG感染巨噬细胞凋亡的影响
在BCG感染巨噬细胞4、24 h后用流式细胞术检测细胞凋亡。在4个象限的细胞分布图中,右上为晚期细胞凋亡,右下为早期细胞凋亡,比较各组巨噬细胞总凋亡率(图5)。与BCG组比较,在感染4 h后,SAL+BCG组能够显著抑制巨噬细胞凋亡率(P=0.008),而SAL+INH+BCG组在感染早期的凋亡率与BCG组相近;感染24 h后,SAL+BCG组(P=0.003)、INH+BCG组(P=0.005)及SAL+INH+BCG组(P=0.001)与BCG组相比凋亡率均显著升高。上述结果表明:在感染初期,SAL和INH能够降低BCG感染的RAW264.7细胞凋亡水平,但在感染后期SAL与INH联合应用能够增强BCG感染的RAW264.7细胞凋亡水平。
图5
图5
SAL对BCG感染巨噬细胞凋亡的影响
Note: A. Representative results of flow cytometry detected the apoptosis rate of each group of BCG-infected macrophages at 4 h. B. Representative results of flow cytometry detected the apoptosis rate of each group of BCG-infected macrophages at 24 h. C. Statistical analysis of the total apoptosis rate of cells in A. D. Statistical analysis of the total apoptosis rate of cells in B. ①P=0.008, ②P=0.032,③P=0.003,④P=0.005,⑤P=0.001, compared with the total apoptosis rate of the BCG group.
Fig 5
Effect of SAL on apoptosis of BCG-infected macrophages
3 讨论
前期实验发现不同浓度的SAL在体外不具有直接抗Mtb活性[15]。通过统计胞内细菌的存活率,发现SAL能够显著抑制BCG感染巨噬细胞细胞内的BCG,SAL与INH联用对胞内细菌的抑制效果更佳。表明SAL可以通过促进宿主巨噬细胞对胞内Mtb的清除,起到辅助治疗结核病的作用,从而提高结核病的治愈率并降低复发率。
细胞因子在免疫应答和炎症反应中扮演着关键角色,其表达水平变化可以调节细胞的免疫功能。Mtb感染可诱导宿主持续性炎症反应并引发免疫病理损伤,进而导致组织结构破坏。细胞因子TNF-α、IFN-γ、IL-6及IL-10能够促进炎症反应、介导细胞凋亡和免疫应答[16]。本研究结果显示,SAL会影响BCG感染的巨噬细胞中细胞因子的分泌,SAL能够降低TNF-α、IFN-γ、IL-6和IL-10的水平,当SAL与INH联合使用时对炎症因子的抑制作用更为显著,提示SAL可调节BCG感染的RAW264.7细胞的免疫功能,从而抑制炎症反应。SAL也可通过抑制NLRP3炎症小体的活化以减轻肺损伤[17]。王慧莲等[18]研究发现SAL可以减轻RAW264.7细胞炎性损伤,本研究结果与其一致。由此推断,SAL可以通过抑制感染的巨噬细胞炎性反应发挥抵抗Mtb感染的作用,这为SAL对结核病的治疗提供一定的依据。SAL的抗炎作用不仅有助于减轻结核病患者的炎症反应和组织损伤,还可能通过调节免疫应答,促进疾病的恢复和预后改善。
综上所述,SAL与一线抗结核药物INH联用能更有效地抑制胞内BCG的存活、降低促炎因子的分泌并促进巨噬细胞凋亡,表明SAL在抗Mtb感染中可以通过改善巨噬细胞免疫功能,减轻Mtb诱导的炎症反应,发挥其宿主抗Mtb作用。本研究提供了SAL在细胞层面抗Mtb作用的依据,但作用机制尚未完全清晰,今后将进一步研究。
作者贡献声明
倪书奕和何树梅参与了实验设计,倪书奕负责实验操作和负责数据分析,倪书奕、姜钊、汪中涛和何树梅参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by NI Shuyi and HE Shumei. The experiments were performed and the results were analyzed by NI Shuyi. The manuscript was drafted and revised by NI Shuyi, JIANG Zhao, WANG Zhongtao, and HE Shumei. All authors have read the last version of paper and consented to submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献