乳腺癌是女性易发且较为常见的恶性肿瘤,是全世界女性癌症死亡的第二大原因[1-2]。传统的乳腺癌治疗方法包括手术治疗、放射治疗、化学治疗等,但其效果均不够显著,使得新的癌症治疗策略有待继续开发。相关研究表明,微生物疗法或将能够为目前常规癌症疗法无法满足的临床需求提供全新的解决方案,如细菌介导的癌症疗法(bacteria-mediated cancer treatment,BMCT)已应用于临床诸多恶性肿瘤的治疗[3]。研究[4-5]显示,多种细菌[如大肠埃希菌(Escherichia coli,E.coli)]具有天然的肿瘤细胞杀伤能力,可诱导肿瘤细胞发生凋亡或使细胞增殖受到抑制,还可进入肿瘤区域通过细胞增殖来减少氧气和营养供应以形成坏死区域,使瘤区中心的肿瘤细胞死于饥饿和窒息,从而表现出良好的抗肿瘤效果。然而,细菌在肿瘤区域定植后发生的不可控制的大量繁殖会引发机体脓毒血症、感染性休克等较多不良反应,因此BMCT在临床上的应用仍存在巨大挑战[6-7]。
1 对象与方法
1.1 细胞来源及培养
小鼠4T1乳腺癌细胞株购自武汉普诺赛生命科技有限公司。使用含10%胎牛血清的RPMI 1640培养基,在37 ℃、5% CO2的细胞培养箱中培养,取对数生长期的细胞进行后续实验。
1.2 菌株来源与培养
大肠埃希菌BL21(DE3)菌株购自上海唯地生物技术有限公司。将冻存于-80 ℃的BL21(DE3)菌株接种于LB培养基,于37 ℃摇床培养20 h后用于后续实验。
1.3 实验动物
使用健康BALB/c雌性小鼠20只,月龄6~8周,体质量20~25 g[购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004]。所有实验动物均饲养于相同的标准实验环境中,即温度为(23±5)℃、湿度为(45±5)%、明暗周期为12 h、自由摄食及饮水,动物使用许可证号为SYXK(渝)2018-0003。
1.4 主要试剂与仪器
CCK-8试剂盒(Dojindo,日本),胎牛血清、RPMI 1640培养基(Gibco,美国),增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)兔单克隆抗体、细胞周期蛋白D1(CyclinD1)兔单克隆抗体(上海碧云天生物技术有限公司),E.coli外膜蛋白A(outer membrane protein A,OmpA)多克隆抗体(上海起发实验试剂有限公司),E.coli O157:H7 OmpC多克隆抗体(Thermo Fisher,美国),即用型免疫组化ElivisionTM Super检测试剂盒(福州迈新生物技术开发有限公司),增强型DAB显色试剂盒(20×)(北京索莱宝科技有限公司)。
Amicon Ultra-15 100kDa超滤离心管(Millipore,美国),Optima XPN-100超高速离心机、CytoFLEX流式细胞仪(Beckman Coulter,美国),INFINITE M PLEX荧光多模式酶标仪(Tecan,瑞士),透射电子显微镜(transmission electron microscope,TEM)(Hitachi,日本)。
1.5 E.coli-OMV的提取与鉴定
1.5.1 E.coli-OMV的提取
采用超滤离心法制备E.coli-OMV[14]。在4 ℃、5 000×g下离心含有BL21(DE3)菌株的LB培养液,获得上清液后依次使用0.45 μm、0.22 μm滤膜进行过滤,并使用超滤离心管对滤液进行浓缩。而后,在4 ℃、150 000×g下超速离心上述浓缩液,使用磷酸盐缓冲液(sodium phosphate buffer,PBS)重悬沉淀物后于-80 ℃保存备用。
1.5.2 E.coli-OMV的鉴定
使用PBS稀释新鲜制备的E.coli-OMV后,采用纳米粒度仪对其粒径进行检测。采用3%半凝固琼脂糖包埋新鲜制备的E.coli-OMV沉淀后进行切片,再通过TEM观察E.coli-OMV的形态。采用蛋白质印迹法(Western blotting)检测E.coli-OMV的OmpA、OmpC的表达,即取5 μg蛋白样品行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分离,经转膜封闭后依次孵育OmpA、OmpC一抗和相应二抗(工作浓度均为1∶5 000),最后使用ECL化学发光成像试剂进行显影。
1.6 4T1细胞摄入 E.coli-OMV的检测
使用PKH67外泌体绿色荧光标记染料对E.coli-OMV进行染色,具体染色步骤参照其说明书。采用PBS重悬已标记好的E.coli-OMV,避光储存在-80 ℃。
将4T1细胞以2×104个/孔接种于6孔板中,培养12 h后向每孔加入2 mL含有标记完成的E.coli-OMV的RPMI 1640完全培养基,共培养0、6、12 h。采用DAPI对细胞核进行染色,而后用荧光显微镜观察4T1细胞对E.coli-OMV的摄入情况。
1.7 4T1细胞增殖的检测
采用BCA蛋白浓度测定试剂盒对“1.5.1”部分得到的E.coli-OMV进行外膜总蛋白浓度检测,具体操作参见该试剂盒说明书。
将4T1细胞以6×103个/孔接种于96孔板中,培养12 h后用含有不同浓度E.coli-OMV的RPMI 1640完全培养基[E.coli-OMV终浓度为0(Ctrl组)、1、10、20、50 μg/mL]分别培养12、24、48 h。经PBS洗涤后,向每孔加入100 μL含有10% CCK-8试剂的RPMI 1640完全培养基,共孵育1 h后使用多功能酶标仪检测细胞的D(450 nm)。细胞抑制率(%)=(1-DE.coli-OMV/DCtrl)×100%。
1.8 4T1细胞周期的检测
将4T1细胞以2×106个/孔接种于6孔板中,使用无血清RPMI 1640培养基培养12 h,对细胞进行饥饿处理。用含有不同浓度E.coli-OMV的RPMI 1640完全培养基[E.coli-OMV终浓度均为0(Ctrl组)、5、10、20 μg/mL]分别培养12、24、48 h后,收集细胞并向其中加入70%冰乙醇,于4 ℃过夜行细胞固定。次日,使用含0.1% Triton X-100的PI进行细胞膜透化并行DNA染色,而后通过流式细胞仪对细胞周期进行检测。
1.9 BALB/c-4T1荷瘤小鼠模型建立及分组
将100 μL密度为5×105个/mL的4T1细胞悬液注射于小鼠背部皮下,10 d后待肿瘤体积达100 mm3则提示BALB/c-4T1荷瘤小鼠模型建立成功。将该模型小鼠随机分为E.coli-OMV组和对照(Control)组,每组10只。其中,每2 d向E.coli-OMV组小鼠的肿瘤区域注射E.coli-OMV溶液(浓度为50 μg/mL,单次剂量为5 mL/kg),共5次;同时,Control组小鼠注射等体积的PBS。分别用于后续体质量及生存率测定实验(每组5只),以及肿瘤组织的体积、质量、抑制率测定实验(每组5只)。
1.10 E.coli-OMV抑瘤效果评估
1.10.1 小鼠体质量及生存率测定
从初次注射开始,每2 d分别对2组小鼠进行称重,该部分数据统计时间结点为第20日。末次注射后,每日记录各组小鼠发生死亡的数量;数据统计时间结点为第45日,对第45日后依然存活的小鼠按生存45 d计算。
1.10.2 肿瘤组织的体积及其抑制率测定
使用游标卡尺分别对2组小鼠肿瘤组织的长径(L)和短径(W)进行测量,计算肿瘤组织的体积(V)及其抑制率。公式为:V(mm3)=L×W×W×0.5,肿瘤组织体积抑制率(%)=(VControl-VE.coli-OMV)/VControl×100%。
1.10.3 肿瘤组织的质量及其抑制率测定
于注射结束后10 d处死小鼠,分别测量2组小鼠肿瘤组织的质量(M)并计算肿瘤组织质量抑制率。公式为:肿瘤质量抑制率(%)=(1-ME.coli-OMV/MControl)×100%。
1.10.4 肿瘤组织的病理学变化分析
采用4%多聚甲醛对2组小鼠的肿瘤组织固定后,常规石蜡包埋并制成切片。行苏木精-伊红染色(hematoxylin-eosin staining,H-E染色),并通过光学显微镜观察肿瘤组织结构及细胞核分裂象。
1.10.5 肿瘤组织增殖标志物及周期蛋白表达的检测
采用免疫组织化学染色法对“1.10.4”部分得到的石蜡切片进行染色,其中一抗为PCNA、CyclinD1(工作浓度均为1∶100),二抗使用即用型免疫组化 ElivisionTM Super试剂盒孵育,最后使用增强型 DAB 显色试剂盒显色,具体步骤操作均依据相关说明书。通过光学显微镜观察组织阳性染色情况,并采用Image J软件计算阳性细胞染色的平均光密度。
1.11 统计学方法
采用GraphPad Prism 8.0统计学软件进行分析。定量资料以x±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
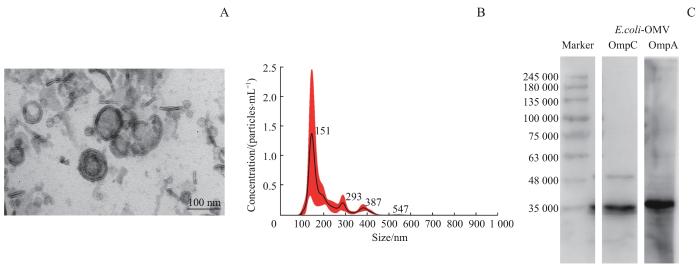
2.1 E.coli-OMV的表征分析
图1
图1
E.coli-OMV的一般特征分析
Note: A. Transmission electron micrograph of E.coli-OMV. B. Particle size distribution of E.coli-OMV. C. Detection of outer membrane marker proteins in E.coli-OMV by Western blotting.
Fig 1
Analysis of the characterization of E.coli-OMV
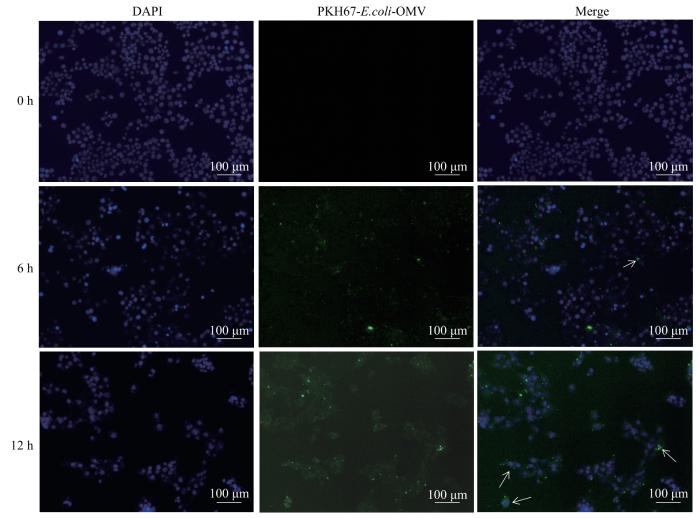
2.2 4T1细胞对 E.coli-OMV的摄入观察
将荧光标记的E.coli-OMV与4T1细胞作用0、6、12 h后,结果(图2)显示,6 h时4T1细胞质中、细胞核附近出现了绿色荧光标记,12 h时荧光强度增加;继而提示,4T1细胞可摄入E.coli-OMV。
图2
图2
4T1细胞对 E.coli-OMV的摄入观察(×100)
Note: Green fluorescence indicates PKH67-labelled E.coli-OMV, and white arrows indicate E.coli-OMV in the nucleus.
Fig 2
Observation on the uptake of E.coli-OMV by 4T1 cells (×100)
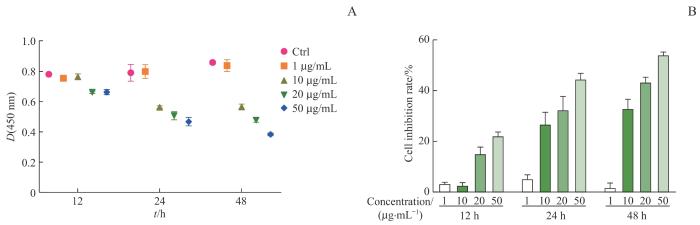
2.3 E.coli-OMV对4T1细胞增殖的影响
CCK-8实验的结果(图3)显示,E.coli-OMV在1 μg/mL浓度下对4T1细胞增殖的影响较小;在10、20、50 μg/mL浓度下,对4T1细胞作用12 h的细胞抑制率分别为(2.76±0.98)%、(15.20±2.53)%、(22.33±1.15)%;作用24 h的细胞抑制率分别为(26.89±4.56)%、(32.51±5.25)%、(44.63±2.21)%;作用48 h的细胞抑制率分别为(33.00±3.64)%、(43.48±1.85)%、(54.19±1.03)%。继而提示,E.coli-OMV可抑制4T1细胞的增殖,且抑制效果呈时间-剂量依赖性。
图3
图3
CCK-8法检测 E.coli-OMV对4T1细胞增殖的影响
Note: A. Effect of the different concentrations of E.coli-OMV on D(450 nm) of 4T1 cells at different time points. B. Analysis of the inhibition rate of E.coli-OMV at different concentrations on 4T1 cell proliferation under different time points.
Fig 3
Effect of E. coli-OMV on 4T1 cells proliferation by CCK-8 method
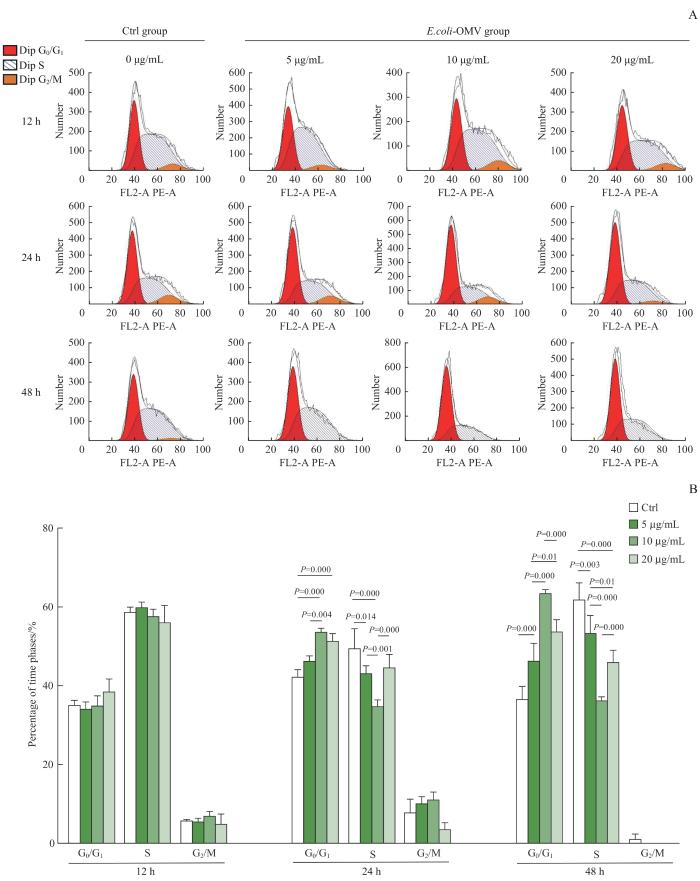
2.4 E.coli-OMV对4T1细胞周期的影响
采用流式细胞术检测E.coli-OMV对4T1细胞周期的影响,结果(图4)显示与Ctrl组相比,经不同浓度的E.coli-OMV处理的细胞在不同作用时间下处于G0/G1期的占比有所增加,S期占比减少;其中,E.coli-OMV浓度为10 μg/mL时对细胞周期的阻滞现象最为明显;随着作用时间的增加,各个浓度E.coli-OMV抑制细胞周期G0/G1期程度也有增加。继而提示,一定剂量的E.coli-OMV可以将4T1细胞的细胞周期阻滞在G0/G1期,且阻滞效果呈明显的作用时间依赖性。
图4
图4
流式细胞术检测 E.coli-OMV对4T1细胞周期分布的影响
Note: A. Flow assay graphs of 4T1 cell cycle. B. Effect of different concentrations of E.coli-OMV on 4T1 cell cycle distribution at different time points.
Fig 4
Effect of E. coli-OMV on 4T1 cell cycle distribution by flow cytometry
2.5 E.coli-OMV对BALB/c-4T1荷瘤小鼠肿瘤的抑制作用
2.5.1 BALB/c-4T1荷瘤小鼠的一般情况观察
与Control组比较,E.coli-OMV组小鼠在首次注射后的第1~4日精神状态欠佳,坚毛,活跃程度与注射前比较稍有下降;在第3次注射时精神状况好转。5次注射过程中,2组小鼠均未出现运动失调、活动受限、呼吸困难、烦躁等反应。
2.5.2 E.coli-OMV对BALB/c-4T1荷瘤小鼠体质量的影响
注射前,2组小鼠的平均体质量间差异无统计学意义。首次注射后4 d,E.coli-OMV组小鼠的平均体质量较Control组稍有下降(P=0.031),而后逐渐回升至与Control组持平,最终2组小鼠的平均体质量间差异无统计学意义(图5)。继而提示,初期注射0.25 mg/kg剂量的E.coli-OMV可使小鼠体质量有下降,而后则不会对小鼠体质量产生影响。
图5
图5
2组BALB/c-4T1荷瘤小鼠的体质量变化
Fig 5
Changes in body weight of BALB/c-4T1 tumor-bearing mice in the two groups
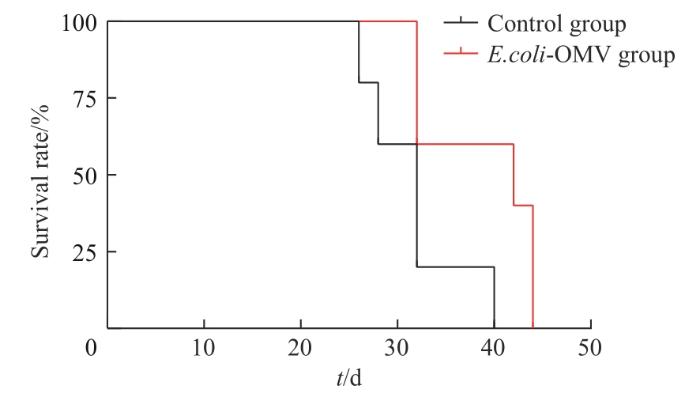
2.5.3 E.coli-OMV对BALB/c-4T1荷瘤小鼠生存率的影响
对2组小鼠的生存率进行观察,结果(图6)显示,注射后第26、32、40 d,Control组小鼠生存率分别为80%(4/5)、20%(1/5)、0(0/5),E.coli-OMV组小鼠生存率分别为100%(5/5)、60%(3/5)、60%(3/5);40 d后,Control组小鼠全部死亡,E.coli-OMV组小鼠仍有存活,组间差异具有统计学意义(P=0.037)。继而提示,0.25 mg/kg剂量下的E.coli-OMV可以延缓由乳腺癌导致的小鼠死亡。
图6
图6
2组BALB/c-4T1荷瘤小鼠的生存率分析
Fig 6
Survival rate analysis of BALB/c-4T1 tumor-bearing mice in the two groups
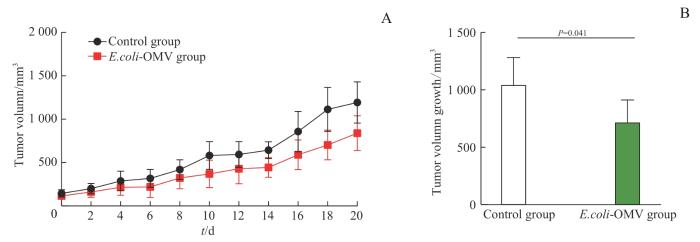
2.5.4 E.coli-OMV对小鼠肿瘤体积的影响
图7
图7
2组BALB/c-4T1荷瘤小鼠的肿瘤体积变化
Note: A. Tumor volume growth curve of the mice injected from 0 d to 20 d. B. Tumor volume growth in mice at d 20 post-injection.
Fig 7
Changes in tumor volume growth of BALB/c-4T1 tumor-bearing mice in the two groups
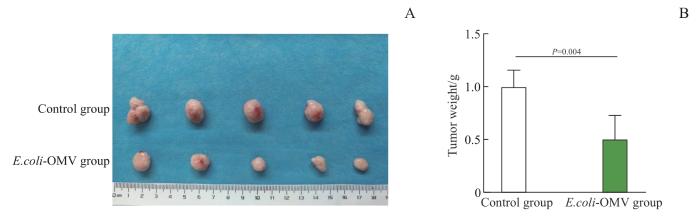
2.5.5 E.coli-OMV对小鼠肿瘤质量的影响
对2组小鼠的肿瘤组织进行解剖观察,结果(图8)显示注射后20 d,E.coli-OMV组小鼠的肿瘤组织均小于Control组,肿瘤质量亦小于Control组且差异具有统计学意义(P=0.004),抑瘤率达到49.81%。继而提示,0.25 mg/kg剂量下的E.coli-OMV可对小鼠4T1肿瘤生长有一定的抑制作用。
图8
图8
2组BALB/c-4T1荷瘤小鼠的肿瘤质量变化
Note: A. Anatomy picture of tumor tissues in the two groups at 20 d post-injection. B. Statistical analysis of tumor weight in the two groups at 20 d post-injection.
Fig 8
Changes in tumor weight of BALB/c-4T1 tumor-bearing mice in the two groups
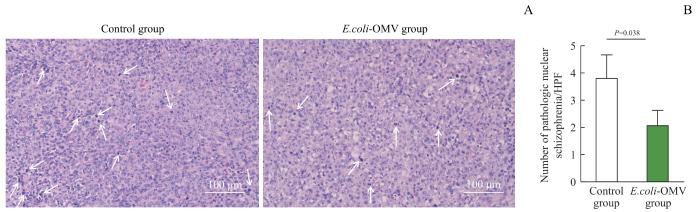
2.5.6 E.coli-OMV对小鼠肿瘤组织病理学变化的影响
H-E染色的结果(图9)显示,相较于Control组,E.coli-OMV组小鼠肿瘤组织细胞排列松散、紊乱,病理性细胞核分裂象减少(P=0.038),核仁染色较浅、不明显。
图9
图9
2组BALB/c-4T1荷瘤小鼠的肿瘤组织的H-E染色分析(×200)
Note: A. H-E staining of tumor tissues. White arrows indicate pathological nuclear schizophrenia. B. Statistical analysis of pathological nuclear schizophrenia of tumor tissues. HPF—High power field.
Fig 9
Analysis of H-E staining of tumor tissues of BALB/c-4T1 tumor-bearing mice in the two groups (×200)
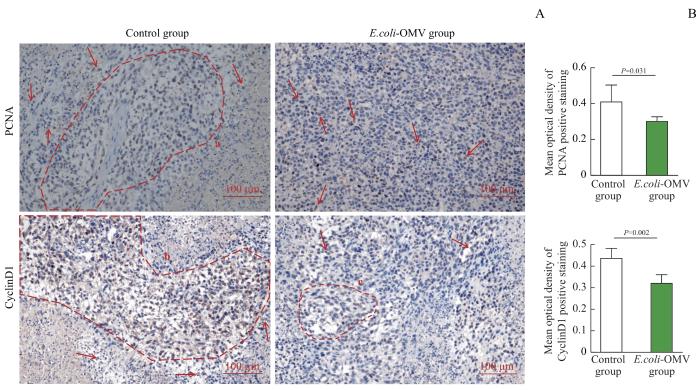
2.5.7 E.coli-OMV对小鼠肿瘤组织PCNA、CyclinD1蛋白表达的影响
免疫组织化学染色的结果(图10)显示,2组小鼠的肿瘤组织均有PCNA和CyclinD1阳性表达,且均定位于细胞核,呈棕黄色;与Control组染色阳性区域相比,E.coli-OMV组小鼠肿瘤组织中PCNA和CyclinD1阳性表达均减少(P=0.031,P=0.002)。
图10
图10
免疫组织化学染色分析2组BALB/c-4T1荷瘤小鼠肿瘤组织中PCNA、CyclinD1的表达(×200)
Note: A. Immunohistochemical images of PCNA and CyclinD1 expressions in the two groups. The areas circled by the red dotted line a、b、c are large area of positive expression. Red arrows indicate scattered nuclei with positive expression. B. Statistical analysis of mean optical density of PCNA and CyclinD1 positive staining.
Fig 10
Analysis of the expression of PCNA and CyclinD1 in tumor tissues of BALB/c-4T1 tumor-bearing mice in the two groups by immunohistochemical staining (×200)
3 讨论
乳腺癌是女性癌症死亡的主要原因之一。近年来,微生物在乳腺癌治疗方面的应用已取得一定进展。研究表明E.coli具有天然的肿瘤杀伤能力,能够改善乳腺癌的治疗效果。然而,由于细菌在肿瘤区域内繁殖后会释放大量毒素,从而对机体产生危害,这使得寻求更安全、高效的治疗方法成为了医学界的难题[15]。
作为细菌的衍生物,OMV虽不可自我复制,但在功能上与亲本细菌具有一定的相似性。目前,已有研究证明了细菌的抗肿瘤作用,而OMV是否具有抗肿瘤功能以及其具体机制尚未得到广泛研究[16]。
在本研究中,我们通过超滤离心法从E.coli培养的上清液中获得E.coli-OMV。首先,通过体外实验发现,E.coli-OMV可以抑制小鼠4T1乳腺癌细胞的增殖,且抑制效果呈现时间-浓度依赖性;体内实验显示,E.coli-OMV对BALB/c-4T1荷瘤小鼠肿瘤生长的抑制效果显著,表现为肿瘤体积、质量均有下降,且小鼠40 d存活率增加,表明E.coli-OMV具有良好的抗肿瘤活性。其次,流式细胞术的结果显示,E.coli-OMV将4T1细胞周期阻滞在G0/G1期;免疫组织化学染色的结果显示,E.coli-OMV组小鼠肿瘤组织中的PCNA和CyclinD1表达均有减少,继而提示E.coli-OMV的抑瘤作用与其对细胞周期的调控作用相关。真核细胞完成正常的有丝分裂需要细胞周期的有序进行,这一过程离不开各种细胞周期蛋白和相关因子的调控。当细胞处于G0/G1期时,大量表达的PCNA可为DNA复制做准备[17],而后CyclinD开始表达以保证细胞从G0/G1期向S期的正常转化,进而推进细胞周期循环完成有丝分裂。在此过程中,细胞任一时相的异常都可能导致细胞增殖失调,这是肿瘤发生与无限制增殖恶化的主要原因之一[18]。因此,恢复细胞周期蛋白和各级调控因子对细胞周期的正常调控,阻断肿瘤细胞增殖是当前抗肿瘤研究的重要策略。在本研究中,E.coli-OMV可使4T1细胞周期停滞在G0/G1期,同时能够抑制增殖相关蛋白PCNA和周期相关蛋白CyclinD1的过量表达,使得肿瘤细胞的分裂增殖减缓,从而抑制了小鼠肿瘤的生长。
综上所述,本研究证明了E.coli来源的OMV具有良好的抗肿瘤作用,且初步证明其对细胞周期存在抑制作用。该结果有望为基于微生物疗法的临床肿瘤治疗提供新的思考。
作者贡献声明
王斓茜参与了数据采集、数据处理分析、文章撰写,马官荣和姜咏竹参与了数据采集,常秀林参与了文章修改,方廖琼参与了实验设计、实验指导和文章指导,白晋参与实验设计、监督及文章指导。所有作者均阅读并同意了最终稿件的提交。
WANG Lanxi collected, processed and analyzed the data, and drafted the manuscript. MA Guanrong and JIANG Yongzhu collected data. CHANG Xiulin revised the manuscript. FANG Liaoqiong designed and guided the experiment, and guided the manuscript. BAI Jin participated in experimental design, supervision and paper guidance. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
参考文献