近几十年来,肥胖等代谢性疾病在儿童和青少年中的患病率呈迅速增长趋势,已成为重要的儿童健康问题。根据“成人疾病胎儿起源”学说,胎儿发育过程中异常的内外环境会增加其成年后患肥胖、2型糖尿病、非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)等慢性代谢性疾病的风险[1]。流行病学研究和来自动物模型的数据均表明,母亲肥胖会导致其后代在成年后罹患代谢性疾病的风险增加[2]。已有研究[3]表明,这种影响与环境因素、遗传学和表观遗传调控等潜在机制有关。此外,本课题组前期研究[4]还发现,来自胎盘的炎症因子白细胞介素-6(interleukin-6,IL-6)水平增加可上调子代肝脏脂质合成基因表达,进而促进子代肝脏脂肪变性,提示胎盘微环境改变在母子代际传递中可能起重要作用。
为此,本研究旨在采用高脂饮食母鼠模型,观察母鼠高脂饮食后胎盘炎症因子水平和结构等微环境变化,以及其子代在宫内和断乳时相关代谢表型变化,并进一步探讨胎盘微环境改变对子代生命早期罹患代谢性疾病的可能的作用。
1 材料与方法
1.1 动物模型的建立
健康3周龄C57BL/6J雌性小鼠24只(购自上海斯莱克实验有限公司),体质量(12±5)g。所有动物均饲养在上海交通大学医学院附属新华医院SPF级动物房。饲养条件为每笼6只,12 h明暗循环,恒温(21 ℃~23 ℃)。实验动物生产许可证号为SCXK(沪)2017-0012,使用许可证号为SYXK(沪)2018-0038。
所有小鼠给予普通饲料适应性喂养1周后,在4周龄时随机分为高脂饮食组(HFD组,n=12)和对照饮食组(CD组,n=12),分别给予高脂饲料(含60%脂肪、20.6%碳水化合物和19.4%蛋白质;TP23300,中国)和普通饲料(含16.7%脂肪、64%碳水化合物和19.3%蛋白质;LAD3001G,中国)喂养5周。雌鼠至9周龄时与正常饲喂雄鼠进行交配。妊娠期与哺乳期均维持原饲料。
1.2 主要试剂与仪器
组织细胞总胆固醇(total cholesterol,TC)含量酶法测定试剂盒(E1015-50)和组织细胞三酰甘油(triacylglycerol,TAG)含量酶法测定试剂盒(E1013-50)均购自北京普利莱基因技术有限公司;油红O染液(G1015)购自武汉塞维尔生物科技有限公司;IL-6、IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)购自武汉塞维尔生物科技有限公司;小鼠紧密连接相关蛋白zonula occludens 1 (Zo-1;5'-AACCCGAAACTGATGCTGTGGATAG-3',5'-CGCCCTTGGAATGTATGTGGAGAG-3')、occludin(Ocln;5'-TTGGCTACGGAGGTGGCTATGG-3',5'- CCTTTGGCTGCTCTTGGGTCTG-3')、claudin 4(Cldn4;5'-TCATCGGCAGCAACATCGTCAC-3',5'- GCGAGCATCGAGTCGTACATCTTG-3')、Cldn5(5'- TGGTGCTGTGTCTGGTAGGATGG-3',5'-GTCACG-ATGTTGTGGTCCAGGAAG-3')、Cldn8(5'-ACGACT-CCCTGCTGGCTCTTAG-3',5'-CACTTCATTCCGAG-GATGGCTGTC-3')、Cldn11(5'-GTGCTCCTTATTC-TGCTGGCTCTC-3',5'-CAACCTGCGTACAGCGAG-TAGC-3')、Cldn18(5'-TTGTGGTGTCACTGATCGG-GTTTG-3',5'-CTCGGACGCATGAACGCCATAG-3')引物购自生工生物工程有限公司;PrimeScript RT Reagent Kit cDNA合成试剂盒(D350A)购自日本TaKaRa公司;SYBR GREEN Master Mix购自翌圣生物工程有限公司。
酶标仪(美国Thermo Fisher Scientific);血糖仪及血糖试纸(德国拜耳);实时定量荧光PCR仪(美国Thermo Fisher Scientific)。
1.3 实验方法
1.3.1 肝脏组织三酰甘油和总胆固醇水平检测
母鼠孕20 d时采用2.5%戊巴比妥钠麻醉后取肝脏组织以及胎鼠肝脏组织,采用组织TC酶法测定试剂盒和组织TAG酶法测定试剂盒进行裂解并测定肝脏TC、TAG水平。取50 mg肝脏组织放入1.5 mL离心管中,按照裂解液体积(μL)∶组织质量(mg)=20∶1的比例加入裂解液,以60 Hz频率高速研磨60 s,室温静置后离心取上清液,随后在70 ℃金属浴中加热10 min,再次离心取上清液进行酶学测定。TC、TAG含量采用同一样品的总蛋白量进行归一化处理。
1.3.2 胎鼠肝脏油红O染色
将干燥后的肝脏组织切片置于配好的60%异丙醇中5 min,随后将切片放入已预热至60 ℃的油红O工作液中约25 min,后弃去染液,用60%异丙醇漂洗5 min左右(置于水平摇床上,共漂洗2~3次),用双蒸水冲洗数次,加入苏木精染液复染10 s,用流动的自来水冲洗3 min,返蓝,双蒸水再漂洗3次,等待其风干后,使用甘油明胶将组织切片封固保存于载玻片与盖玻片之间。
1.3.3 胎盘病理切片
母鼠孕20 d时采用2.5%戊巴比妥钠麻醉后取胎盘组织,胎盘剥离干净后用4%多聚甲醛固定,24 h后以梯度乙醇常规脱水,石蜡包埋切片,将切片放入已预热至60 °C的恒温箱中1 h,随后立即依次置于二甲苯和不同浓度乙醇中;然后用流水冲洗5 min后用苏木精染液染色3 min;经过返蓝后伊红染液染色20 s;再依次置于不同浓度乙醇和二甲苯中各5 min;待其风干后,用中性树胶封片,完成苏木精-伊红染色(hematoxylin-eosin staining,H-E染色)。
1.3.4 胎盘组织免疫组织化学染色
将胎盘石蜡切片脱蜡水化,用PBS(pH 7.4)冲洗3次后进行组织抗原修复,PBS冲洗后加入IL-6、IL-1β、TNF-α和ZO-1抗体,室温下孵育60 min后PBS冲洗,后滴入酶二抗聚合物,室温孵育40 min后PBS冲洗,加入新鲜配制的二氨基联苯胺(diaminobenzidine,DBA)溶液。显微镜下观察IL-6、IL-1β和TNF-α在胎盘内的分布,并通过ImageJ软件将阳性细胞染色转化为平均光密度值来统计其表达水平。
1.3.5 胎盘组织结构分析
扫描胎盘H-E染色切片后存储完整胎盘视野,采用ImageJ软件计算胎盘迷路区占胎盘总面积的比例;通过胎盘H-E染色切片,观察迷路区母体血窦大小、滋养层细胞形态、母血和胎儿血管之间间隔厚度;通过反转录聚合酶链反应(RT-PCR)检测胎盘内紧密连接相关蛋白Zo-1、Ocln、Cldn4、Cldn5、Cldn8、Cldn11、Cldn18的mRNA表达水平。
1.3.6 空腹血糖以及腹腔注射葡萄糖耐量测试
待测3周龄断乳子鼠(n=6)提前空腹8 h后,用血糖仪通过剪尾法检测空腹血糖。待小鼠休整数日后,提前空腹12 h,先检测空腹血糖,后使用1 mL注射器腹腔注射20%葡萄糖溶液,注射剂量为1.5 g/kg;分别于30、60、120 min测定血糖,并计算曲线下面积。
1.4 统计学分析
采用SPSS 22.0软件进行数据分析。定量数据以x±s表示。统计分析前,采用Levene验证进行方差齐性检验。2组间均值比较采用独立样本t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 母鼠体质量和肝脏脂质含量比较
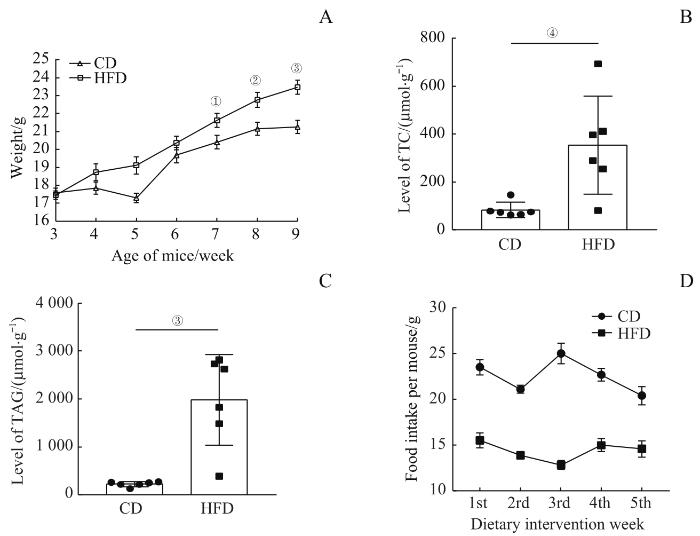
HFD组母鼠孕前经5周高脂饮食后,体质量明显高于CD组母鼠,且自母鼠7周龄开始2组间差异逐渐增大。至合笼前,2组母鼠体质量差异最大[(23.48±0.39)g vs(21.26±0.36)g],且差异具有统计学意义(P=0.001,图1A)。
图1
图1
2组母鼠体质量、肝脏脂质含量以及摄食量改变
Note: A. Weight change curves of female mice before pregnancy. B. TC content in livers of female mice in the two groups. C. TAG content in livers of female mice in the two groups. D. Changes of weekly food intake before pregnancy of female mice in the two groups. ①P=0.015, ②P=0.005, ③P=0.001, ④P=0.009.
Fig 1
Changes in body weight, liver lipid content and food intake of female mice in the two groups
2组母鼠每周摄食量见图1D(饮食干预后5周每只母鼠每周摄食量),HFD组摄食量均低于CD组,提示60%脂肪含量的高脂饲料本身而非摄食量导致了母鼠体质量增长和肝脏脂质代谢水平。
2.2 高脂饮食母鼠胎盘炎症因子表达增加
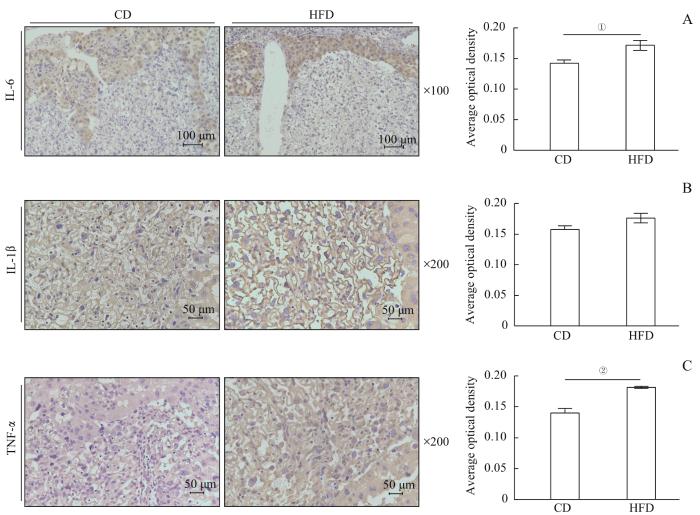
胎盘免疫组织化学(免疫组化)染色结果(图2)显示,2组母鼠胎盘中,IL-6均主要聚积在胎盘连接区(junctional zone,JZ),而IL-1β和TNF-α则在连接区和迷路区(labyrinth zone,LZ)均有分布。与CD组相比,HFD组胎盘中IL-6水平(P=0.038)和TNF-α水平明显升高(P=0.002),IL-1β无明显改变。
图2
图2
2组母鼠胎盘炎症因子表达水平
Note: A. Immunohistochemical staining of IL-6 in placentas and its average optical density. B. Immunohistochemical staining of IL-1β in placentas and its average optical density. C. Immunohistochemical staining of TNF-α in placentas and its average optical density. ①P=0.038, ②P=0.002.
Fig 2
Expression levels of inflammatory cytokines in placentas of female mice in the two groups
2.3 高脂饮食母鼠胎盘结构分布改变
图3
图3
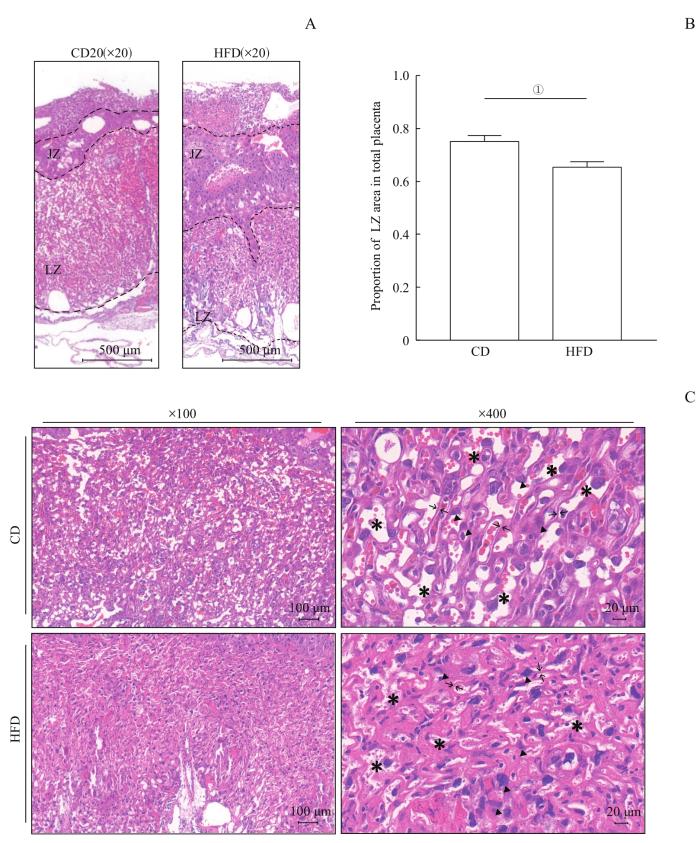
2组母鼠胎盘结构改变
Note:A. H-E staining sections of the placentas in the two groups. Dotted lines divided different placental zones. JZ—junction zone; LZ—labyrinth zone. B. ImageJ calculated the area proportion of placental labyrinth zone. C. H-E staining sections of the placentas were taken to observe the structure of LZ of the placentas in the two groups (* representing maternal blood sinuses, ▲ representing trophoblast cells, →← representing intervascular membranes). ①P=0.009.
Fig 3
Changes of placental structure in the two groups
2.4 高脂饮食母鼠胎盘组织血管分布改变
除了胎盘迷路区面积减小外,其内部结构也发生改变。CD组胎盘迷路区绒毛分支正常,滋养层细胞形态正常,胎儿毛细血管与母体血窦接触良好;而HFD组迷路区绒毛分支增多,母体血窦狭小,血管间膜增厚,滋养层细胞形态改变,占据更多血液交换空间(图3C)。
2.5 高脂饮食母鼠胎盘紧密连接结构改变
图4
图4
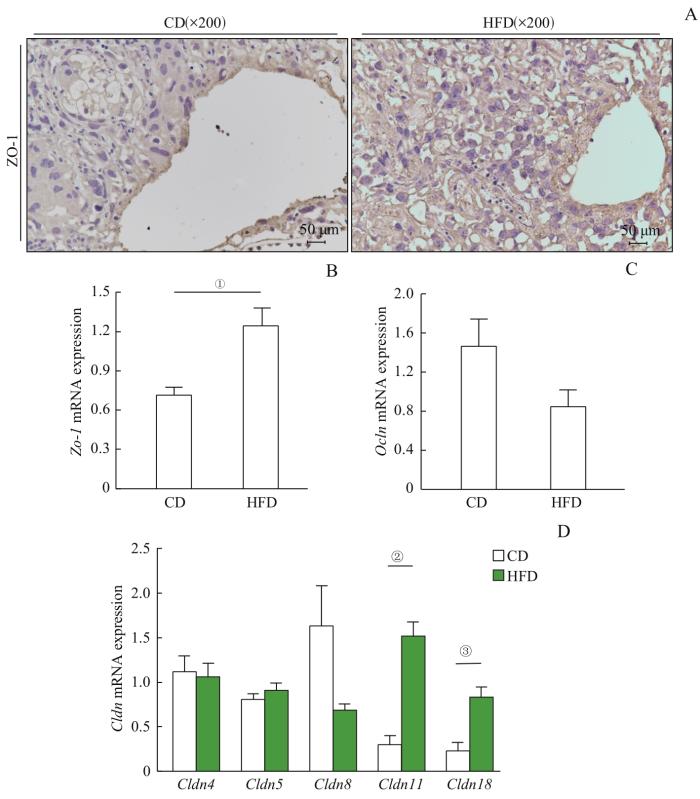
2组胎盘紧密连接相关蛋白表达水平
Note:A. Placental immunohistochemistry revealed the expression level of ZO-1 in the placentas. B. The expression level of Zo-1 mRNA in placentas was detected by RT-PCR. C. The mRNA expression levels of occludin and claudins in placentas in the two groups were detected by RT-PCR. ①P=0.006, ②P=0.001, ③P=0.012.
Fig 4
Expression levels of tight junction-related proteins in the placentas in the two groups
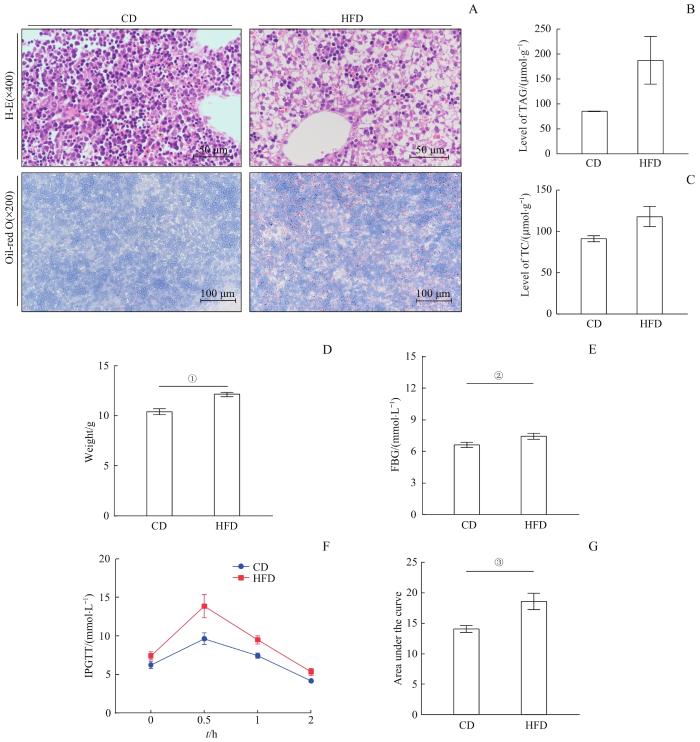
2.6 高脂饮食母鼠子代代谢表型改变
图5
图5
CD组与HFD组子代表型改变
Note: A. H-E staining and oil red staining of fetal liver tissues in the CD group and the HFD group. B. TAG levels in fetal liver tissues of the CD group and the HFD group. C. TC levels in fetal liver tissues of the CD group and the HFD group. D. Body weight of the 3-week-old offsprings in the CD group and the HFD group. E. FBG of the 3-week-old offsprings in the CD group and the HFD group. F/G. Intraperitoneal glucose tolerance test (IPGTT, F) and area under the curve (G) of the 3-week-old offsprings in the CD group and the HFD group. FBG—fasting blood glucose. ①P=0.000, ②P=0.046, ③P=0.009.
Fig 5
Phenotypic changes of offsprings in the CD group and the HFD group
3 讨论
20世纪90年代BARKER等[8]提出“成人疾病胎儿起源”学说,认为胚胎发育过程中母代营养环境不良可以导致处于发育敏感期的子代组织器官结构及功能发生永久性改变。本课题组的前期研究已经发现母鼠高脂饮食至哺乳期结束时,已出现严重的糖脂代谢紊乱,并且其新生子鼠肝脏脂质代谢异常,炎症增加[4];3周龄断乳子鼠体质量增加,糖耐量受损,出现NAFLD[9];甚至11周龄子代依然表现出肝脏脂肪变性以及TAG积累[10]。本研究发现早在宫内时期,胎鼠就已受到母代高脂饮食的影响,出现肝脏脂质沉积。已有研究[11]证实这种代际传递影响与表观遗传和肠道微生物均有关。胎盘作为母体与胎儿之间的唯一连接,在支持胎儿发育方面具有多种功能,包括提供营养物质、清除废物、建立母体免疫耐受、形成母胎屏障防止有害物质渗透影响胎儿发育[12]。胎盘形态结构以及炎症状态均会影响子代疾病发生发展[6]。本研究聚焦母代高脂饮食下胎盘形态结构以及炎症状态的表型变化,探索胎盘微环境特征改变在高脂饮食母子代际传递中的重要作用。
进一步分析小鼠胎盘组织结构发现,胎盘组织主要分为2个区域,即连接区和迷路区。前者主要包括海绵滋养细胞和糖原细胞,具有内分泌和提供能量的功能;后者由母体血窦和绒毛组成,绒毛形成分支直接浸于母体血液中,是母胎交换的场所[15-16]。胎盘的可塑性使其可以适应母体环境来优化胎儿生长发育,但也导致胎盘更容易受到母体环境的影响,尤其是迷路区因其血流量大、细胞增殖活跃、增殖期长的特点更易受到外界影响[17]。有研究证实母代高脂饮食可导致胎盘迷路区变薄[18],滋养层细胞分化紊乱,基底膜破坏[19]。本研究结果也发现,母鼠高脂饮食可引起胎盘迷路区面积占比减小。作为胎儿气体交换、营养供应和废物清除的重要区域,迷路区占比下降可影响胎儿生长发育。迷路区主要由绒毛的3层滋养层细胞,即最外层的血窦型滋养巨细胞和里面2层合体滋养细胞、胎儿毛细血管的基底膜、胎儿毛细血管内皮组成。其中滋养细胞作为内皮周围支持细胞,可通过改变细胞形状缩短母体血窦和胎儿毛细血管之间的距离并增加接触面积。本研究结果发现光学显微镜下高脂饮食母鼠胎盘迷路区内滋养层细胞形态发生改变,占据空间增加,血管间膜滋养层较对照组增厚,这可能导致母体血窦和胎儿毛细血管接触不良,阻碍胎儿血供和物质交换。但我们对妊娠末期胎盘迷路区结构的分析结果并不能解释母鼠高脂饮食影响的是胎盘早期血管生成还是妊娠中后期胎盘血管重塑,这需要进一步的实验探索。
除了作为物质交换的场所,胎盘也起到屏障保护作用,其中细胞连接对于胎盘屏障功能发挥了举足轻重的作用。ZO-1作为单层极化上皮细胞间连接复合物结构的重要组成部分,在妊娠早期胎盘中均有表达,在妊娠晚期胎盘中表达明显增加[20]。我们发现高脂饮食母鼠胎盘内ZO-1表达明显增加,但这种过度表达带来的影响尚不明确。CLDN是构成紧密连接的四通道跨膜蛋白,其与ZO-1相互作用调节细胞旁通透性。本研究结果显示Cldn11和Cldn18在高脂饮食母鼠胎盘中表达显著增加。除clandins外,MARVEL结构域蛋白occludin也在紧密连接中发挥作用,但其确切功能尚不明确[21]。在高脂饮食孕鼠胎盘结构中,紧密连接相关蛋白分子的表达水平增高,提示胎盘的重塑过程中,外界任何有可能影响发育的因素(如高炎症水平)都会启动特定的调节机制,从而建立更为紧密的屏障系统,通过胎盘微环境的适应性改变来发挥作用。母鼠高脂饮食改变了迷路区滋养层细胞形态,以及使得胎盘紧密连接相关蛋白的表达水平升高,也较好地证实了胎盘屏障的调节功能,从而维持子代正常生长发育,其中的具体机制有待进一步深入研究。
在以上所述胎盘微环境改变的同时,本研究发现HFD组胎鼠肝脏内出现脂肪变性和脂滴沉积,并且3周龄子代体质量明显升高、糖耐量受损,这些代谢改变极有可能是由于胎鼠时期就受到胎盘微环境改变而产生的。综上所述,母代孕前及孕期高脂饮食可以引起胎盘组织微环境的变化,造成胎盘局部炎症水平升高以及组织结构改变,提示母代高脂饮食导致代谢特征分子的改变可以通过改变胎盘微环境进而影响子代生长发育,从而成为解析“成人疾病胎儿起源”学说的新机制。深入分析胎盘微环境表型变化的潜在机制以及影响子代发育的机制,有望获得新的干预措施来降低胚源性疾病的发病率。
作者贡献声明
董艳设计并指导研究。徐一丹完成大部分实验,并撰写文章。卢星宇和张骞仁为实验提供技术支持。
AUTHOR's CONTRIBUTIONS
DONG Yan designed the project and directed the research. XU Yidan performed most of the experiment, and drafted the manuscript. LU Xinyu and ZHANG Qianren provided technical support for the experiments.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献