狭颅症又称颅缝早闭(craniostenosis),是小儿在生长发育过程中颅缝过早闭合造成颅腔狭小的先天畸形,发病率约为1/2 500。目前,在婴儿期(6个月至1岁)进行外科手术干预已经成为治疗狭颅症的普遍共识[1]。早期手术不仅可以重塑患儿的头颅外观,而且能最大程度地降低由颅内压升高、脑组织发育受限等导致的严重并发症。然而,由于头皮血运丰富、血管固定且硬脑膜窦壁无平滑肌,损伤后往往止血困难,导致手术过程常伴随大量失血。极端情况下,术中出血量甚至可达到循环总血容量的500%[2],是造成围手术期心搏骤停的主要原因[3]。此外,大量输血导致的过敏、凝血功能障碍也会增加患儿术后并发症的发生率和死亡率[4]。本研究通过回顾性收集上海交通大学医学院附属上海儿童医学中心2013年6月—2019年6月接受开放性颅骨修补术患儿的相关资料,分析此类手术中出血量的影响因素,旨在为临床识别颅骨修补术大出血高危人群,制定个体化围手术期血液保护策略,减少异体血使用量,改善预后提供参考。
1 对象与方法
1.1 研究对象
纳入2013年6月—2019年6月在上海儿童医学中心,经头颅CT和颅骨三维重建诊断为单条或多条颅缝早闭,并择期行开放性颅骨修补术的患儿。排除标准:术中出入量记录不完整的患儿。
1.2 临床资料收集
采用自行编制的临床资料收集表,回顾临床电子病例系统和DoCare麻醉临床信息系统收集患儿围手术期资料。①术前资料:患儿年龄、性别、体质量、身高、红细胞压积、血红蛋白浓度、白蛋白浓度、早闭颅缝类型、早闭颅缝数量、既往颅面部手术史、症状持续时间,是否为综合征型狭颅,是否合并脑积水,以及家族史等。②术中资料:手术持续时间、手术方式、术中最低体温、晶体液和胶体液输注总量、血制品(红细胞悬液、普通血浆、新鲜冰冻血浆、冷沉淀)使用量、止血药物(氨甲环酸、血凝酶、凝血酶原复合物)使用情况,以及术中出血量等。
1.3 麻醉方法
所有手术均为开颅手术,由同一位神经外科医师主刀。年龄大于6个月的患儿入手术室前30 min予咪达唑仑(0.75 mg/kg)口服或右美托咪定(3 μg/kg)滴鼻镇静。所有患儿进入手术室后在心电图、脉搏血氧饱和度监测下开放静脉通路,予丙泊酚(3 mg/kg)、舒芬太尼(0.3 μg/kg)或芬太尼(3 μg/kg)复合罗库溴铵(0.6 mg/kg)或顺阿曲库铵(0.1 mg/kg)静脉注射诱导后行气管内插管。术中空气-氧气混合吸入[吸氧浓度(FiO2)40%~50%],氧流量2.0 L/min,压力控制通气模式控制通气,维持潮气量6~8 mL/kg,调整呼吸频率,维持呼气末二氧化碳35~45 mmHg(1 mmHg=0.133 kPa)。术中予丙泊酚每小时4~10 mg/kg泵注和/或七氟烷0.5~1.0最低肺泡有效浓度(minimum alveolar concentration,MAC)吸入,瑞芬太尼每小时0.3 μg/kg静脉泵注,舒芬太尼(0.1 μg/kg)、芬太尼(1 μg/kg)间断静脉推注,维持血压、心率波动不超过基础值的20%;罗库溴铵或顺阿曲库铵间断静脉注射维持肌肉松弛,并予肛温、有创动脉血压、呼吸功能等监测,同时间断测定动脉血气电解质。肛温低于36 ℃时使用暖风机进行加温。根据4-2-1法则给予醋酸林格液,必要时予羟乙基淀粉输注。浓缩红细胞、冰冻血浆和血小板输注由麻醉医师根据患儿情况及其血红蛋白测定值决定,尽量维持血红蛋白大于8 g/dL。
1.4 失血量估算与分组
失血量估算,由以下3个部分估算值相加得到。①术中吸引量。②手术单血迹面积估算:10 cm×10 cm面积血迹,则估算失血量为5 mL;15 cm×15 cm面积血迹,则估算出血量为15 mL。③纱布称重:血纱布质量(g)减去干纱布质量(g)的差值作为失血量(mL)。
术中出血量大于等于其自身循环总血容量的20%为大出血组,小于20%为非大出血组。循环总血容量计算方法:≥36个月患儿为70 mL/kg,<36个月患儿为75 mL/kg。
1.5 统计学分析
采用SPSS 19.0统计软件进行数据分析。符合正态分布的定量资料以x±s表示,组间比较采用两独立样本t检验;非正态分布的定量资料以M(最小值~最大值)或M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。定性资料以频数(百分比)表示,组间比较采用χ2 检验。采用二分类Logistic回归模型分析患儿术中大出血的独立危险因素。双侧P<0.05表示差异具有统计学意义。
2 结果
2.1 患儿基本资料
本研究共纳入患儿239例,其中大出血组215例,非大出血组24例。大出血组患儿中位年龄11(3~76)个月,非大出血组中位年龄22(3~46)个月;大出血组患儿中位体质量9.6(4.0~18.4)kg,非大出血组患儿为12.0(7.8~29.0)kg;大出血组患儿中位身长75(39~110)cm,非大出血组患儿为85(67~108)cm。手术方式包括额眶前移术10例、颅顶重建术132例、额眶前移复合颅顶重建术92例、后颅窝重建术3例和上颌骨Lefort截骨术2例。其余情况如表1所示。
表1 儿童狭颅手术术中大出血的单因素分析
Tab 1
| Item | Massive bleeding group (n=215) | Non-massive bleeding group (n=24) | Z/χ2 value | P value |
|---|---|---|---|---|
| Gender/n(%) | 0.941 | 0.332 | ||
| Male | 140 (65.1) | 18 (75.0) | ||
| Female | 75 (34.9) | 6 (25.0) | ||
| Age/month | 11 (7, 21) | 22 (10, 30) | -2.301 | 0.021 |
| Weight/kg | 9.6 (8.4, 11.0) | 12.0 (10.1, 13.8) | -3.089 | 0.002 |
| Body length/cm | 75 (70, 82) | 85 (74, 94) | -3.436 | 0.001 |
| Previous craniofacial surgery/n(%) | 14 (6.5) | 3 (12.5) | 1.172 | 0.507 |
| Syndromic/n(%) | 12 (5.6) | 1 (4.2) | 0.084 | 0.772 |
| Hydrocephalus/n(%) | 10 (4.7) | 0 (0) | 1.165 | 0.590 |
| Family history/n(%) | 2 (0.9) | 0 (0) | 0.225 | 0.642 |
| Duration of symptom/month | 9 (6, 17) | 14 (6, 24) | -1.901 | 0.057 |
| Preoperative Hb/(g·L-1) | 121 (113, 126) | 125 (116, 130) | -1.369 | 0.171 |
| Preoperative hematocrit/% | 36.45 (38.00, 34.10) | 37.20 (38.90, 35.30) | -1.664 | 0.096 |
| Preoperative albumin/(g·L-1) | 41.4 (39.5, 44.2) | 42.7 (39.9, 44.0) | -0.584 | 0.559 |
| Lowest temperature in operation/℃ | 35.6 (35.0, 36.1) | 36.1 (35.2, 36.4) | -2.131 | 0.033 |
| Duration of surgery/min | 215.5 (184.0, 243.0) | 216.0 (176.0, 251.0) | -0.367 | 0.713 |
| Amount of crystalloid and colloids infusion/mL | 350 (200, 500) | 400 (263, 575) | -0.763 | 0.446 |
| Amount of blood products using | ||||
| RBC transfusion/mL | 300 (200, 300) | 150 (150, 300) | -3.169 | 0.002 |
| Plasma transfusion/mL | 100 (0, 100) | 100 (0, 100) | -1.506 | 0.132 |
| FFP/n(%) | 7 (3.3) | 0 (0) | 1.430 | 1.000 |
| Cryoprecipitate/n(%) | 8 (3.7) | 0 (0) | 0.924 | 1.000 |
| Use of hemostatic drugs/n(%) | ||||
| Hemocoagulase injection | 111 (5.2) | 8 (3.3) | 2.890 | 0.089 |
| Tranexamic acid | 18 (8.3) | 0 (0) | 2.173 | 0.140 |
| PPSB | 13 (6.0) | 0 (0) | 1.535 | 0.373 |
| Number of sutures/n(%) | 4.148 | 0.126 | ||
| 1 | 134 (62.3) | 10 (45.8) | ||
| 2 | 64 (29.8) | 12 (50.0) | ||
| ≥3 | 17 (7.9) | 1 (4.2) | ||
| Craniosynostosis type/n(%) | 13.268 | 0.010 | ||
| Scaphocephaly | 64 (29.8) | 6 (25.0) | ||
| Brachycephaly | 16 (7.4) | 2 (8.3) | ||
| Trigonocephaly | 39 (18.1) | 3 (12.5) | ||
| Plagiocephaly | 17 (7.9) | 1 (4.2) | ||
| Multiple | 79 (36.7) | 12 (50.0) | ||
| Type of operation/n(%) | 8.482 | 0.033 | ||
| CVR | 117 (54.5) | 15 (62.5) | ||
| FOA | 8 (3.7) | 2 (8.3) | ||
| CVR+FOA | 87 (40.5) | 5 (20.8) | ||
| Others | 3 (1.4) | 2 (8.3) |
2.2 儿童颅骨修补术中出血量的单因素分析
单因素分析结果(表1)显示,2组患儿早闭颅缝类型和手术方式存在差异,且大出血组患儿年龄、体质量、身长、术中最低体温低于非大出血组(均P<0.05),大出血组患儿术中红细胞悬液输入量高于非大出血组(P<0.05)。然而,2组患儿性别、既往颅面手术史、合并症,术前凝血功能以及术中输液量、血浆输入量、止血药物的使用、手术时间等差异均无统计学意义。
2.3 儿童颅骨修补术中出血量的二元Logistic回归分析
将单因素分析中2组差异具有统计学意义的变量,包括年龄、体质量、术中最低体温、早闭颅缝类型和手术方式等纳入二元Logistic回归分析模型,结果显示体质量(B=-0.24,OR=0.79,95%CI 0.64~0.96,P=0.018)是儿童颅骨修补术中大出血的独立危险因素,其余变量均无统计学意义。因体质量和身高存在共线性,参考既往文献资料纳入体质量作为自变量。
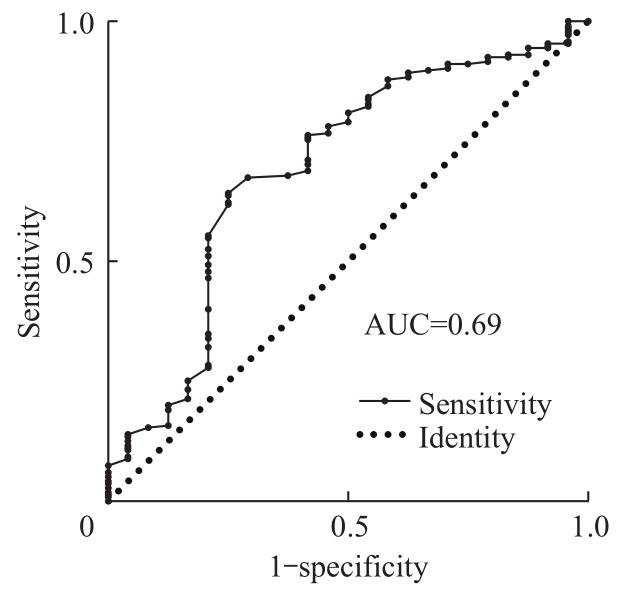
根据Logistic回归模型绘制受试者操作特征曲线(receiver operator characteristic curve,ROC曲线),曲线下面积(area under the curve,AUC)为0.69(95%CI 0.57~0.81),见图1。进一步计算体质量的约登指数为0.392,对应的体质量界值为10.45 kg,意味着体质量<10.45 kg的患儿在颅骨修补术中发生大出血的风险增加。
图1
图1
体质量预测狭颅症儿童颅骨修补术中大出血的ROC曲线
Fig 1
ROC curve of weight predicting intraoperative massive bleeding in pediatric patients during craniosynostosis surgery
3 讨论
围术期大出血是行颅骨修补手术的狭颅症患儿出现并发症,甚至死亡的主要原因。明确影响术中失血量的因素有助于及时识别高危患儿,提早预防和干预,从而改善预后。本研究单因素分析结果显示,患儿的体质量、年龄、术中最低体温、手术方式、早闭颅缝类型是影响术中出血量的因素。二元Logistic回归分析结果显示,体质量是开放性颅骨修补术中大出血的危险因素,且体质量低于10.45 kg的患儿出血量显著增加。根据2015年我国九市城区儿童体格发育调查数据[5]显示,若患儿体质量为10.45 kg,则年龄为12~18个月。自出生至18个月,小儿生长发育迅速,脑部尤为明显。出生时,大脑质量约为350 g,9个月时已是出生时的2倍以上,至3岁时则是出生时的3倍以上。头颅血容量在全身循环总血容量中占很大比例,因此颅脑手术容易造成出血量增加。其次,1岁以内的婴儿凝血功能发育不完善,表现为活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长,纤维蛋白原、凝血因子水平低[6],可能也是造成患儿术中出血量增加的原因。GOOBIE等[7]的研究结果显示,与体质量大于10 kg的患儿相比,10 kg以下患儿在颅骨修补术后由于大出血、贫血等血液系统不良事件,以及血流动力学严重不稳定、术后再插管等心肺系统不良事件而转入重症监护室的可能性明显增加。因此,手术时机的选择在不影响神经发育的同时,应考虑到低龄患儿术后并发症以及预后情况。
低体温可以抑制血小板功能,影响凝血级联反应中酶的活性,导致凝血功能障碍。因此,围手术期体温过低可能是造成术中出血增加的间接原因。轻度低温(体温降低<1 ℃)可能导致失血量增加约16%,输血相对风险增加约22%[8]。一项针对儿童的前瞻性队列研究[9]显示,尽管采用了主动和被动加温技术,患儿术中低体温的发生率仍高达46.6%。本研究结果发现,大出血组患儿术中最低体温明显低于非大出血组。尽管本研究中,患儿在术中均使用了被动保暖技术(手术被巾),并实时监测患儿肛温,在肛温低于36 ℃时使用主动保暖(暖风机)技术,但术中仍发生体温降低,这可能与术前等候时未采取保温措施,且术中输注常温晶体溶液有关。既往研究[10]也发现,麻醉诱导前30 min开始使用被动保温可以明显减少麻醉诱导引起的再分布性体温降低。这提示我们应加强患儿术前保温,尤其对于体质量低、手术时间长的患儿。
手术范围越大(如全颅重建术以及涉及额眶部的额眶前移术),术中出血量也越大。虽然本研究的单因素分析结果显示早闭颅缝类型和手术方式是影响术中出血量的因素,但结果未能显示出何种早闭颅缝类型的术中出血量更多,这可能与病例数不足有关。与传统开放性手术相比,改进后的手术技术,如颅骨内窥镜手术以及单条闭合颅缝切除术能够避免大面积的颅骨切开,明显减少手术出血量[2],但本中心尚未开展此类手术。
精细化的血液管理策略能减少围手术期出血量。常见的策略包括术中控制性降压、使用止血药物、血液稀释等。由于目前缺乏儿童术中低血压的定义和可能引起组织缺氧的血压界值,因此控制性降压技术应用于婴幼儿仍存在争议。鉴于患儿年龄较小,低血压可能造成的组织低灌注,以及婴幼儿本身对缺血缺氧的耐受性差等,本中心在此类手术中较少使用控制性降压技术。最近的研究[11-12]表明,氨甲环酸可以抑制纤溶亢进,显著减少颅骨修补手术中的失血量和异体血输注量,改善患儿预后。本研究仅18例患儿在术中使用了氨甲环酸,多为术中大出血时临时补救使用,使用方法为负荷量静脉滴注,未给予持续泵注。使用方法、时机的差异导致未能观察到氨甲环酸对术中出血量的影响。GOOBIE等[13]根据氨甲环酸的药代动力学模型,建议儿童手术中给药方案为负荷量10~30 mg/kg(最大2 g)泵注15 min,然后继续以每千克体质量5~10 mg/h速率输注,维持氨甲环酸血液浓度20~70 μg/mL,以达到最佳止血效果。对于可能存在大出血风险的患儿,建议术中及早、规范应用抗纤溶药物如氨甲环酸,以减少围手术期出血量。
本研究存在一定的局限性。首先,单中心回顾性研究的数据完整性和有效性有限。其次,由于患儿年龄较小,血容量低,受止血纱布、手术单以及术中冲洗液干扰,难以精确估算患儿失血量。既往研究大多根据GROSS等[14]研究的公式计算失血量,然而该公式忽视了血液稀释、浓缩对红细胞压积的影响,在估计儿童术中失血量方面是否合适尚不清楚。本中心过去几年一直使用相同的失血量估算方法,一定程度上保证了数据的一致性。此外,本研究仅考虑最低体温的影响,未能考虑到低体温持续时间对出血量的影响。
综上所述,患儿年龄、体质量、术中体温、手术方式早闭颅缝类型是影响开放性颅骨修补术中出血量的因素。体质量小、术中体温过低的患儿在开放性颅骨修补术中大出血的风险越大,特别是体质量<10.45 kg的患儿。对这类患儿应考虑选择创伤小的手术方式,同时加强围手术期的体温管理,合理使用凝血药物,减少大出血的发生。
研究经上海交通大学医学院附属上海儿童医学中心伦理委员会审查(批件号SCMSIRB-W2020050)通过。因回顾性研究性质,未签订知情同意书。
作者贡献声明
姜静、黄悦参与研究设计。姜静、卞勇参与数据收集及整理。姜静、黄悦、郑吉建参与论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by JIANG Jing and HUANG Yue. The data collection and analysis were carried out by JIANG Jing and BIAN Yong. The manuscript was drafted and revised by JIANG Jing, HUANG Yue and ZHENG Jijian. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献