为此,本研究采用家系全外显子组测序这一遗传性疾病诊断的重要手段,鉴定一个可疑Wolfram综合征的中国糖尿病家系的致病基因和突变位点,并进行相关临床性状分析,期冀为Wolfram综合征患者的早期诊断、早期干预及治疗提供参考。
1 对象与方法
1.1 研究对象
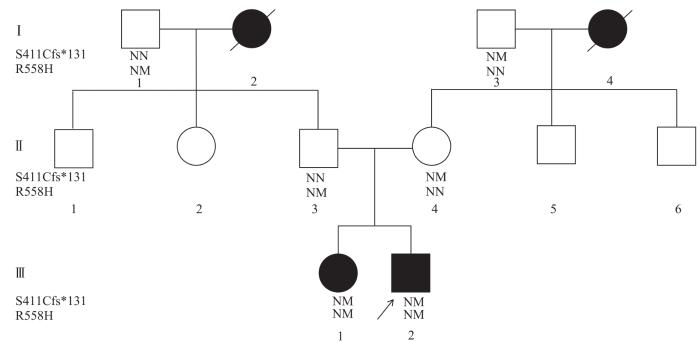
本研究对象为一个可疑Wolfram综合征的中国糖尿病家系,共12名成员。其中,先证者于2013年5月到新乡医学院第一附属医院内分泌科初诊,并于2022年7月和2023年4月共2次至该医院复诊;该家系其他成员分别为先证者的姐姐、父亲、母亲、祖父、祖母、伯伯、姑姑,及其外祖父、外祖母、大舅和小舅。收集该家系成员的临床资料。
1.1.1 先证者的情况
先证者(Ⅲ2)(图1),男性,18岁。2013年无明显诱因出现夜尿增多,每晚排尿5~6次,量较多。患者无口干、多饮、多食、体质量下降,无尿急、尿痛、排尿不尽感和血尿。空腹血糖16.57 mmol/L,静脉随机血糖20 mmol/L,尿糖++,血酮体0.7 mmol/L,谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)和蛋白酪氨酸磷酸化酶抗体(tyrosine phosphatase-like protein antibody,IA-2A)阴性,空腹C肽0.85 ng/mL,被诊断为糖尿病。予重组人胰岛素注射液于早(4 IU)、中(4 IU)、晚(5 IU)餐前0.5 h皮下注射,精蛋白重组人胰岛素注射液4 IU于睡前皮下注射。近年来因血糖波动,院外多次遵医嘱调整胰岛素降糖方案。2022年7月因四肢无力伴麻木就诊,入院完善检查。入院体格检查:身高176 cm,体质量64 kg,体质量指数(body mass index,BMI)20.66 kg/m2。询问出生养育史:患者足月顺产,出生时体质量3.1 kg,Apgar评分10分,新生儿期健康;予母乳喂养至12月龄,6月龄开始添加辅食;3月龄时会抬头,6月龄时会坐,1岁会走;身高发育与同龄儿相当,学习成绩优。入院完善辅助检查,静脉空腹血糖16.63 mmol/L,餐后2 h血糖23.31 mmol/L,糖化血红蛋白8.2%,血空腹C肽0.68 ng/mL,餐后2 h C肽1.07 ng/mL,GADA和IA-2A均阴性。尿微量白蛋白18.6 mg/L,尿糖+++,尿酮体阴性,尿比重1.020。肝肾功能、甲状腺功能正常,电解质、促肾上腺皮质激素、皮质醇及睾酮正常。B超提示膀胱残余尿。于2023年4月再次入院进行检查:眼底检查提示杯盘比(cup-disc ratio,C/D)>0.5,视神经呈苍白色、色淡;光学相干断层扫描(optical coherence tomography,OCT)发现左眼视网膜神经纤维层(retinal nerve fiber layer,RNFL)鼻侧超薄,右眼RNFL普遍超薄,提示双眼视神经萎缩;双侧眼球无震颤,无耳聋。入院后根据临床表现诊断为糖尿病、糖尿病周围神经病变、神经源性膀胱。予门冬胰岛素注射液于早(6 IU)、中(6 IU)、晚(11 IU)餐前5 min皮下注射,甘精胰岛素注射液26 IU于睡前皮下注射,阿卡波糖50 mg每日3次口服,二甲双胍0.5 g每日1次口服来控制血糖。
图1
图1
先证者家系图
Note: M—mutant allele; N—non-mutant allele. S411Cfs*131 is a frameshift mutation; R558H is a missense mutation. Arrow indicates the proband.
Fig 1
Family tree of the proband
1.1.2 家系其他成员的情况
先证者姐姐(Ⅲ1)(图1),女性,22岁。2013年因口干、多饮、多食伴体质量下降1个月余就诊。静脉随机血糖为20 mmol/L,尿糖++,尿酮弱阳性,血酮体0.7 mmol/L,空腹C肽0.91 ng/mL。GADA和IA-2A阴性。被诊断为糖尿病,予重组人胰岛素注射液三餐前皮下注射、精蛋白重组人胰岛素注射液睡前皮下注射控制血糖。院外根据血糖情况遵医嘱调整胰岛素降糖方案。患者2022年开始出现双眼视力下降,左侧为著。于2023年4月入院进行眼底检查:C/D增大,视神经苍白、色淡,左侧为著,符合视神经萎缩诊断。体格检查:身高161 cm,体质量49 kg,BMI 18.91 kg/m2。双侧眼球无震颤,无耳聋,双下肢无浮肿,双足背动脉搏动对称、有力,足部皮温正常。
先证者的父亲(Ⅱ3)45岁,母亲(Ⅱ4)48岁,伯伯(Ⅱ1)50岁,姑姑(Ⅱ2)54岁,祖父(Ⅰ1)78岁,祖母(Ⅰ2)73岁时因脑梗死去世;先证者的外祖父(Ⅰ3)83岁,大舅(Ⅱ5)51岁,小舅(Ⅱ6)54岁,外祖母(Ⅰ4)67岁时因脑梗死去世。以上家系所有亲属中,除先证者的大舅患有高血压以外,其他均无糖尿病、高血压、冠状动脉粥样硬化性心脏病(冠心病)、脑梗死疾病。
1.2 研究方法
1.2.1 基因组DNA提取
采集先证者及家系其他5位成员的外周血2 mL(EDTA抗凝),用QIAGEN血液DNA提取试剂盒(QIAamp DNA Blood Mini Kit,51104,QIAGEN公司,德国)抽提其基因组DNA。
1.2.2 全外显子组测序
使用KAPA HyperExome探针(Roche公司,瑞士)对外显子组DNA进行捕获富集,用NovaSeq6000测序仪(Illumina公司,美国)进行高通量测序,并进行生物信息数据分析。使用GATK BaseRecalibrator软件(version 3.7)对测序数据进行质量评估,用Burrows-Wheeler Aligner软件(BWA-MEM,version 0.7.17-r1188)将测序序列比对到人参考基因组(hg19/GRCh37),对检测出的突变位点进行注释。用Exome Aggregation Consortium(ExAC)数据库比对检测出的突变位点的频率。
1.2.3 Sanger测序
PCR扩增后对产物纯化,制备测序模板;在ABI 3500XL测序仪(Applied-Biosystems公司,美国)上进行正反向测序。测序引物序列见表1。
表1 测序引物序列
Tab 1
| Target mutation | Forward primer (5′→3′) | Reverse primer (5′→3′) |
|---|---|---|
| R558H | TTGGCCAGACCTTCATCACC | CTCCAGAGACGTGAACCACC |
| S411Cfs*131 | GAGAACTTCCGCACCCTCAC | CTGACGTTGAGGACGACCAG |
1.2.4 生物信息学软件分析蛋白结构、功能、物种保守性
用CADD(combined annotation dependent depletion)、DANN(domain-adversarial training of neural networks)、MetaSVM(meta-support vector machine)、Polyphen-2(polymorphism phenotyping v2)、SIFT(sorting intolerant from tolerant)和M-CAP(Mendelian clinically applicable pathogenicity)生物信息学软件预测突变位点对蛋白质结构和功能的影响。使用Swiss-Model软件构建野生型和突变型wolframin蛋白的三维结构,并用PyMOL软件(version 2.2.0)进行可视化。用Clustal Omega软件(version 1.2.2)比对突变位点的物种保守性:随机选择了包括人类在内的12个进化程度不同的物种,对每个物种的同源蛋白进行比对,并基于保守值确定变异的致病可能性。采用JNetPRED软件进行蛋白二级结构在线预测。
2 结果
2.1 先证者全外显子组测序结果分析
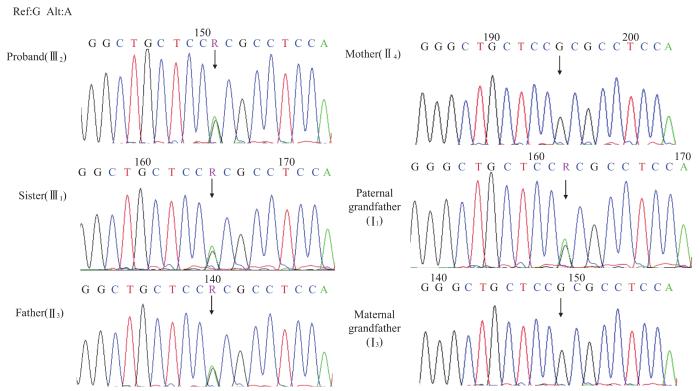
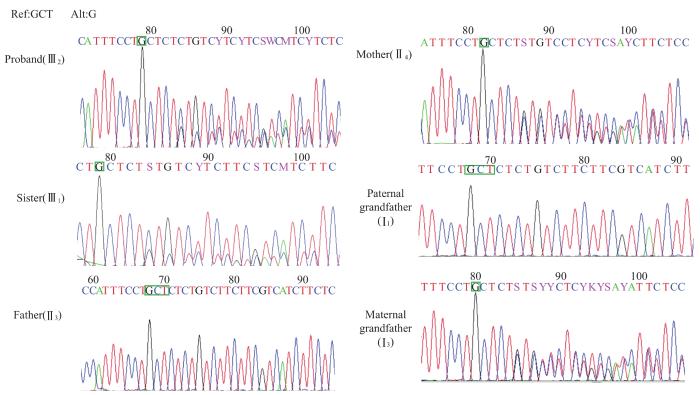
通过全外显子组测序鉴定出先证者携带WFS1基因的复合杂合突变:根据人参考基因组(hg19/GRCh37),一条染色体WFS1基因外显子8发生了一个错义突变,即第1 673位核苷酸由G突变成了A(c.G1673A),其翻译的蛋白中精氨酸变成了组氨酸(p.R558H);另一条染色体WFS1基因外显子8第1 228和1 229位核苷酸缺失(c.1228_1229del),导致了移码突变(p.S411Cfs*131)。经与ExAC数据库比对,该错义突变R558H在东亚人群中出现的频率为1/10 000;而移码突变则为国际上首次发现的新突变。根据《美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)遗传变异分类标准与指南》分析,R558H的致病性证据为PM2+PM3+PP3+PP4,提示该变异为可能致病性的变异;S411Cfs*131的致病性证据为PM2+PM3+PM4+PP4,提示该变异为可能致病性的变异。
2.2 家系其他成员测序结果分析
图2
图2
WFS1 基因R558H突变测序图
Note: ref—reference allele; alt—alter allele. Ⅲ2, Ⅲ1, Ⅱ3, and Ⅰ1 all carried the G/A heterozygous missense mutation.
Fig 2
Sequencing of R588H mutation of WFS1 gene
图3
图3
WFS1 基因S411Cfs*131突变测序图
Note: ref—reference allele; alt—alter allele. Ⅲ2, Ⅲ1, Ⅱ4 and Ⅰ3 all carried the GCT/G heterozygous frameshift mutation.
Fig 3
Sequencing of S411Cfs*131 mutation of WFS1 gene
2.3 生物信息学软件进行突变蛋白功能预测
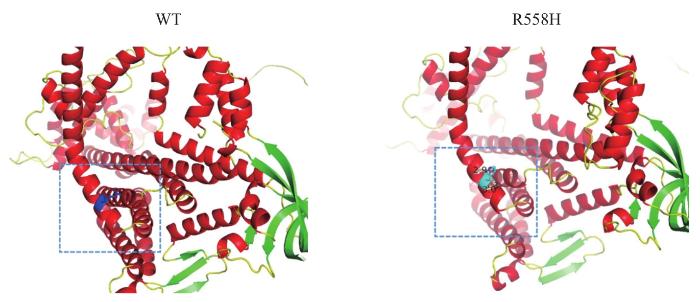
利用生物信息学软件对R558H突变进行蛋白功能损害程度预测,6种生物信息学软件的分析结果均提示该突变为损害突变:CADD软件显示损害程度为27.7(分值≥20为损害);DANN软件提示损害程度为0.999(分值≥0.98为损害);MetaSVM(D为损害)、Polyphen2(D为损害)、SIFT(D为损害)和M-CAP软件(D为损害)均提示损害突变。使用Swiss-Model软件构建野生型和突变型wolframin蛋白的三维结构,并用PyMOL软件进行可视化,可以观察到R558H错义突变附近蛋白质结构的改变(图4),其中R558H错义突变位于wolframin蛋白α螺旋结构域上。Clustal Omega软件提示,经比对该突变区域的氨基酸序列在人类、斑马鱼、黑猩猩、狗、小鼠、大鼠、牛、猕猴、鸡、非洲爪蟾、果蝇和疟蚊共12个物种中均具有较高的保守性(图5)。
图4
图4
Wolframin蛋白野生型及突变型三维结构
Note: WT—wild-type wolframin protein; R558H—R558H mutant wolframin protein. Dashed boxes indicate the protein structures surrounding the 558 amino acids. Red indicates the α-helix of the secondary structure of wolframin protein; green indicates the β-sheet of the secondary structure of wolframin protein.
Fig 4
Three-dimensional structures of wild-type and mutant wolframin proteins
图5
图5
WFS1 突变区域氨基酸序列保守性分析
Fig 5
Conservative analysis of amino acid sequences of WFS1 mutation region
3 讨论
全外显子组测序技术对于鉴定散发糖尿病和糖尿病家系的致病基因来说是一种简便、高效的方法,对糖尿病的遗传分子诊断和治疗具有重要意义[8-9]。2019年发表在Nature上的一项2型糖尿病(type 2 diabetes,T2D)全外显子组测序研究[10],收集并分析了来自5个不同种族(西班牙裔、欧裔、美国非裔、东亚及南亚人群)的20 791例T2D患者和24 440例对照,鉴定出4个基因上的罕见突变与T2D发病相关;同时显示由全外显子组测序发现的T2D罕见变异可解释25%的T2D的遗传度,远超全基因组关联研究(Genome-Wide Association Study,GWAS)的1.96%解析度。另一项研究[11]对1个由16个家庭成员组成的3代糖尿病家系进行全外显子组测序,首次鉴定出该家系中存在早期内体抗原1(early endosome antigen 1,EEA1)基因的N1072K突变,该突变可能是该家系罹患T2D的原因。
Wolfram综合征是一种常染色体隐性遗传病。现已明确90%~95%的Wolfram综合征是由染色体4p16.1的WFS1基因突变所致,患者为突变纯合子或复合突变杂合子,前者多有近亲通婚[12]。WFS1基因有8个外显子,编码890个氨基酸组成的蛋白质wloframin;该蛋白有8个跨膜节段,主要在脑、胰腺及心肌内表达。Wolframin是跨膜糖蛋白,仅在内质网表达,与膜运输、内质网应激的未折叠蛋白反应有关[13-15]。Wolfram综合征主要有糖尿病、视神经萎缩、尿崩症及神经性耳聋共4种临床表现;糖尿病及视神经萎缩较早出现,确诊者均有这2种表现;尿崩症及神经性耳聋仅见于2/3的患者;仅12%~54%的患者同时具有4种临床表现。此外,多种神经系统疾病,如认知障碍、眼球震颤和小脑性共济失调,可在患者起病30年后发展,并与该疾病的早期死亡有关[16]。其中,糖尿病常是首发疾病,发病年龄平均为6周岁,为胰岛素依赖型糖尿病[17]。Wolfram综合征在基因型及临床表型上具有高度异质性。虽然突变位点主要集中在8号外显子,但不同突变位点表现出不同的临床表型;且同一突变在不同人群都可表现出不同的疾病特点[18]。复杂的WFS1基因型-表型相关性给该综合征的诊断带来了一定的困难。
本研究利用家系全外显子组测序迅速定位2个糖尿病患者均携带WFS1基因的复合杂合突变R558H和S411Cfs*131,且2个突变分别来自父亲和母亲。错义突变R558H在人群中罕见,而移码突变S411Cfs*131则为国际上首次发现的新突变。先证者临床表型与WFS1基因致病的临床表型相符合,家系内表型和基因型共分离。其中,R558H突变最早于2003年首次在意大利Wolfram综合征人群中被报道[19]。2004年和2007年2个关于欧裔人群的研究[18,20]又相继在Wolfram综合征家系中筛查到了这一突变;携带该突变的患者临床表型较轻,除了糖尿病和视神经萎缩以外,没有出现耳聋、尿崩症和神经系统的问题;其中1例患者在29和35岁才分别罹患糖尿病和视神经萎缩,随访至38岁时仍没有出现其他症状。本研究的家系中2例糖尿病患者都是于青少年阶段起病,于起病9年后开始出现视神经萎缩,与文献报道的病例表型接近,提示WFS1基因型-表型之间存在一定的相关性。此外,2例患者还携带S411Cfs*131移码突变,且2例患者均在年龄较小时发病,是否出现尿崩症、神经性耳聋,以及其他泌尿系统和神经系统异常等仍需继续观察;因此,临床上仅仅根据患者现有的临床表现难以做出准确的诊断。本研究通过全外显子组测序这一遗传病诊断的重要手段,明确了患者患有Wolfram综合征,提示利用全外显子组测序可实现该病的早期诊断。对该类患者可进行纯音听力检测、禁水升压素试验、颅脑磁共振成像等相关检查,及时随访,有望实现早期干预及治疗。
此外,本研究发现的R558H错义突变位于wolframin蛋白的α螺旋结构域。α螺旋是跨膜蛋白存在于磷脂双分子层的主要结构域,其外侧集中了大量的疏水侧链基团,而内侧则含有带电的亲水侧链基团,这提示R558H突变可能通过改变蛋白质的亲水性和疏水性从而影响蛋白质的稳定性和构象。蛋白稳定性的改变可进一步影响其细胞膜运输、分泌、加工或内质网钙离子稳态的破坏,激活内质网未折叠蛋白反应,促进细胞凋亡。
综上所述,本研究通过全外显子组测序鉴定出的WFS1基因罕见错义突变R558H和新的移码突变S411Cfs*131为该家系Wolfram综合征的致病基因突变,携带该复合杂合突变的人群主要临床表现为糖尿病和视神经萎缩,不排除将来罹患其他系统障碍的可能性,应注意继续随访其表型。这2个突变对wolframin蛋白功能的影响有待于进一步研究。
作者贡献声明
孟祥雨、徐云、耿瑞娜负责临床数据收集;赖思宇负责提取基因组DNA;张红、张蓉负责全外显子组测序和生物信息学分析;闫丹丹、陈香慧完成了Sanger测序验证;孟祥雨、严婧撰写论文;胡承对论文进行了指导;严婧负责修改论文、指导论文。稿件的最终版本得到了所有作者的认可。
MENG Xiangyu, XU Yun and GENG Ruina collected the clinical data. LAI Siyu extracted genomic DNA. ZHANG Hong and ZHANG Rong performed the whole exome sequencing and bioinformatics analysis. YAN Dandan and CHEN Xianghui performed the Sanger sequencing. MENG Xiangyu and YAN Jing wrote the manuscript. HU Cheng provided advice and participated in discussions throughout this work. YAN Jing revised the manuscript and directed the research. The final version of the manuscript has been recognized by all authors.
利益冲突声明
本研究不存在利益冲突。
The authors declare no competing interests.
参考文献