原发性肝癌是全球常见的恶性肿瘤之一,占所有新发癌症病例的4.7%,位居第六。在所有癌症引起的死亡病例中,因肝癌导致的死亡病例数排在第四位,其中东亚和非洲地区的肝癌发病率和死亡率最高[1]。目前原发性肝癌的治疗主要分为手术治疗与非手术治疗。手术治疗包括肿瘤切除术与肝移植术,需根据肝癌患者的全身情况如肝硬化程度、肿瘤位置与大小决定手术切除方式及部位。然而,80%的肝癌患者在确诊时已伴有明显的肝硬化,往往不适宜进行手术治疗。肝癌的非手术治疗方法包括介入治疗、放射治疗、化学治疗(化疗)、免疫生物治疗、中药治疗和分子靶向治疗等[2]。对于晚期肝癌患者,传统全身化疗药物如奥沙利铂、吉西他滨和多柔比星的单药治疗成功率较低,而联合化疗方案在临床Ⅲ期试验中也效果不佳[3]。因此肝癌的治疗需要在分子病理研究的基础上,寻找差异性表达的基因,从而实施靶向和免疫治疗,以达到延长患者生命、提高生活质量的目的。
癌-睾丸抗原(cancer-testis antigen,CTA)是一类只在睾丸和肿瘤中特异表达的蛋白[4]。人类基因组包含200多个CTA基因,分为44个基因家族[5]。由于这些分子具有肿瘤特异性和高度的免疫原性,它们的发现为肿瘤诊断、免疫治疗研究及临床开发提供了前所未有的机会,其中一部分已经作为治疗性癌症疫苗的靶点被广泛研究[6]。已有研究发现,多个CTA如G抗原(G antigen,GAGE)[7]、胎儿和成人睾丸表达蛋白1(fetal and adult testis expressed 1,FATE1;CT4)[8]、锌指蛋白165(zinc finger protein 165,ZNF165;CT53)[9]等在肝癌中高表达,但它们是否参与调控肝癌的发生发展目前尚未见报道。因此,找到在肝癌细胞中高表达的CTA,研究其对肝癌发生发展的作用并揭示其机制,对于肝癌前期诊断和后期靶向治疗具有重要意义。
在本研究中,我们通过生物信息学分析发现CT57蛋白在肝癌中高表达,并且其表达水平与患者的预后显著相关;因此通过进一步的实验探究CT57在促进肝癌细胞增殖、侵袭和迁移中的作用,并初步探讨可能的分子机制,旨在为肝癌的临床治疗提供新的潜在靶点。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 细胞系及实验动物
人胚肾上皮永生化细胞系HEK293T(简称293T),人正常乳腺细胞MCF10A,人乳腺癌细胞MCF7,人正常肺上皮细胞Beas2B,人肺癌细胞A549、CRL5889,人正常肝细胞LO2,人肝癌细胞系PLC/PRF/5、HepG2、Hep3B和Huh7,质粒构建中使用的pLVX-mCherry、pGreen-Puro质粒以及慢病毒包装中使用的dR8.9、VSVG质粒均在本机构保存并使用。
雄性Balb/c无胸腺裸鼠10只,8周龄,SPF级,购于上海吉辉实验动物饲养有限公司,实验动物生产许可证号为SCXK(沪)2022-0009。裸鼠饲养于上海交通大学医学院附属第九人民医院SPF级动物房,实验动物使用许可证号为SYXK(沪)2020-0025。动物房为恒温恒湿,明暗交替时间为12 h/12 h,水和饲料持续供应。
1.1.2 主要试剂及仪器
胎牛血清(fetal bovine serum,FBS)、胰酶(Gibco,美国),DMEM培养基(上海源培生物科技股份有限公司),基质胶Matrigel(BD,美国),RNA抽提试剂盒(Qiagen,德国),高保真PCR预混液(南京诺唯赞生物科技股份有限公司),无内毒素质粒小提中量试剂盒[天根生化科技(北京)有限公司],mRNA反转录试剂盒、SYBE Green定量PCR试剂盒(TaKaRa,日本),限制性核酸内切酶、T4 DNA连接酶、细胞转染试剂盒Lipo3000、CT57抗体、Alexa Fluor™ 555标记羊抗鼠IgG-H&L(Thermo Fisher,美国),BCA蛋白浓度测定试剂盒、细胞计数试剂盒8(Cell Counting Kit-8,CCK-8;上海碧云天生物技术股份有限公司),预制蛋白胶(南京金斯瑞生物科技有限公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、辣根过氧化物酶(HRP)标记的羊抗鼠重组二抗、HRP-羊抗兔二抗(Proteintech,美国),重组anti-Ki67抗体[B56](Abcam,英国)。
实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪LightCycler 480 Instrument II(Roche,瑞士),激光扫描共聚焦显微镜LSM880(ZEISS,德国),凝胶成像系统Amersham Imager 600(GE,美国),酶标仪VICTOR Nivo、高通量细胞成像分析仪Operatta(PerkinElmer,美国),流式细胞分析仪LSRFortessa、流式细胞分选仪Influx(BD,美国),实时无标记细胞功能分析(real time cellular analysis,RTCA)仪xCELLigence RTCA DP(Agilent,美国),Nanodrop One微量分光光度计(Thermo Fisher,美国)。
1.2 研究方法
1.2.1 生物信息学分析
使用TCGAbiolinks软件v2.20.1从肿瘤基因组图谱计划(The Cancer Genome Atlas Program,TCGA)数据库(
1.2.2 细胞培养及传代
PLC/PRF/5、HepG2、Hep3B和Huh7细胞使用完全培养基(含10% FBS的DMEM培养基)进行培养。培养条件为37 ℃、5% CO2。
1.2.3 构建敲低与过表达CT57的细胞系
表达型质粒构建:将扩增的CT57全长编码序列(coding sequence,CDS)插入pLVX-mCherry载体构建pLVX-CT57表达质粒。
短发夹RNA(short hairpin RNA,shRNA)质粒构建:分别将特异性靶向CT57的shRNA片段与线性化的pGreen-Puro载体连接,构建CT57敲低质粒。特异性靶向CT57的shRNA片段序列为CGAGAAGATGACCCAGATCAT(sh-1)和CGAAA CTACCTTCAACTCCAT(sh-2)。同时,使用无靶向效应的序列插入pGreen-Puro载体构建阴性对照。
细胞转染:向培养皿中接种处于对数生长期的293T细胞,待其生长汇合度达60%~70%时转染慢病毒pGreen-ctrl/sh-1/sh-2及包装质粒dR8.9、VSVG,48 h后收取病毒,分别感染PLC/PRF/5、HepG2、Hep3B和Huh7细胞。
1.2.4 Western blotting
在细胞稳定培养24~48 h后,加入RIPA裂解液并超声裂解细胞(24 s,8个循环)。使用BCA蛋白浓度测定试剂盒测定蛋白浓度,使用4%~12%的预制蛋白胶分离蛋白。电泳结束后采用湿转法将蛋白转移至PVDF膜,使用5%脱脂牛奶室温封闭1 h,然后加入一抗4 ℃孵育过夜,TBST洗3次后室温孵育二抗1 h,TBST再次清洗后,使用化学发光(ECL)法显影并拍照。
1.2.5 细胞增殖实验
使用CCK-8检测细胞增殖情况。将对数生长期的细胞计数后按1×103个/孔接种入96孔板,设立6个重复孔。细胞每培养24 h后,吸去96孔板中的培养液并在每孔中加入稀释后的检测试剂继续培养4 h,使用酶标仪测定各孔在450 nm波长下的吸光度值[D(450 nm)]。根据公式D(450 nm)实验组/D(450 nm)对照组×100%,计算相对细胞活力,以此判断各组细胞增殖情况。
1.2.6 细胞划痕实验
在12孔板中,每孔均匀接种5×105个细胞,继续培养至细胞汇合度达到100%,使用200 μL移液枪吸头进行划痕。适当PBS清洗后,使用含2% FBS的培养基继续培养。每培养12 h使用高通量细胞成像分析仪扫描记录细胞间划痕愈合情况。
1.2.7 软琼脂克隆形成实验
在6孔板每孔中预铺2 mL含0.8%琼脂糖的DMEM完全培养基,室温静置30 min待其凝固。细胞经胰酶消化后,悬浮于含0.4%琼脂糖的完全培养基中,按5×103~4×104个/孔的细胞密度加入预铺琼脂糖的6孔板,4 ℃放置10 min待其凝固,上层加入1 mL含10% FBS的DMEM培养基。后于细胞培养箱中培养,每4 d添加适量完全培养基。待细胞克隆形成后,向6孔板内加入0.1%的结晶紫染料,室温孵育30 min,弃去染色液,用水洗净背景色,拍照记录结果。实验重复3次。
1.2.8 Ki67免疫荧光染色实验
细胞经胰酶消化后计数,向薄底96孔板每孔加入5×103个细胞和200 μL培养基培养24 h。实验前弃去培养基,用PBS清洗细胞,4%多聚甲醛室温固定10 min后,加入PBS保存。进行实验时用PBST清洗3次,然后用封闭液(5%牛血清白蛋白+PBS+0.1% Triton X-100)室温封闭30 min,随后加入Ki67抗体4 ℃孵育过夜;PBST洗3次,加入荧光二抗,室温与避光条件下在摇床上孵育40 min;PBST洗3次,加入DAPI,室温条件下于摇床上染色10 min;最后用PBST清洗10 min,使用抗荧光猝灭剂封层。染色结束后使用激光扫描共聚焦显微镜对目的蛋白进行扫描分析。
1.2.9 Matrigel中的三维培养实验
在预冷的24孔板中每孔加入75 µL Matrigel(1.0 mg/mL),操作过程在冰上完成以防止Matrigel凝固;之后,将24孔板置于37 ℃培养箱静置15~20 min,使其充分凝聚。消化对数生长期的细胞,离心计数后,将细胞悬浮于含2% Matrigel的完全培养液中,调整细胞浓度至1×104个/mL,每孔加入500 µL细胞悬液于已凝聚的Matrigel上,置于细胞培养箱中培养1~2周,观察细胞成球情况和形态学变化。
1.2.10 细胞周期实验
将胰酶消化的细胞离心后吸除上清液,再用2 mL PBS重悬细胞,离心后吸除上清液,滴入无水乙醇使其终浓度为70%,-20 ℃固定24 h。离心后吸除上清液,PBS重悬细胞,再次离心后避光加入500 μL含染色液碘化丙啶(propidium iodide,PI)、RNA酶A的结合缓冲液,37 ℃避光30 min。使用流式细胞仪检测细胞周期分布,并用FlowJo分析软件v.10.8.1进行细胞周期拟合分析。
1.2.11 Transwell细胞迁移/侵袭实验
利用RTCA仪检测细胞穿过铺有Matrigel的Transwell小室底部膜的能力。预先浸润CIM-Plate 16孔板,并在每孔下室中加入165 μL完全培养基;在每孔上室中加入1∶40稀释的Matrigel 15 μL后置于37 ℃培养箱中静置30 min,然后每孔加入30 μL无血清培养基并置入RTCA仪中测定背景值。消化并使用无血清培养基重悬细胞,于每孔上室接种2×104个细胞并置于RTCA仪中记录48 h。
1.2.12 qRT-PCR实验
使用RNA抽提试剂盒提取细胞总RNA,通过微量分光光度计定量后取2 μg RNA,利用反转录试剂盒获得cDNA。使用SYBE Green试剂盒按照说明书进行qRT-PCR检测。实验结果均以GAPDH作为参考进行归一化处理,每种基因的相对表达量以
表1 qRT-PCR引物序列
Tab 1
| Primer | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| GAPDH | AATGGGCAGCCGTTAGGAAA | GCCCAATACGACCAAATCAGAG |
| CT57 | GAACATCGTGAACTACCTACCG | CAAGGGTGTCTCCGTGATGAT |
| ECAD | TCTTCAATCCCACCACGTACA | CTGGGGTATTGGGGGCATC |
| VIM | GACGCCATCAACACCGAGTT | CTTTGTCGTTGGTTAGCTGGT |
| OCLN | GGCACCTGCATACTCACCC | CTGGGAGAGCAACTCATCCTC |
| TWIST1 | GTCCGCAGTCTTACGAGGAG | GCTTGAGGGTCTGAATCTTGCT |
| MMP2 | TACAGGATCATTGGCTACACACC | GGTCACATCGCTCCAGACT |
| FOXM1 | CGTCGGCCACTGATTCTCAAA | GGCAGGGGATCTCTTAGGTTC |
| SNA | TCGGAAGCCTAACTACAGCGA | AGATGAGCATTGGCAGCGAG |
1.2.13 裸鼠皮下成瘤实验
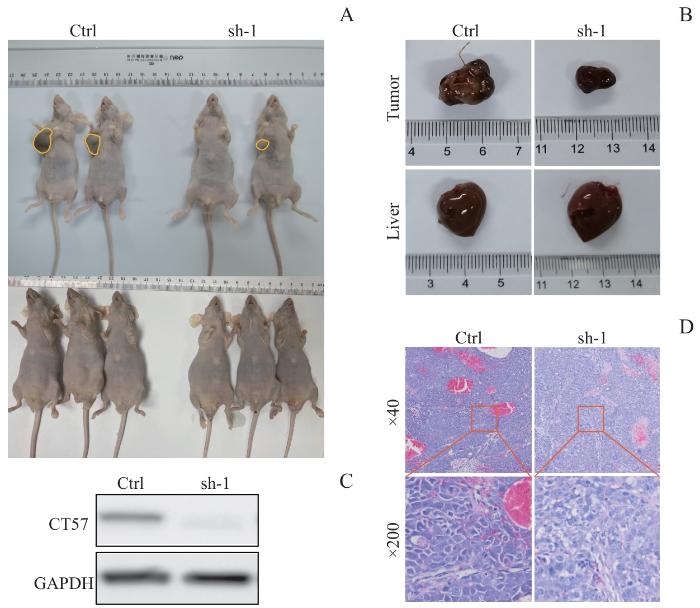
选取8周龄雄性Balb/c无胸腺裸鼠10只,以注射Hep3B-Ctrl细胞的裸鼠为对照组,以注射Hep3B-sh-1细胞的裸鼠为实验组,每组5只。于每只裸鼠腋下皮下注射100 μL PBS溶液重悬的细胞(2×106个)。继续饲养2个月,观察裸鼠成瘤情况并记录。取部分肿瘤组织经液氮冷冻研磨后提取蛋白,行Western blotting分析CT57表达情况。将剩余肿瘤标本进行脱水石蜡包埋,并每隔5 μm切取一张组织切片后进行苏木精-伊红(hematoxylin-eosin,H-E)染色并观察。
H-E染色:将组织切片置于60 ℃条件下脱蜡,并在二甲苯、乙醇溶液、水中依次浸泡复水。使用苏木精染液浸泡切片5 min后,流水冲洗,于1%盐酸乙醇溶液中洗脱多余染液,随后放置于水中室温静置15 min,再将切片于伊红染液中浸泡5 min,使用流水清洗。将切片依次在水、乙醇溶液、二甲苯中浸泡,取出晾干后滴加中性树脂,盖上盖玻片封片。
1.3 统计学分析
使用GraphPad Prism 8.0软件对数据进行统计分析。定量资料用x±s表示,组间比较采用t检验;生存分析采用Kaplan-Meier法。P<0.05表示差异有统计学意义。
2 结果
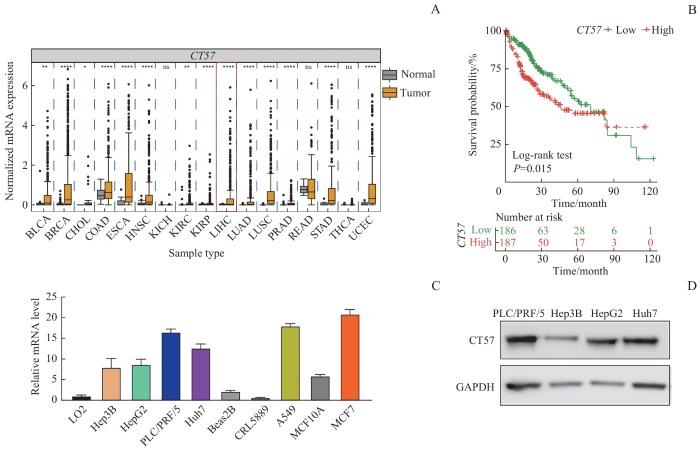
2.1 CT57 在肝癌组织及细胞系中的表达情况
图1
图1
CT57 在肝癌组织及细胞株中的表达情况以及与患者预后的关系
Note: A. CT57 expression levels of different tumor types in the TCGA database. BLCA—bladder urothelial carcinoma; BRCA—breast invasive carcinoma; CHOL—cholangiocarcinoma; COAD—colon adenocarcinoma; ESCA—esophageal carcinoma; HNSC—head and neck squamous cell carcinoma; KICH—kidney chromophobe; KIRC—kidney renal clear cell carcinoma; KIRP—kidney renal papillary cell carcinoma; LIHC—liver hepatocellular carcinoma; LUAD—lung adenocarcinoma; LUSC—lung squamous cell carcinoma; PRAD—prostate adenocarcinoma; READ—rectum adenocarcinoma; STAD—stomach adenocarcinoma; THCA—thyroid carcinoma; UCEC—uterine corpus endometrial carcinoma. The expression of CT57 in the liver cancer is marked by the red box. B. Kaplan-Meier survival curves comparison between the liver cancer patients with high expression and low expression of CT57 in livers. C. The mRNA expression levels of CT57 in cell lines. D. Western blotting analysis of CT57 expression level in four human liver cancer cells.
Fig 1
Expression of CT57 in liver cancer tissues and cell lines and its relationship with patients′ prognosis
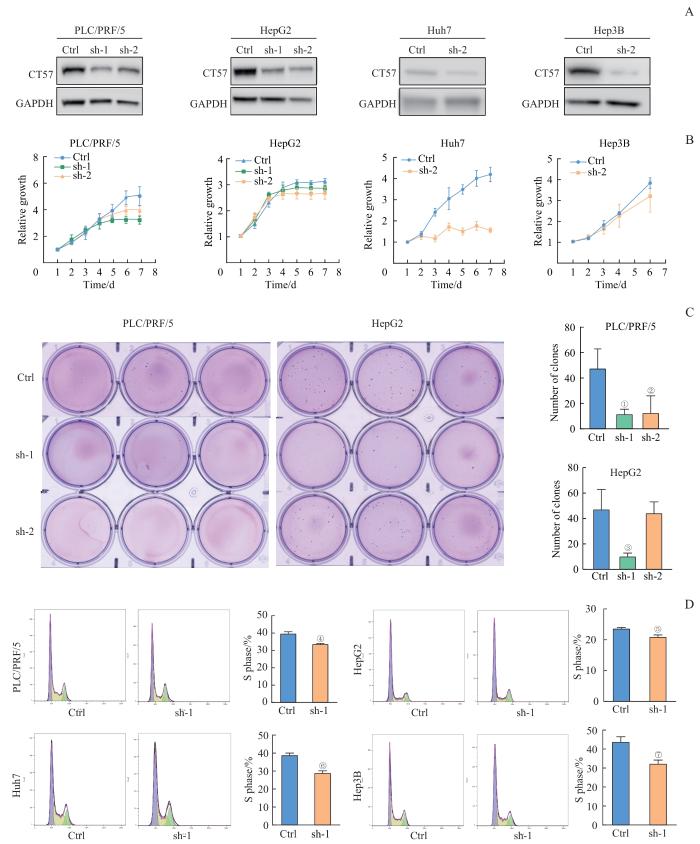
2.2 敲低 CT57 抑制肝癌细胞的增殖
我们利用293T细胞包装慢病毒pGreen-ctrl/sh-1/sh-2,并感染PLC/PRF/5、HepG2、Hep3B和Huh7细胞,利用嘌呤霉素筛选构建成功的稳转株。实验结果如图2所示。通过Western blotting检测CT57表达水平,结果显示敲低细胞系的CT57表达水平较对照组显著下降(图2A)。对于4个肝癌细胞株我们均分别用2种shRNA来敲低CT57,但是Huh7和Hep3B细胞转染sh-1后,细胞均死亡,重复3次结果均如此。考虑到在PLC/PRF/5和HepG2细胞中sh-1的敲低效果强于sh-2,我们推测Huh7和Hep3B细胞转染sh-1后由于不能耐受CT57水平的大幅降低而死亡,这也从侧面说明CT57对于这2个细胞系的生长非常重要。此外,CCK-8实验结果显示,敲低CT57导致4个肝癌细胞株的增殖速度较对照组发生不同程度的降低(图2B)。
图2
图2
敲低 CT57 对肝癌细胞增殖能力及细胞周期的影响
Note: A. CT57 knockdown (sh-1 and sh-2) efficiency detected by Western blotting analysis. B. CCK‒8 proliferation assay. C. Soft agar colony formation assay. D. Flow cytometry for analyzing cell cycle. ①P=0.016, ②P=0.039, ③P=0.015, ④P=0.014, ⑤P=0.026, ⑥P=0.012, ⑦P=0.003, compared with the corresponding control (Ctrl) group.
Fig 2
Effect of CT57 knockdown on proliferation and cell cycle in liver cancer cells
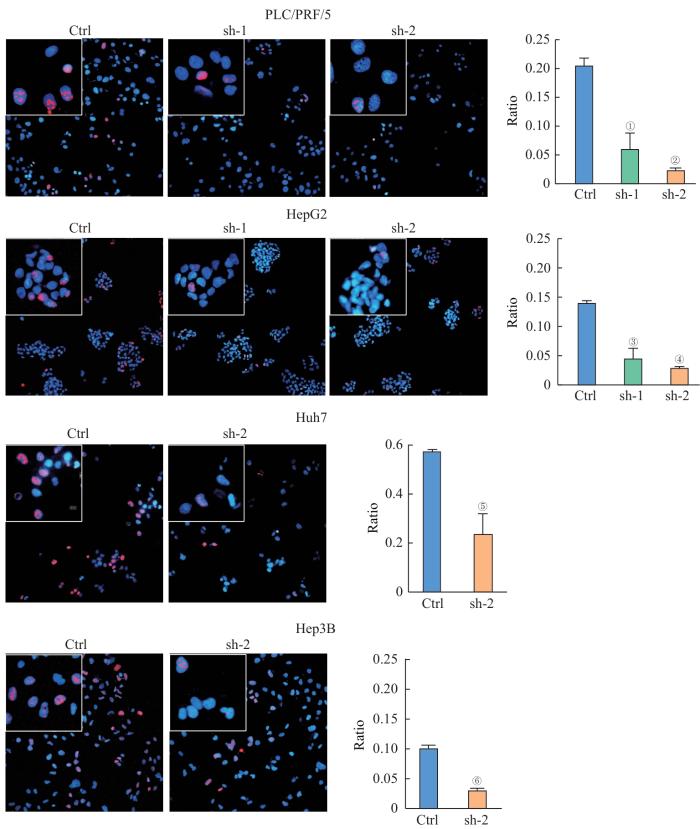
我们进一步对这4种细胞进行了Ki67免疫荧光染色,在200倍镜下选取3个视野进行统计分析,并选择代表性视野展示。我们发现敲低CT57后,Ki67阳性细胞的比例明显降低,提示处于活跃分裂期的细胞比例明显减少,细胞的增殖能力受到抑制(图3)。
图3
图3
敲低 CT57 后肝癌细胞Ki67阳性细胞比例的变化
Note:Ki67 immunostaining of indicated cells (×200 in big boxes; ×800 in small boxes). ①P=0.020, ②P=0.002, ③P=0.015, ④P=0.000, ⑤P=0.027, ⑥P=0.003, compared with the corresponding control (Ctrl) group.
Fig 3
Changes in the proportion of Ki67-positive cells in liver cancer cells after knocking down CT57
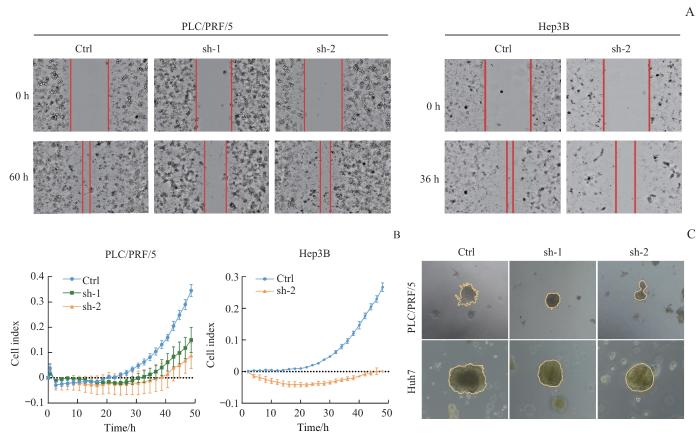
2.3 敲低 CT57 抑制肝癌细胞的侵袭和迁移
RTCA仪是将微电子细胞传感器整合到细胞板底部的细胞阻抗检测传感系统,可以用于实时、动态、定量地跟踪细胞形态和增殖分化等改变。我们利用RTCA仪检测细胞穿过Transwell底部膜的能力探究CT57对肝癌细胞侵袭/迁移能力的影响。结果显示,与对照组相比,敲低CT57后PLC/PRF/5和Hep3B细胞侵袭/迁移能力明显降低。划痕实验结果同样显示,敲低CT57后,PLC/PRF/5和Hep3B细胞迁移速度降低,划痕愈合减慢(图4A、B)。HepG2和Huh7细胞因迁移较慢无法在48 h内出现划痕明显愈合或穿过小室底部膜,所以不适合用这2种实验检测其侵袭/迁移能力。三维培养PLC/PRF/5和Huh7细胞结果显示,与对照组相比,敲低CT57后细胞形成的克隆较小且克隆团伸出的分枝状结构更少(图4C),HepG2和Hep3B细胞在Matrigel中生长极其缓慢,并未形成足够观察的细胞团。这些实验结果表明敲低CT57后肝癌细胞的侵袭和迁移能力下降。
图4
图4
敲低 CT57 对肝癌细胞侵袭和迁移能力的影响
Note: A. Wound healing assay (×200) of indicated cells. B. RTCA coupled Transwell migration/invasion assay of indicated cells. C. 3D culture of indicated cells (×200).
Fig 4
Effect of CT57 knockdown on invasion and migration ability of liver cancer cells
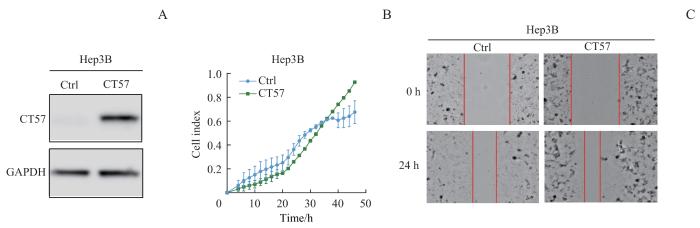
2.4 过表达CT57促进肝癌细胞的侵袭和迁移
图5
图5
CT57过表达对肝癌细胞侵袭和迁移能力的影响
Note: A. Western blotting analysis of CT57 overexpression in Hep3B cells. B. RTCA coupled Transwell migration/invasion assay of Hep3B cells. C. Wound healing assay (×200) of Hep3B cells.
Fig 5
Effect of CT57 overexpression on invasion and migration ability of liver cancer cells
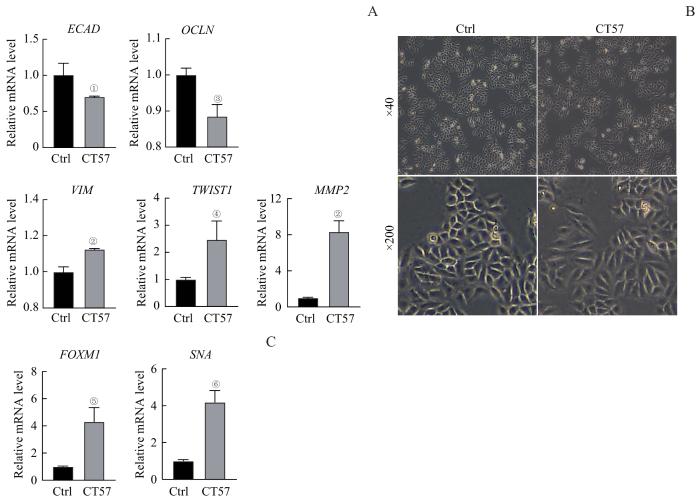
2.5 CT57调控肝癌细胞的上皮间质转化信号通路
图6
图6
CT57过表达对肝癌细胞EMT的影响
Note: A. The mRNA expression of EMT markers after CT57 overexpression in Hep3B cells detected by qRT-PCR. B. The cell morphology after overexpression of CT57 in Hep3B cells. C. FOXM1 and SNA expression after CT57 overexpression in Hep3B cells detected by qRT-PCR. ①P=0.031, ②P=0.002, ③P=0.006, ④P=0.021, ⑤P=0.035, ⑥P=0.012, compared with the corresponding control (Ctrl) group.
Fig 6
Effect of CT57 overexpression on EMT in liver cancer cells
2.6 敲低 CT57 抑制肝癌细胞在裸鼠皮下成瘤
图7
图7
敲低 CT57 对肝癌细胞在裸鼠皮下成瘤的影响
Note: A. The tumorigenic ability of Hep3B cells after knockdown of CT57 in nude mice. B. Tumor and liver size in nude mice. C. Western blotting analysis of CT57 knockdown efficiency in the tumors. D. H-E staining of tumor tissues.
Fig 7
Effect of CT57 knockdown on subcutaneous tumor formation of liver cancer cells in nude mice
3 讨论
细胞周期的改变是肿瘤发生与进展的关键步骤之一,细胞周期的紊乱可能引发细胞癌变。肿瘤的一些特性,例如无限复制增殖、生长信号自给自足和对生长抑制信号不敏感,可能是细胞周期失调造成的直接结果[20]。本研究通过体外细胞实验证实,抑制CT57表达可导致肝癌细胞的增殖能力和克隆形成能力下降;通过裸鼠体内成瘤实验证实,抑制CT57表达可导致肝癌细胞成瘤能力下降。同时细胞周期实验显示,敲低CT57的肝癌细胞中处于有丝分裂S期的细胞显著减少;免疫荧光实验显示,敲低CT57的肝癌细胞中Ki67阳性细胞显著减少。这些结果表明CT57可能通过调控细胞周期参与肝癌的恶性发展。
值得一提的是,CT57对不同肝癌细胞系增殖、克隆形成能力均有促进作用,但产生的影响程度并不相同,这可能是不同的肿瘤细胞系之间表达背景的差异导致的。肿瘤细胞的一个重要特征是它们的异质性,即使是同一类型的肿瘤,不同的细胞系也会表现出不同的基因稳定性和基因突变,以及各自独特的表观遗传重编程[21]。除此之外,这种差异还可能与细胞本身生长快慢有关,对于生长较快的PLC/PRF/5和Huh7细胞,敲低CT57作用较为明显;Hep3B和HepG2细胞增殖较慢,因此CCK-8实验没有观察到明显的差异。
肿瘤细胞侵袭和迁移能力的变化也是评价肿瘤治疗潜在靶点的核心指标之一。EMT是上皮细胞失去其形态和功能逐渐转化为间质样细胞的过程,它赋予细胞转移和入侵的能力,不仅在发育过程中起着关键的作用,而且还参与组织愈合、器官纤维化和肿瘤侵袭等过程。此前的研究[13]已经表明,CT57可以促进肺癌细胞的EMT。本研究通过细胞划痕实验和RTCA结合的Transwell实验证实,敲低CT57显著抑制肝癌细胞的侵袭和迁移能力;过表达CT57则会导致上皮细胞标志物ECAD和OCLN的下调,以及间质细胞标志物VIM、TWIST1和MMP2的上调。其中VIM蛋白是肿瘤细胞运动过程中的关键骨架蛋白,通过促进肿瘤细胞伪足形成提升其侵袭和迁移能力;MMP2发挥着降解细胞外基质和降低细胞黏附力的功能,因此被认为是肿瘤细胞获得侵袭和迁移能力的因素之一;而TWIST1常通过调控VIM和MMP2的表达来发挥作用[22]。这些结果证明,CT57可能通过促进肝癌细胞EMT来促进其侵袭和迁移。
基因的突变或过表达诱导肿瘤细胞发生EMT过程几乎都是通过调控某些转录因子而实现的,其中最主要的3个诱导因子家族为TWIST、SNAIL、ZEB[23]。此前关于肺癌的研究[17]表明,敲低CT57导致细胞迁移和侵袭能力降低,并显著抑制FOXM1、微管解聚蛋白1(stathmin 1,STMN1)、Polo样激酶1(polo like kinase 1,PLK1)和含杆状病毒IAP重复蛋白5(baculoviral IAP repeat containing 5,BIRC5)的表达。其中FOXM1属于FOX转录因子家族,参与调节细胞分化、增殖、凋亡及维持干细胞多能性等生理过程[24-25],并在包括肝癌在内的多种肿瘤中高表达[26-27]。在肺癌中,FOXM1能够与EMT相关转录因子SNA的启动子结合,诱导其表达并抑制ECAD的表达[28]。而在胶质瘤中FOXM1可以直接靶向β-联蛋白(β-catenin),与之形成复合物引导β-catenin进入细胞核并与淋巴增强因子(lymphoid enhancer factor,LEF)相互作用,形成β-catenin-TCF/LEF复合物,激活WNT靶基因来启动EMT,从而促进肿瘤的侵袭与转移[29-30]。我们的研究也发现在肝癌细胞Hep3B中上调CT57可以促进FOXM1表达,这为CT57促进肝癌细胞EMT的机制提供了可能的解释。
综上所述,本研究发现CT57在肝癌组织中高表达且与患者预后不良相关;敲低CT57可导致细胞周期阻滞,从而抑制肝癌细胞增殖和裸鼠皮下成瘤;体外实验证实,敲低CT57可抑制肝癌细胞的侵袭和迁移,而过表达CT57可促进肝癌细胞的EMT,进而增强其侵袭和迁移能力。这些研究结果为肝癌的临床治疗提供了新的科学依据,CT57有望成为肝癌分子靶向治疗的新靶点。
作者贡献声明
雷鸣设计并指导了整个课题的研究,罗蓝鸽完成所有的实验操作、数据收集、数据分析处理与文章撰写的工作,郑超负责实验指导以及整篇论文的修改。所有作者均阅读并同意最终稿件的提交。
AUTHOR's CONTRIBUTIONS
LEI Ming designed and guided the whole research project. LUO Lange completed the work of experiments, data collection, data analysis and processing, and article writing. ZHENG Chao were responsible for the guidance of experiment design and the revision of the whole paper. All authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献