EVT在胎盘植入过程中表现出高度的侵袭、迁移和增殖,这与癌症侵袭过程中观察到的病理效应相似[4]。转移相关蛋白1(metastasis-associated protein 1,MTA1)在肿瘤中具有调控细胞侵袭和转移的作用,且与MTA1功能密切相关的因素如缺氧、基质金属蛋白酶(matrix metalloproteinase,MMP)等均与PE病理发生过程有关。我们推测,内源性MTA1表达可能对胎盘滋养细胞的功能非常重要。本研究拟探讨MTA1在PE胎盘组织中的表达及其对其滋养层细胞功能的影响,以期为妊娠相关胎盘疾病的预防和治疗提供参考。
1 材料与方法
1.1 胎盘来源与分组
随机选取2015年3月—2017年9月在中国人民解放军空军军医大学第一附属(西京)医院产科住院分娩的PE孕妇20例(PE组),孕妇年龄22~34岁,平均年龄(31.4±3.5)岁,孕龄(33.4±2.3)周。以同期在该院分娩的健康妊娠孕妇35例作为对照组,孕妇年龄(29.3±4.1)岁,孕龄(39.1±0.6)周。纳入标准:月经周期规律,且具备明确的末次月经时间;经B超证实为宫内单胎妊娠;早孕B超符合停经天数;经剖宫产终止妊娠。排除标准:妊娠期糖尿病、肾病、原发性高血压、甲状腺疾病等,或存在不能用子痫前期解释的血、尿、生化指标异常。所有小鼠由中国人民解放军空军军医大学实验动物中心提供,动物生产许可证号为SCXK2019-001。
妊娠20周后出现收缩压≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥90 mmHg,合并以下任意一种不良情况诊断为PE。① 血压不断上升,收缩压≥160 mmHg和/或舒张压≥110 mmHg。② 24 h蛋白尿≥5.0 g,或随机尿蛋白≥(+++)。③ 视觉不良、持续性头痛或其他脑神经症状。④ 上腹持续疼痛,有肝破裂或肝包膜下血肿表现。⑤ 肝脏功能异常:谷丙转氨酶或谷草转氨酶水平上升。⑥ 肾功能异常:血肌酐(Scr)>106 μmol/L,或少尿(每小时尿量少于17 mL或24 h尿量少于400 mL)。⑦ 低蛋白血症合并腹腔积血(或胸腔积液)。⑧ 血液系统不良表现:血小板不断降低且<100×109个/L,血清乳酸脱氢酶(LDH)上调,血管内溶血,黄疸或贫血。⑨ 肺水肿、心力衰竭。⑩ 胎儿生长受限或羊水过少。
1.2 胎盘标本采集
孕妇胎盘娩出后避开钙化点,直视下在胎盘母体面中央距脐根2 cm处剪取全层的一小块绒毛组织5份,大小约2 cm×4 cm×1 cm,经生理盐水清洗干净后,放入固定液甲醛中(固定液的体积为胎盘组织的20倍),用于形态学检测;另取胎盘中央部位约1 cm×1 cm×1 cm大小的绒毛组织10份,经生理盐水清洗干净后,存入液氮罐中,用于蛋白质提取。将C57小鼠安乐死后,无菌解剖取出子宫,于冰上剥离胎盘,去除非胎盘组织。
1.3 HTR8/SVneo细胞培养、缺氧处理和转染
HTR8/SVneo人早孕期胎盘滋养层细胞系获自中国科学院上海细胞生物学研究所。在37 ℃、5% CO2、20% O2湿润环境中,用含有10%胎牛血清(Corning,美国)和1%青霉素-链霉素溶液(碧云天,中国)的RPMI1640培养基(Thermo Fisher,美国)培养HTR8/SVneo。
在缺氧条件(37 ℃、5% CO2、3% O2)培养48 h,之后复氧,在常规条件(37 ℃、5% CO2、20% O2)下培养24 h。
将HTR8/SVneo细胞以1×105个/孔的密度接种于24孔板,培养24 h。分为Scramble sh组与MTA1 sh组,将稀释好的siRNA和Lipofectamine 3000(Invitrogen,美国)轻轻混合均匀,室温孵育20 min以配制转染复合物。待细胞汇合度达到70%~90%后,弃掉旧培养基,磷酸盐缓冲液(PBS)漂洗后,加入新培养基,滴加转染试剂混和液至孔板内。“十”字法摇晃培养板数次,放入恒温培养箱继续培养6~8 h,更换为完全培养基;继续培养48 h,收取细胞,用于后续试验。
1.4 蛋白质印迹法检测MTA1的表达
对临床获取的人胎盘组织、绒毛外植体、小鼠胎盘组织分别进行蛋白提取,样品经SDS-PAGE凝胶电泳后转移至PVDF膜,封闭后添加一抗MTA1(Abcam,英国),4 ℃孵育过夜。复温1 h,PBS洗涤5 min×3次,经二抗孵育和洗膜后使用ECL化学发光显色液显影,凝胶成像系统(Bio-Rad,美国)拍照。以GAPDH作为内参蛋白。
1.5 免疫荧光双重染色检测胎盘组织MTA1的表达
对照组和PE组胎盘组织常规石蜡包埋切片、脱蜡、水合,用PBS洗涤,牛血清蛋白于37 ℃封闭1 h,滴加混合后的MTA1与CK-14(ab7800,Abcam,英国)一抗(1∶400稀释),用非免疫血清代替一抗作为阴性对照,4 ℃孵育过夜。第2日,PBS洗涤5 min×3次后,荧光山羊抗兔、山羊抗鼠二抗混合(1∶400稀释),37 ℃孵育1 h,PBS清洗后,含抗荧光淬灭剂的DAPI封片,激光共聚焦显微镜下拍照并采集图像。
1.6 细胞伤口愈合实验检测细胞迁移情况
HTR8/SVneo细胞分为Scramble sh组与MTA1 sh组,处理同前。在24孔板中,每孔接种6×104个HTR8/SVneo细胞,待细胞汇合度达到70%~90%,进行转染操作。转染48 h后,用枪头在孔板底部垂直划线,并清洗1次,去除多余细胞。分别在正常培养前(0 h)、培养24 h后,使用倒置显微镜拍照,并通过ImageJ软件计算HTR8/SVneo细胞伤口愈合面积。
1.7 Transwell细胞侵袭实验检测细胞的侵袭
HTR8/SVneo细胞分为Scramble sh组与MTA1 sh组,处理同前。使用Transwell插入物(BD Biosciences,美国)进行体外细胞侵袭和迁移测定。Transwell插入物的底部由聚对苯二甲酸乙二醇酯(PET)膜制成,该膜具有直径8 μm的孔,允许细胞通过。用5 mg/mL基质胶(BD Biosciences,美国)涂覆用于细胞侵袭实验的Transwell插入物的PET膜。将Transwell插入物放入24孔细胞培养板中,将孔分离成上室和下腔。将细胞悬液接种入预处理的Transwell小室中。每组实验均在下室加入600 μL完全培养基,将Transwell小室在37 ℃、5% CO2湿润的细胞培养箱中培养24 h;随后用PBS洗涤Transwell 小室3次,棉签拭去小室内多余细胞,将细胞在预冷的95%乙醇中固定10 min。用2 μg/mL DAPI(KPL,美国)对留在膜上侧的细胞染色2 min;室温下,用1 μg/mL碘化丙啶(Sigma-Aldrich,德国)对到达膜下侧的侵袭性细胞染色1 min。在倒置荧光显微镜下对细胞进行计数。为了消除负载误差等非特异性因素对Transwell测定结果的影响,将细胞侵袭能力定义为侵袭细胞数与非侵袭细胞数的比值,而不是仅计算膜底面的侵袭细胞数。实验重复3次。将处理过的样本的侵入能力标准化为相应对照的侵入能力。
1.8 定量实时聚合酶链式反应检测蛋白酶 MMP-2、MMP-9 的mRNA表达情况
用TRIzol提取细胞总RNA。使用SuperScript RT(Invitrogen,美国)试剂盒将所提RNA反转录为cDNA。将cDNA与PowerUp™ SYBR® Green Master Mix(Thermo Fisher,美国)混合,进行定量实时聚合酶链式反应(qRT-PCR)。MMP2(NM_008610.3)引物为5′-TTGGCGGACAGTGACACCAC-3′和5′-GGGGCCTCATACACAGCGTC-3′,产物大小为102 bp;MMP9(NM_013599.5)引物为5′-CCTTCA CCTTCGAGGGACGC-3′和5′-GCCGTGCTCCGTGT AGAGTC-3′,产物大小为146 bp。
1.9 绒毛外植体培养、观察及检测
早孕绒毛组织来自中国人民解放军空军军医大学第一附属(西京)医院妇产科。运输中全程置于冰冷的DMEM/F-12培养基中,并保证在2 h内完成组织处理。用无菌PBS清洗组织,将母体子宫内膜与胎膜剥离去除。剪刀剪取2~4 mm绒毛片段,置于预先包被Matrigel胶(Matrigel∶DMEM=1∶19)的12孔板中,轻轻按压以固定绒毛,37 ℃恒温孵箱中静置聚合30 min,再将孔板转移至37 ℃培养箱。培养4 h后取出孔板,小心加入1 mL完全培养基(含有20% PBS和1%青霉素-链霉素),尽量避免冲起绒毛。培养24 h后,选取含贴壁绒毛的孔进行MTA1 shRNA绒毛外植体转染,转染过程同前。8 h后常规换液,更换为完全培养基,转染24 h。MTA1 shRNA转染96 h后观察绒毛外植体存活和外延情况,用蛋白质免疫印迹法检测绒毛外植体中MTA1蛋白的表达。
1.10 小鼠基因型鉴定
1.11 免疫组织化学方法检测小鼠胎盘内CD31表达
将小鼠胎盘组织用4%的多聚甲醛固定过夜,梯度乙醇脱水、二甲苯透明后石蜡包埋,切片。石蜡切片于二甲苯与梯度乙醇复水,柠檬酸钠缓冲液(10 mmol/L,pH值6.0)中微波修复15 min,冷却至室温。PBS清洗后,于0.03%甲醇-0.3%过氧化氢中室温孵育30 min;PBS洗涤,血清封闭30 min;CD31(ab28364,Abcam,美国)一抗4 ℃过夜孵育,对照玻片用非免疫血清代替一抗孵育。次日,切片复温1 h,PBS清洗;二抗室温孵育3 h,PBS清洗;ABC复合物孵育1 h,PBS清洗,DAB显色;自来水冲洗切片,苏木精复染1 min。切片脱水、透明、封片,扫描成像。
1.12 生育力测试
以Mta1-/-雌性小鼠为实验组,C57野生型雌性小鼠作为对照组(Mta1+/+),每组各15只,均为8周龄。2组小鼠分别与生育力正常的8周龄C57野生型雄性小鼠合笼2周,记录每只雌性小鼠的产仔数。
1.13 统计学分析
使用GraphPad Prism 10软件进行统计分析。组间比较采用两样本t检验。所有实验至少重复3次。P<0.05表示差异有统计学意义。
2 结果
2.1 人胎盘组织内MTA1的表达情况
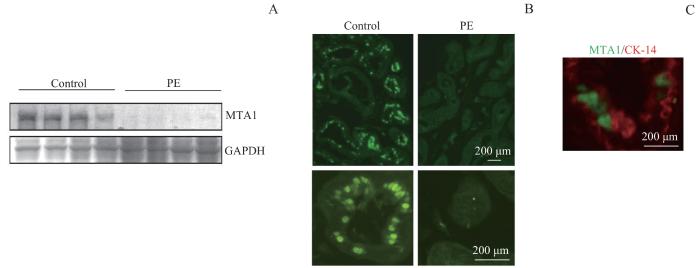
图1
图1
人胎盘组织MTA1蛋白的表达
Note: A. Western blotting. B. Immunofluorescence assay. C. Expression site of MTA1 protein located by immunofluorescence double staining.
Fig 1
Expression of MTA1 protein in human placental tissues
2.2 敲低 MTA1 对HTR8/SVneo细胞迁移、侵袭能力及蛋白酶表达的影响
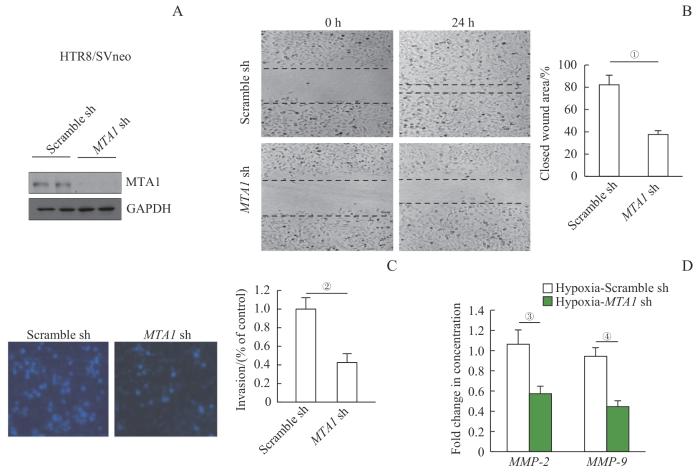
MTA1 shRNA转染后,蛋白质印迹法检测HTR8/SVneo滋养层细胞MTA1表达,结果显示,与 Scramble sh组相比,滋养层细胞MTA1的表达明显降低(图2A)。伤口愈合实验(图2B)显示,划伤后24 h,MTA1 sh组细胞迁移量明显低于Scramble sh组(P=0.002);Transwell细胞体外侵袭实验(图2C)显示,MTA1 sh组细胞侵袭能力与Scramble sh组相比显著下降(P=0.015);该结果提示MTA1能够促进滋养层细胞侵袭及迁移。将滋养层细胞在缺氧环境中培养后复氧,以模拟PE胎盘缺氧环境,进行qRT-PCR检测以明确MTA1对蛋白酶MMP-2、MMP-9表达的影响;结果(图2D)显示,低氧刺激下,与Scramble sh组相比,MTA1 sh组MMP-2和MMP-9的mRNA表达水平均降低(P=0.020,P=0.003);提示低氧刺激诱导下MTA1对于促进MMP-2和MMP-9的表达有重要作用。
图2
图2
敲低 MTA1 对HTR8/SVneo细胞功能的影响
Note: A. Expression of MTA1 protein in HTR8/SVneo cells with stable MTA1 knockdown by Western blotting. B. Wound healing assay. Representative images were taken at the beginning of wound healing (0 h) and 24 h later. The level of cell migration towards the wound scratches was quantified by measuring the distance of wound closure. C. Invasive capacity of the cells by Transwell in vitro invasion assay and statistical analysis. D. Expression levels of MMP-2 and MMP-9 by qRT-PCR. n=4. ①P=0.002, ②P=0.015, ③P=0.020, ④P=0.003.
Fig 2
Impact of MTA1 knockdown on the functional properties of HTR8/SVneo cells
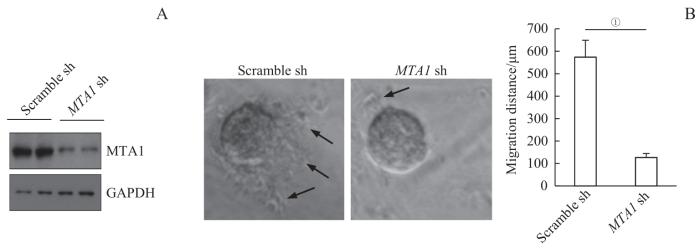
2.3 敲低 MTA1 对体外培养的绒毛外植体外延能力的影响
图3
图3
敲低 MTA1 对体外培养的绒毛外植体外延能力的影响
Note: A. Expression of MTA1 protein in villous explants by Western blotting. B. The growth state of villus explants (arrows) under the inverted microscope. C. The average migration distance of villous explants. n=4. ①P=0.003.
Fig 3
Effect of knocking down MTA1 on epitaxial ability of cultured villous explants in vitro
2.4 MTA1-/-雌鼠胎盘血管形成情况与产仔数目
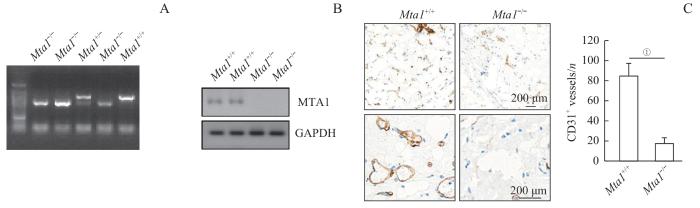
图4
图4
Mta1-/-小鼠的鉴定及其胎盘组织中CD31表达情况
Note: A. PCR identification results of mouse tail genomic DNA. B. Detection of MTA1 expression in placental tissues by Western blotting. C. Immunohistochemical staining and quantitative analysis of CD31 protein in placental tissues of mice. n=4. ①P=0.004.
Fig 4
Identification of Mta1-/- mice and expression of CD31 in the placental tissues
通过血管内皮标志物CD31的表达量分析胎盘血管生成过程。免疫组织化学结果表明(图4C),MTA1-/-组小鼠的CD31+微血管密度显著低于对照组(P=0.004),MTA1-/-组小鼠胎盘血管生成受到损害。
生育力测试结果显示,Mta1+/+组小鼠产仔数分别为7、8、8、8、8、9、9、9、9、10、10、10、10、12、12只;MTA1-/-组小鼠产仔数分别为0、0、2、2、3、3、4、4、5、5、6、6、7、7、8只。与对照组相比,Mta1-/-雌鼠产仔数显著降低(P=0.000)。
3 讨论
MTA1在人滋养层细胞中表达水平较高,揭示了MTA1在正常人滋养层细胞中具有潜在作用[10]。MTA1是一个与肿瘤发生和发展相关的转录调节因子[11-12],文献报道主要集中在其调控多种人类肿瘤细胞的侵袭和转移方面[13-14]。蛋白质印迹法结果显示,MTA1在PE患者胎盘中表达异常降低。免疫荧光双重染色结果显示MTA1主要定位于滋养层细胞胞核。考虑到胎盘滋养细胞作为胎盘侵袭、浸润和子宫血管重塑的执行细胞,其侵袭活性和功能的异常是导致胎盘发育障碍的根本原因,而与MTA1功能密切相关的因素(缺氧、MMP表达降低等)均与PE病理发生过程有关。我们推测,内源性MTA1表达可能对胎盘滋养细胞的功能非常重要。
EVT中MMP的异常表达与先兆子痫有关[15]。滋养层细胞侵袭过程涉及MMP介导细胞外基质(extracellular matrix,ECM)的降解[16-17]。MMP在生理和病理生理过程中对胎盘发育、炎症、血管生成、肿瘤侵袭和转移等均具有重要意义[18]。Akt/MMP-9信号通路是乳腺癌细胞侵袭和迁移的关键信号通路[19]。MTA1是第一个发现的转移相关基因(MTA)家族成员,在乳腺癌侵袭和转移过程中是癌症进展相关基因[20]。同样,MMP-2也与肿瘤细胞的增殖与侵袭转移作用机制关联密切[21]。滋养细胞分泌的MMP-2为酶解子宫内膜外基质与基底膜的重要调控因子,有利于滋养细胞侵入子宫内膜,是妊娠早期调控滋养细胞浸润的关键酶[22]。MMP-2低表达与子痫前期发生高度相关,使滋养细胞的浸润能力下调,子宫螺旋动脉重铸不足[23]。MMP-2是准确的PE预测生物标志物[24]。本研究将滋养层细胞在缺氧环境中培养后复氧,模拟胎盘的缺氧环境,结果显示稳定敲低MTA1的人绒毛膜滋养层细胞HTR8/SVneo在低氧刺激诱导下,MMP-2、MMP-9表达水平显著降低。该结果提示了MTA1在滋养细胞浸润子宫内膜方面具有重要作用。
早孕绒毛外植体培养最大程度上维持了组织结构的完整性,通常用来研究多种生物学功能,包括细胞增殖、凋亡、迁移以及侵袭等[25]。对绒毛外植体进行反义寡核苷酸或者人源重组活性因子的干预,可探究某个基因或外源性因子对外植体存活和功能的影响。为进一步证实MTA1对滋养细胞迁移能力的影响,本研究使用了早孕绒毛外植体培养模型,以便更好地模拟胎盘早期发育中滋养细胞的分化过程。MTA1 shRNA转染绒毛外植体,培养至96 h,采用蛋白质印迹法检测绒毛外植体中MTA1蛋白的表达;结果显示,与Scramble shRNA组相比,MTA1 shRNA可显著降低绒毛组织中MTA1蛋白的表达水平。MTA1 shRNA转染96 h后,对外植体进行整体绒毛外延检测;结果显示,与Scramble shRNA转染组相比,MTA1 shRNA显著降低了外植体中EVT迁移的距离。结合MTA1表达定位结果,我们推测MTA1可能参与了早孕期EVT的分化过程。
综上所述,MTA1在胎盘发育和先兆子痫发病机制中发挥重要作用,可通过调节滋养细胞迁移和血管重塑影响胎盘功能。MTA1作为PE潜在的治疗靶点,其具体作用机制需要进一步研究。
作者贡献声明
耿瑶负责文章撰写;李伟、张杨、赵洁、蔡国青参与了文章修改;耿瑶、张杨、赵洁参与实验操作与数据整理;李伟、蔡国青负责课题总体设计、技术及材料支持。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
GENG Yao was responsible for writing the article. LI Wei, ZHANG Yang, ZHAO Jie and CAI Guoqing participated in the revision of the article. GENG Yao, ZHANG Yang and ZHAO Jie participated in the experimental operation and data collation. LI Wei and CAI Guoqing were responsible for the overall design of the project, and the support of technology and material. All authors have read the final manuscript and agreed to the submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献