斑马鱼是一种常用的模式动物,具有产卵量高、体外受精、体外发育、早期胚胎透明等诸多优势,已被广泛应用于组织器官发育、药物高通量筛选、环境污染物的测试和毒理学试验等研究领域[1-4]。斑马鱼虽不具有哺乳动物般的易于从形态学上区分的性染色体以及可经PCR检测的Y染色体性别决定区(sex-determining region of Y chromosome,SRY),但其体内存在与性别分化相关基因,如SRY-盒转录因子9(SRY-box transcription factor 9,SOX9)、细胞色素 P450家族17亚家族A成员1(cytochrome P450 family 17 subfamily A member 1,CYP17A1)、CYP19A1、抗米勒管激素(anti-Müllerian hormone,AMH)、类固醇5α-还原酶2(steroid 5α-reductase 2,SRD5A2)等的同源基因[5-9],是较好的研究性腺发育的模式生物;且利用标记了各种细胞类型的转基因鱼品系使组织器官的发育变得可视化是该模式生物最大的优势之一。目前,与生殖系统相关的斑马鱼转基因品系如标记生殖细胞的Tg(vasa:EGFP)、标记颗粒细胞的Tg(cyp19a1:EGFP)已成功构建,但尚未有标记睾丸支持细胞的转基因鱼品系的报道[10]。
AMH是转化生长因子-β(transforming growth factor-β,TGF-β)家族的成员之一[11],可在胎儿和成人的睾丸支持细胞中表达。JOSSO等[12]对斑马鱼的研究显示,受精后17 d(17 days post fertilization,17dpf)的幼鱼性腺中已出现amh表达;在性腺已分化为睾丸或卵巢的幼鱼(38dpf)中,该基因主要表达于雄性性腺,在雌性性腺中不表达。在受精后6个月(6 months post fertilization,6mpf)的成年斑马鱼中,amh在雄性性腺支持细胞中高表达,在卵巢的颗粒细胞中低表达[13-14],提示amh或可作为雄性性腺发育的标记基因。
Tol2是一种天然存在且具有转座活性的脊椎动物转座子。KAWAKAMI等[15]通过DNA印迹法发现斑马鱼基因组中不包含任何与Tol2相关的序列,这为Tol2转座子系统在斑马鱼中的广泛应用提供了优良的基础条件。基于此,本研究使用amh基因编码区的上游启动子序列,构建带有红色荧光标签的pTol2-amh-mCherry重组转基因表达载体;而后,通过显微共注射该载体和Tol2转座酶的mRNA,建立能够稳定遗传的Tg(amh:mCherry)转基因斑马鱼品系;最终通过amh启动子驱动的红色荧光标记和示踪,探究斑马鱼性腺发育的过程。
1 对象与方法
1.1 实验动物
本实验所用的野生型斑马鱼为透明鱼Casper品系,由美国波士顿儿童医院周一教授馈赠。斑马鱼饲养于28.5 ℃的恒温循环水系统中,保持14 h光照/10 h黑暗的光控周期,每日喂食2次;其胚胎(<3dpf)培养于28.5 ℃的恒温培养箱中。
1.2 pTol2-amh-mCherry 重组转基因表达载体的构建及Tol2转座酶mRNA的体外合成
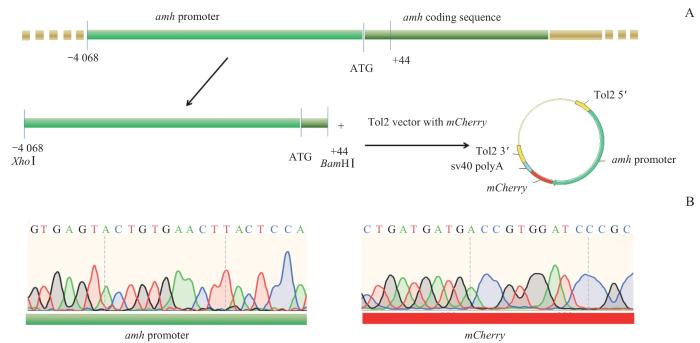
以成年斑马鱼基因组为模板,扩增出amh上游启动子序列(即包含amh ATG密码子上游4 068 bp和amh编码区前44 bp),经XhoⅠ和BamHⅠ消化后与pTol2-tg-mCherry载体(由比利时布鲁塞尔自由大学SABINE教授捐赠)连接,经转化、涂板、挑克隆后采用Sanger测序对构建的重组转基因表达载体进行鉴定。
以pCS-zT2TP质粒(由比利时布鲁塞尔自由大学OPITZ R教授捐赠)为模板,使用mMessage mMachine SP6转录试剂盒(Thermo Fisher,美国)对Tol2转座酶mRNA进行体外合成,具体步骤参见试剂盒说明书。
1.3 稳定遗传的转基因斑马鱼品系的筛选
将已构建的pTol2-amh-mCherry转基因载体与体外合成的Tol2转座酶mRNA显微共注射至1-细胞期的透明鱼Casper的胚胎中,经饲养后将成活的斑马鱼命名为F0代。将每条成年F0 代与野生型Casper成鱼(>3mpf)进行交配,并将其后代饲养至40dpf(即为F1代斑马鱼)。接着,采用荧光显微镜对F1代进行观察,如有部分幼鱼(3dpf~3mpf)的性腺位置出现红色荧光,则表明其F0代携带有重组转基因表达载体。而后,将这些带有红色荧光的幼鱼养大即为能够稳定遗传的F1代转基因斑马鱼。最终经过饲养,选择F3代转基因斑马鱼用于后续研究。
1.4 F3代转基因斑马鱼荧光信号与内源性 amh 表达的一致性检测
为检测已建立的F3代转基因斑马鱼品系的荧光信号是否能真实反映内源性amh的表达模式(位置是否一致),本研究依据THISSE等[16]报道的方法,采用原位杂交技术对该转基因斑马鱼品系的幼鱼、成鱼精巢中的amh和mCherry的表达进行检测,具体步骤如下:①以野生型斑马鱼胚胎cDNA为模板,制备用于原位杂交的amh探针质粒。该质粒的引物序列为5'-TCGCAGGTTTCTCATCTGGT-3'(amh-F)、5'- CAAATACAGTCGGCGTGGAG-3'(amh-R)。②分别以amh探针质粒、pCS2-mCherry质粒(由比利时布鲁塞尔自由大学OPITZ R教授捐赠)为模板,采用SP6 RNA聚合酶或T7 RNA聚合酶试剂盒(Thermo Fisher,美国)制备用于检测amh和mCherry表达的原位杂交探针。③以F3代转基因斑马鱼的幼鱼、成鱼精巢为对象,分别使用上述构建好的探针进行原位杂交,即对其内源性amh的表达、mCherry的表达(荧光信号)进行检测。
1.5 F3代转基因斑马鱼幼鱼的荧光观察及其性别分化的分析
使用荧光显微镜对“1.3”部分获得的F3代转基因斑马鱼幼鱼的红色荧光进行观察,即选择12dpf~45dpf的幼鱼,然后将该部分幼鱼培养至性成熟再行观察,最终将成鱼性别与其幼鱼期间是否出现红色荧光进行比较分析。按此方法重复3次,每次使用25条斑马鱼。
2 结果
2.1 pTol2-amh-mCherry 重组转基因表达载体的构建
图 1
图 1
pTol2-amh-mCherry 重组转基因表达载体的构建及其Sanger测序结果
Note: A. Construction of pTol2-amh-mCherry recombinant transgenic expression vector. B. Results of Sanger sequencing of amh promoter and mCherry in pTol2-amh-mCherry recombinant transgenic expression vector.
Fig 1
Construction of pTol2-amh-mCherry recombinant transgenic expression vector and its Sanger sequencing results
2.2 F3代转基因斑马鱼品系的建立及 mCherry 与内源性 amh 表达的一致性分析
采用荧光显微镜对F1代斑马鱼进行观察,结果发现部分幼鱼的性腺位置出现了红色荧光,而后对该幼鱼进行饲养、交配,获得可稳定遗传的F3代转基因斑马鱼Tg(amh:mCherry)。
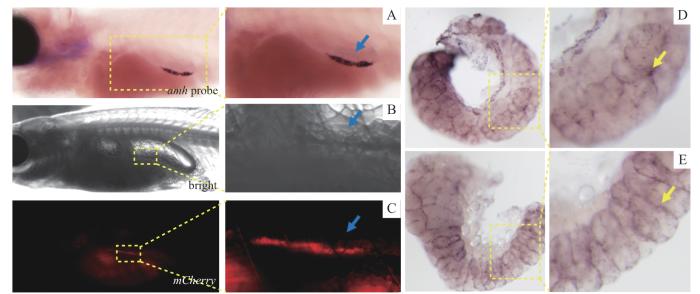
由于转基因序列为人为引入斑马鱼基因组中的外源性序列,其基因表达模式可能与内源性基因的表达模式不一致。为检测已建立的F3代转基因斑马鱼品系中红色荧光的表达位置与内源性amh基因表达位置是否一致,我们采用原位杂交技术分别对该转基因斑马鱼的幼鱼、成鱼精巢中的amh和mCherry 的表达进行检测并结合荧光观察结果进行分析。结果(图2)显示,在F3代转基因斑马鱼幼鱼(30dpf)中,amh探针显示的信号(图2A)位置与mCherry明场、荧光下显示的位置相一致(图2B为明场、图2C为红色荧光),均位于腹部与躯干交界的部位(蓝色箭头所示),且形态均为长条状;在F3代转基因斑马鱼的成鱼精巢中amh表达信号的分布形似圆形,与文献[17]报道的表达部位一致,即位于精巢的体细胞中(图2D黄色箭头所示),mCherry的表达位置与amh的表达位置一致(图2D、E)。上述结果均提示,我们成功建立了可反映内源性amh表达位置且能够通过红色荧光标记表达amh基因的性腺体细胞的F3代转基因斑马鱼品系。
图 2
图 2
F3代转基因斑马鱼的幼鱼、成鱼精巢中 mCherry 的表达位置和内源性 amh 表达位置的一致性分析
Note:A. In situ hybridization results of endogenous amh in 30dpf transgenic juvenile zebrafish. B/C. Bright-field observation (B) and mCherry fluorescence observation (C) of 30dpf transgenic juvenile zebrafish. D/E. In situ hybridization results of endogenous amh (D) and mCherry (E) in the spermatheca of adult transgenic zebrafish.
Fig 2
Consistency analysis of mCherry and endogenous amh expression sites in the F3 transgenic juvenile zebrafish and the spermatheca of adult transgenic zebrafish
2.3 F3代转基因斑马鱼性腺发育的荧光观察及分析
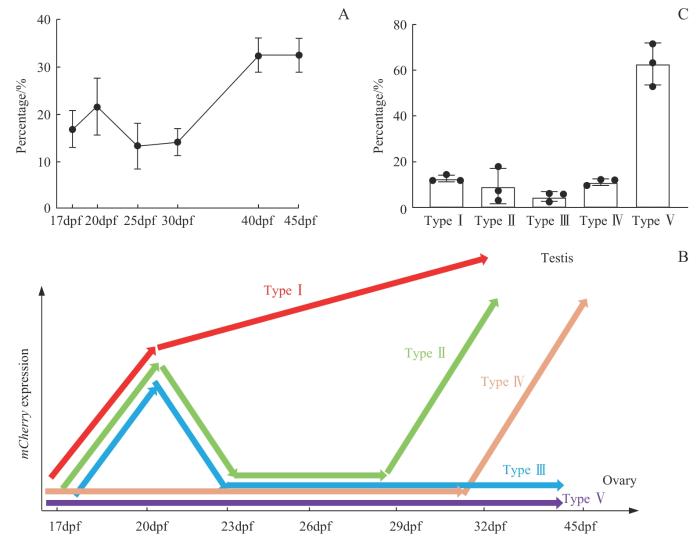
对F3代转基因斑马鱼的红色荧光进行观察后发现,该品系的幼鱼出现红色荧光信号的时间不尽相同,其中出现荧光信号最早的为17dpf,部分幼鱼出现信号相对晚一些,也有部分幼鱼一直未出现红色荧光,同时有的幼鱼早期出现过荧光信号但后期荧光信号又消失。随后,我们对不同时间点观察到的出现荧光信号的幼鱼占总幼鱼的比例进行统计,结果(图3A)显示,17dpf、20dpf、25dpf、30dpf、40dpf和45dpf时间点对应的占比分别为17%、21%、13%、14%、32%和32%。
图3
图3
F3代转基因斑马鱼幼鱼的荧光观察及其性腺发育分析
Note: A. Percentage of juvenile zebrafish with fluorescent signals in the total juvenile zebrafish at different time points. B. Five types of gonadal development in the juvenile zebrafish. C. Proportion of juvenile zebrafish with 5 types of gonadal development.
Fig 3
Fluorescence observation and gonadal development analysis of juvenile F3 transgenic zebrafish
根据红色荧光信号出现的时间不同,我们将12dpf~45dpf期间的幼鱼性腺发育过程分为5种类型(图3B):①Type Ⅰ,从17dpf左右开始至45dpf一直保持有红色荧光信号,最终发育成雄性斑马鱼。②Type Ⅱ,在17dpf左右开始出现红色荧光信号,23dpf~26dpf信号消失,而在29dpf左右又重新出现红色荧光信号直到45dpf,最终发育为雄性斑马鱼。③Type Ⅲ,在17dpf左右开始出现红色荧光信号,23dpf~26dpf信号消失且一直未再出现,最终发育为雌性斑马鱼。④Type Ⅳ,17dpf~30dpf未出现红色荧光信号,但从30dpf左右开始出现荧光信号直至45dpf,最终发育为雄性斑马鱼。⑤Type Ⅴ,从始至终均未出现红色荧光信号,最终发育成雌性斑马鱼。同时,我们对每种发育类型的斑马鱼比例进行统计,结果(图3C)显示Type Ⅰ~Ⅴ类斑马鱼的占比依次为13%、9%、5%、11%及62%。
3 讨论
斑马鱼具有可以体外受精、发育快、胚胎透明等优势;借助转基因技术,可以实现对其不同类型细胞的荧光标记及可视化示踪分析,使斑马鱼成为研究器官发育的重要模式生物。为研究斑马鱼的性腺发育过程,研究人员成功构建了可标记不同性腺细胞类型的转基因斑马鱼品系。如研究人员利用Tg(vasa:EGFP)转基因斑马鱼品系来示踪斑马鱼性腺的发育过程,结果发现10dpf左右的斑马鱼幼鱼会首先发育出含有未成熟卵母细胞的未分化卵巢样性腺;在17dpf~35dpf期间,如受到某些外在或内在因素的影响,幼鱼的生殖细胞数量会减少并导致其向雄性发育,反之则向雌性发育,这一过程的分子机制目前尚不清楚[18-19]。在本研究中,我们成功建立了由amh基因启动子驱动表达红色荧光且能够稳定遗传的F3代转基因斑马鱼品系Tg(amh:mCherry);在该斑马鱼品系中,通过针对内源性amh以及mCherry的探针进行原位杂交后发现,mCherry的表达位置与内源性amh表达的位置相一致,提示红色荧光可被用来监测amh的表达并可以标记表达amh基因的性腺体细胞。
本研究通过对F3代转基因斑马鱼幼鱼的红色荧光信号进行观察后发现,斑马鱼性腺在双向分化时期(17dpf~35dpf)的红色荧光信号并非一成不变,即信号最早出现在17dpf,随着幼鱼的发育部分斑马鱼的红色荧光会消失直至性成熟,而部分斑马鱼的荧光在消失后会重现直至性成熟;因此,我们把斑马鱼在12dpf~45dpf期间的性腺发育的过程分为Type Ⅰ~ Type Ⅴ共5类。这一结果提示斑马鱼的性别分化过程是动态且复杂的,其中Type Ⅱ、Type Ⅲ、Type Ⅳ为性腺发育动态变化的主要路径,25dpf~35dpf是斑马鱼性别分化的关键时期,即在遗传因素和环境因素的共同影响下会有一些雌性向雄性或者雄性向雌性发育方向的变动。由于处于动态变化阶段的性腺体积非常小,使得对其解剖的难度较大,而本研究构建的转基因斑马鱼品系可用于示踪这一过程,因此该构建的品系或可为斑马鱼发育过程的研究提供一个较好的动物模型。
作者贡献声明
董梅、吴婧负责实验设计、论文的写作和修改,吴婧、徐悦和凌诗颖负责实验操作与数据分析,宋怀东、乔洁和董梅负责课题指导。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by DONG Mei and WU Jing. The manuscript was drafted and revised by WU Jing and DONG Mei. The experiments and data analysis were performed by WU Jing, XU Yue and LING Shiying. SONG Huaidong, QIAO Jie and DONG Mei were responsible for subject guidance. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献