作为MiTF/TFE(microphthalmia family of transcription factors )家族成员的转录因子,转录因子EB(transcription factor EB,TFEB)是激活细胞自噬的关键因子。它与溶酶体蛋白表达相关,能与溶酶体调控元件结合,调控溶酶体相关生物学过程以及自噬作用[7]。在大多数情况下,TFEB以磷酸化(p-TFEB)的失活状态存在于细胞质中;脱磷酸化后的TFEB能进入细胞核中发挥活性作用[8]。有研究[9]表明,糖尿病状态下血管内皮细胞中的TFEB磷酸化水平升高,导致其活性下降。而另一项研究[10]表明,高糖环境下可以通过减少肾小管上皮细胞上游细胞因子对TFEB的抑制作用来恢复溶酶体的生物活性,从而保护细胞的自噬功能。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是重要的TFEB负性调节因子。研究表明:在细胞营养丰富的条件下,具有激酶活性的p-mTOR可以在溶酶体膜上介导TFEB的磷酸化,抑制它的活性[8-11];而在细胞饥饿状态下,mTOR会进入抑制状态,导致TFEB的磷酸化水平降低,自噬被激活[12]。溶酶体Ca2+的释放和钙调神经磷酸酶的激活也可刺激TFEB发生核易位。溶酶体膜上的钙调通道蛋白MCOLN1(mucolipin TRP cation channel 1)能释放溶酶体中的Ca2+并激活钙调神经磷酸酶,使TFEB去磷酸化,从而促进其核易位[13]。有研究[14-15]证实,在心肌细胞中,上调MCOLN1的活性可促进TFEB脱磷酸化,增强TFEB的活性,介导自噬的激活。然而目前,糖尿病脑病中MCOLN1、mTOR及TFEB与自噬的关系尚不明确,有待进一步研究。
本研究将通过高脂饲养和链脲佐菌素(streptozotocin,STZ)建立T2DM小鼠模型[16],对各组小鼠的体质量、随机血糖(random blood glucose,RBG)、葡萄糖耐量、空腹胰岛素水平,以及小鼠海马组织中Aβ、tau、MCOLN1、mTOR、TFEB、自噬相关蛋白的表达水平进行检测,从而探讨糖尿病脑病中MCOLN1、mTOR、TFEB及自噬相关蛋白表达的变化及关系,为糖尿病脑病的干预提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
8周龄健康SPF级雄性C57BL/6J小鼠,购自上海市计划生育科学研究所实验动物经营部,实验动物生产许可证号为SCXK(沪)2018-0006。小鼠饲养于上海交通大学医学院附属第六人民医院动物实验室,室温20~22 ℃,湿度50%~60%,12 h昼夜循环;实验动物使用许可证号为SYXK(沪)2021-0028。
1.1.2 主要试剂及仪器
高脂饲料(high-fat diet,HFD,#D12492,美国Research Diet),热量为20 kJ/g,总热量的40%来自脂肪;普通饲料热量为14 kJ/g。STZ(#S0130,美国Sigma‑Aldrich),胰岛素ELISA试剂盒(#32100,中国香港AIS),APP抗体(#ab32136,美国Abcam),Aβ抗体(#ab201061,美国Abcam),tau蛋白抗体(#SAB4501830,美国Sigma-Aldrich),p-tau蛋白抗体(#SAB4504557,美国Sigma-Aldrich),微管相关蛋白1A/1B-轻链3(microtubule-related protein 1A/1B-light chain 3,LC3)抗体(#ab192890,美国Abcam),P62抗体(#ab56416,美国Abcam),溶酶体相关膜糖蛋白1(lysosomal-associated membrane protein 1,LAMP1)抗体(#ab25630,美国Abcam),TFEB抗体(#MBS2538354,美国My-BioSource),p-TFEB抗体(#ABE1971-I,美国Millipore),mTOR抗体(#CST-2983,美国Cell Signaling Technology),p-mTOR抗体(#CST-5536,美国Cell Signaling Technology),MCOLN1抗体(#PA1-46474,美国Thermo-Fisher),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(#CST-5174S,美国Cell Signaling Technology),辣根过氧化物酶(HRP)标记的兔二抗(#1706528,美国Bio-Rad),Alexa Fluor 647标记的山羊抗兔二抗(#ab150079,美国Abcam),FITC标记的山羊抗兔二抗(#ab6717,美国Abcam),Western blotting转膜液、BCA蛋白定量试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒、电泳液(中国Beyotime),4',6-二脒基-2-苯基吲哚(DAPI)染色液(#D8417,美国Sigma-Aldrich)。
ACCU‑CHEK® Performa血糖仪(美国Roche Diagnostics),水迷宫实验仪器(#XR-XM101,中国欣软)。
1.2 小鼠T2DM模型建立及分组
随机将20只健康8周龄雄性小鼠(体质量18~22 g)分为2组,分别为T2DM组和对照(CON)组,每组10只。T2DM组采用高脂饲料喂养12周后,连续5 d腹腔注射STZ溶液,剂量为40 mg/kg,将注射完成STZ前记为第0周。注射完成1周后,连续2 d检测尾静脉RBG均大于或等于11.1 mmol/L者视为建模成功,继续喂养高脂饲料直至实验结束。CON组采用普通饲料喂养,12周后连续5 d注射与STZ溶液同等体积的柠檬酸钠缓冲液。从第0~10周,每周于同一时间段检测1次小鼠的体质量以及RBG。行为学实验结束后,行经腹腔注射葡萄糖耐量检测(intraperitoneal glucose tolerance test,IPGTT)实验,按照小鼠体质量2 g/kg的剂量注射葡萄糖溶液(质量浓度10%),之后分别于注射后15、30、45、60、75、90、105和120 min检测小鼠尾静脉血液的葡萄糖浓度。用过量戊巴比妥钠麻醉处死小鼠,收集2组小鼠尾静脉血浆,使用小鼠胰岛素ELISA试剂盒检测血浆胰岛素含量。
1.3 Morris水迷宫实验
第10周开始Morris水迷宫实验,对小鼠进行行为学测试。在行为学测试期间,各组仍按原干预措施执行。水迷宫装置中包括一个圆形水池(直径120 cm,高40 cm),分为4个象限,每个象限设置不同图案,以帮助小鼠寻找方位。水温保持在(23±1)℃。实验分为3个部分:可见平台实验、隐形平台实验以及空间探索实验。所有数据用SMART V3.0跟踪系统进行分析。
1.3.1 可见平台实验
第1日,平台被放置于一个象限的随意位置上,高于水面1.0 cm。如果小鼠能够看见平台且直接游向并爬上平台,说明动物的运动能力和视力均正常,则可以开展后续实验。
1.3.2 隐形平台实验
可见平台实验结束24 h后,在水中加入无毒颜料使水不透明,放置平台于固定象限,平台低于水面1.0 cm。对小鼠进行为期4 d的训练(第2~5日),将小鼠每日分别从4个象限的固定点放入水中,观察并记录其从入水到爬上平台的时间(逃避潜伏期)。如果小鼠超过60 s找不到平台,研究人员引导其到平台上,并在平台上停留15 s。
1.3.3 空间探索实验
第6日进行空间探索实验。移除平台,每只小鼠从距离平台最远的点入水后,在水中探索60 s,观察并记录小鼠在原平台所在象限花费的时间,以及穿越原平台位置的次数。
1.4 小鼠海马组织标本收集
小鼠处死后,获取海马组织,一部分迅速液氮冷冻并置于-80 ℃冰箱中保存,另一部分在4%多聚甲醛中固定48 h,石蜡包埋以备后续实验。
1.5 Western blotting
将小鼠海马组织放于冰水浴中进行充分匀浆,采用RIPA裂解缓冲液分离总蛋白,BCA法测定总蛋白浓度,用SDS-PAGE分离,并转移到聚偏氟乙烯(PDVF)膜上。用5%脱脂牛奶室温封闭1 h,加入一抗TFEB抗体(1∶50)、LC3抗体(1∶100)、MCOLN1抗体(1∶200)、tau抗体(1∶1 000)、p-tau抗体(1∶1 000)、P62抗体(1∶1 000)、mTOR抗体(1∶1 000)、p-mTOR抗体(1∶1 000)、p-TFEB抗体(1∶1 000)、APP抗体(1∶10 000)或LAMP1抗体(1∶10 000),4 ℃孵育过夜,洗膜,加入HRP标记的二抗(1∶5 000),室温下孵育1 h,以GAPDH作为内参。用化学发光(enhanced chemiluminescence,ECL)法显示蛋白条带,扫描并记录实验结果,ImageJ软件分析实验结果。
1.6 免疫荧光染色
石蜡包埋组织切片,PBS洗涤,用0.3% Triton X-100渗透稳定20 min进行阻断,将一抗稀释到适宜浓度(Aβ抗体1∶1 000,p-tau抗体1∶1 000),滴加抗体50 µL/片,4 ℃过夜孵育。PBS洗涤3次,每次10 min,在室温下用荧光染料偶联的二抗孵育1 h。PBS再次洗涤3次,并在室温下与DAPI一起孵育30 min,荧光显微镜下观察并采集图片,使用ImageJ软件进行分析。
1.7 统计学分析
采用SPSS 27.0与GraphPad prism 8.0.1软件进行统计分析。定量资料用x±sx 表示;隐形平台实验数据采用重复测量方差分析,其余实验数据采用独立样本t检验进行分析。P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠代谢水平变化
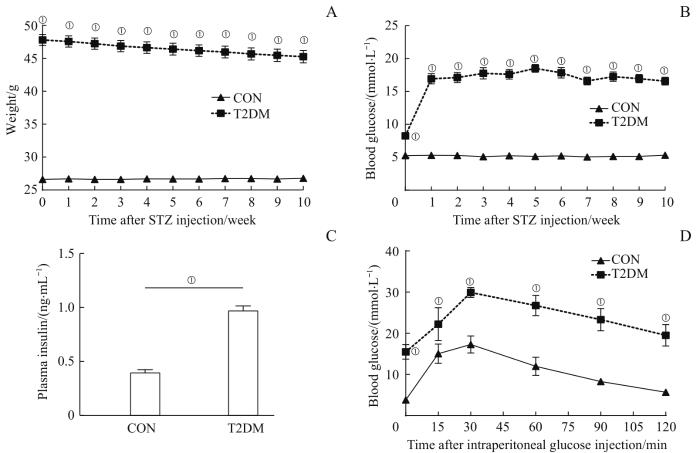
如图1所示:与CON组相比,T2DM组的小鼠体质量、RBG以及血浆胰岛素水平显著升高(均P<0.05),且连续2 d检测尾静脉RBG均≥11.1 mmol/L;IPGTT结果显示,T2DM组小鼠血糖水平均显著高于CON组(均P<0.05),存在葡萄糖耐量下降。此外,T2DM组小鼠还出现多饮、多尿症状,符合T2DM表现,提示T2DM模型已成功建立。
图1
图1
2组小鼠糖代谢水平的比较 (n=10)
Note: A. Weight. B. RBG. C. Plasma insulin. D. Results of IPGTT. ①P=0.000, compared with the CON group.
Fig 1
Comparison of glucose metabolic levels between the two groups of mice (n=10)
2.2 小鼠学习记忆功能变化
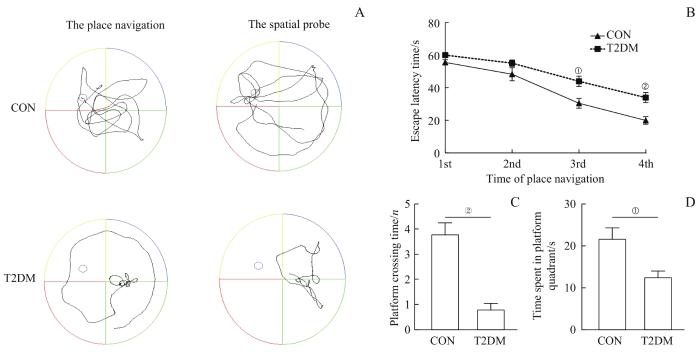
在隐形平台实验中,对结果进行主体内效应检验显示:小鼠的逃避潜伏期在不同定位航行次数间差异有统计学意义(F=81.749,P=0.000),逃避潜伏期随着训练次数的增加逐渐缩短。主体间效应检验显示:2组小鼠间差异有统计学意义(F=13.446,P=0.002),可以认为2组的逃避潜伏期不完全相同。进一步对每次试验2组的逃避潜伏期进行比较,结果显示,在第3次与第4次试验时,T2DM组小鼠的逃避潜伏期较CON组显著延长(均P<0.05)。详见图2A、B。
图2
图2
2组小鼠学习记忆功能的比较 (n=10)
Note: A. Typical swimming traces of the two groups of mice in the place navigation and the spatial probe. B. Comparison of the escape latency between the two groups in the place navigation. C. Comparison of the number of times crossing the platform between the two groups in the spatial probe. D. Comparison of the time spent in the target quadrant between the two groups in the spatial probe. ①P=0.006, ②P=0.002, compared with the CON group.
Fig 2
Comparison of learning and memory function between the two groups of mice (n=10)
在空间探索实验中,与CON组相比,T2DM组的小鼠穿越平台的次数显著减少,在目标象限的停留时间也显著缩短(均P<0.05,图2A、C、D)。据此推测T2DM组小鼠的学习记忆能力下降。
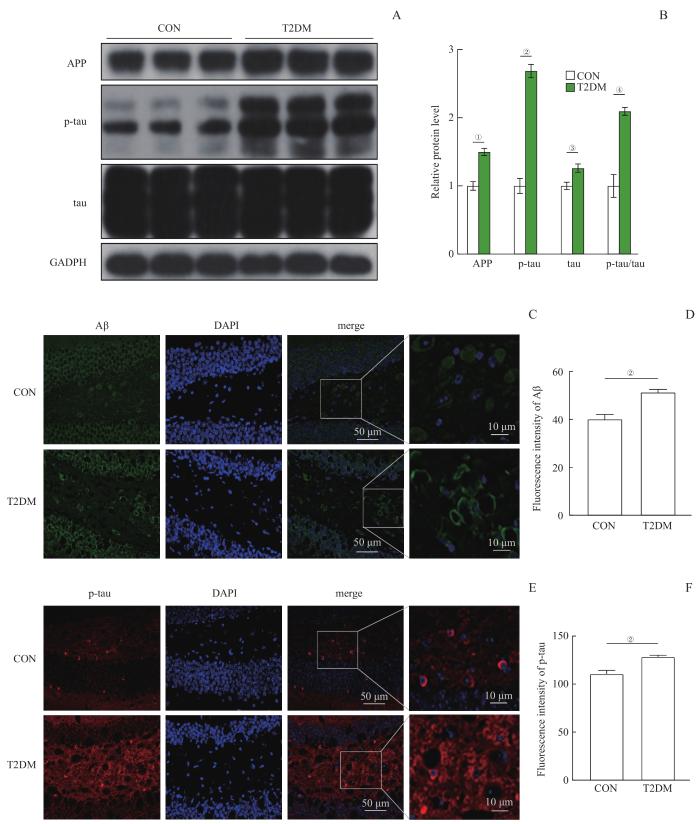
2.3 小鼠海马组织中Aβ、APP和tau蛋白表达水平的变化
图3
图3
2组小鼠海马APP、p-tau、tau和Aβ蛋白水平的比较 (n=10)
Note: A. The Western blotting images of APP, p-tau and tau proteins in the hippocampi of mice in the two groups. B. Statistical histogram of the protein bands in the Western blotting analysis. C. The immunofluorescence images of Aβ protein in the hippocampi of mice in the two groups. D. Statistical histogram of the fluorescence intensity of Aβ. E. The immunofluorescence images of p-tau protein in the hippocampi of mice in the two groups. F. Statistical histogram of the fluorescence intensity of p-tau. ①P=0.004, ②P=0.000, ③P=0.032, ④P=0.003, compared with the CON group.
Fig 3
Comparison of APP, p-tau, tau and Aβ proteins in the hippocampi of mice between the two groups (n=10)
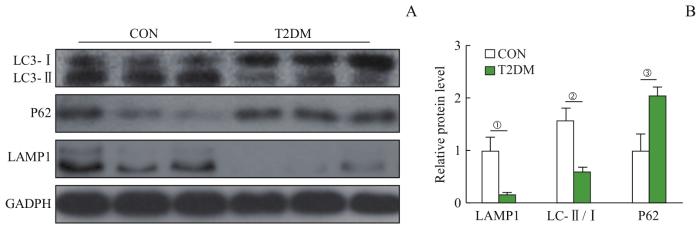
2.4 小鼠海马组织中自噬相关蛋白表达水平的变化
Western blotting结果显示,与CON组相比,T2DM组小鼠海马组织中P62蛋白表达水平显著升高而LC3-Ⅱ/LC3-Ⅰ比值显著下降(均P<0.05),自噬溶酶体相关蛋白LAMP1水平显著下降(P<0.05)。详见图4。结果提示,T2DM组小鼠海马中自噬功能下降。
图4
图4
2组小鼠海马中LC3-Ⅰ/Ⅱ、P62和LAMP1蛋白水平的比较 (n=10)
Note: A. The Western blot images of LC3-Ⅰ/Ⅱ, P62 and LAMP1 proteins in the hippocampi of mice in the two groups. B. Statistical histogram of the protein bands in the Western blotting analysis. ①P=0.032, ②P=0.016, ③P=0.040, compared with the CON group.
Fig 4
Comparison of LC3-Ⅰ/Ⅱ, P62 and LAMP1 proteins in the hippocampi of mice between the two groups (n=10)
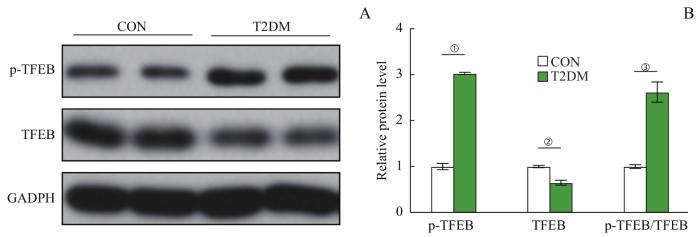
2.5 小鼠海马组织中TFEB蛋白表达水平变化
Western blotting检测结果显示,T2DM组小鼠海马中p-TFEB蛋白表达水平和p-TFEB/TFEB比值与CON组相比均显著升高,而TFEB水平显著下降(均P<0.05)。详见图5。结果提示,T2DM组小鼠海马TFEB的活性下降。
图5
图5
2组小鼠海马中p-TFEB和TFEB蛋白水平的比较 (n=10)
Note: A. The Western blotting images of p-TFEB and TFEB proteins in the hippocampi of mice in the two groups. B. Statistical histogram of the protein bands in the Western blotting analysis. ①P=0.001, ②P=0.028, ③P=0.018, compared with the CON group.
Fig 5
Comparison of p-TFEB and TFEB proteins in the hippocampi of mice between the two groups (n=10)
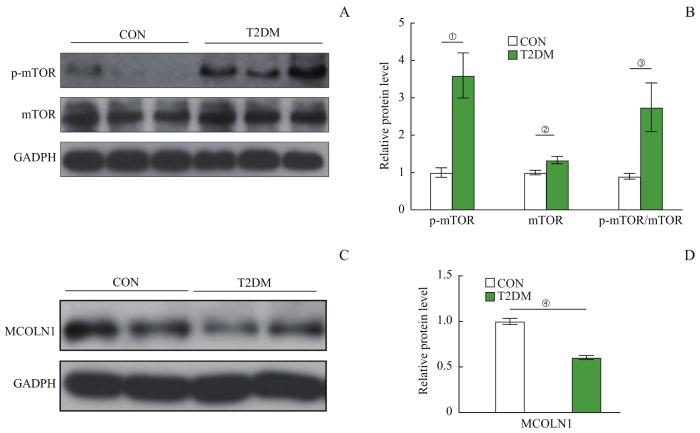
2.6 小鼠海马组织中mTOR和MCOLN1蛋白表达水平的变化
Western blotting结果显示,与CON组相比,T2DM组小鼠海马组织中p-mTOR和mTOR蛋白表达水平、p-mTOR/mTOR比值均显著升高(均P<0.05),而MCOLN1蛋白表达水平显著下降(P<0.05)。详见图6。结果提示,T2DM组小鼠海马中mTOR活性升高,MCOLN1活性下降。
图6
图6
2组小鼠海马中p-mTOR、mTOR和MCOLN1蛋白水平的比较 (n=10)
Note: A. The Western blotting images of p-mTOR and mTOR proteins in the hippocampi of mice in the two groups. B. Statistical histogram of the p-mTOR and mTOR protein bands in the Western blotting analysis. C. The Western blotting images of MCOLN1 protein in the hippocampi of mice in the two groups. D. Statistical histogram of the MCOLN1 protein bands in the Western blotting analysis. ①P=0.014, ②P=0.044, ③P=0.048, ④P=0.005, compared with the CON group.
Fig 6
Comparison of p-mTOR, mTOR, and MCOLN1 proteins in the hippocampi of mice between the two groups (n=10)
3 讨论
流行病学研究表明,糖尿病脑病是T2DM的重要并发症,是指由于糖脂代谢异常导致大脑结构、生理等方面出现的一系列病理性改变,包括AD样神经病变以及认知功能的损伤。本研究所构建的T2DM模型小鼠表现出肥胖、血糖升高、胰岛素抵抗等特征性代谢异常,证明建模成功。同时水迷宫认知行为学实验结果说明,我们所建立的T2DM模型小鼠的学习记忆能力下降,提示模型构建成功后9周时T2DM小鼠已有糖尿病脑病。
糖尿病脑病的脑损伤发病机制目前还不完全明确。LUO等[17]研究发现,该病与脑内Aβ沉积、tau蛋白的磷酸化增多有着密切的关联。尸检报告显示超过40%的T2DM患者脑内有中度至重度的Aβ沉积斑块和神经原纤维缠结[1]。DENVER等[18]在App/早老素1(App/presenilin 1,App/Ps1)双转基因AD模型小鼠脑中发现普遍存在Aβ沉积现象;SUN等[19]研究发现,该转基因AD模型小鼠脑中p-tau蛋白增多。在本研究中,与CON组相比,T2DM组小鼠海马组织Aβ沉积明显,APP和p-tau蛋白表达水平升高,与AD模型小鼠脑部的研究结果相似。因此,我们认为T2DM代谢紊乱状态下脑内出现的AD样神经病变是糖尿病脑病脑损伤的重要病理机制之一。
自噬溶酶体途径是细胞内清除异常蛋白和功能障碍细胞器的重要途径。LI等[4]研究发现,在糖尿病状态下,大脑的自噬溶酶体途径受到抑制。本研究也证实了这一点。T2DM组小鼠海马组织中P62蛋白表达水平升高,溶酶体相关蛋白LAMP1表达和LC3-Ⅱ/LC3-Ⅰ比值水平显著下降。自噬溶酶体途径的功能障碍可能导致大脑自身对于异常蛋白APP、Aβ和p-tau的清除能力下降,造成异常蛋白的积累和沉积,进一步激发脑内炎症等病理级联反应,从而产生脑损伤。本研究结果证实了T2DM组小鼠海马组织中存在AD样神经病变以及自噬溶酶体途径功能的损伤,因此,我们推测T2DM状态下自噬溶酶体途径功能的障碍与AD样神经病变有密切的联系。
TFEB是细胞自噬的关键调节因子,TFEB表达的激活能够增强细胞溶酶体功能。大多数情况下,失活的p-TFEB被保留在细胞质中,而当细胞处于应激状态时, TFEB脱磷酸化进入活化状态,转入细胞核,调节下游自噬相关蛋白,如LC3、P62的表达,自噬功能被激活[20]。本研究发现,与CON组相比,T2DM组小鼠海马组织中p-TFEB表达水平升高,TFEB的表达水平下降;表明在T2DM状态下,TFEB的核转位减少,细胞溶酶体的功能下降,自噬功能受损。
MCOLN1能诱导溶酶体Ca2+释放,使TFEB脱磷酸化,激活钙调神经磷酸酶,触发TFEB核易位,自噬增强。相关研究[21-22]表明,MCOLN1介导的TFEB脱磷酸化和核转位在多种疾病中发挥重要作用。与之相反,mTOR是一种TFEB负性调节因子,能使TFEB的磷酸化增加,抑制TFEB的活性。在细胞受到刺激时,作为自噬负性调控分子的mTOR被激活,p-mTOR升高,抑制自噬的激活[23]。CHEN等[24]用雷帕霉素抑制mTOR在糖尿病脑病大鼠海马中的过度激活,增强了自噬功能,有效降低了tau的过度磷酸化和Aβ的沉积,揭示mTOR信号转导的自噬调节在糖尿病大鼠认知障碍上发挥了重要作用。本研究对mTOR和MCOLN1这2种蛋白表达水平的检测发现,与CON组相比,T2DM组小鼠海马组织中p-mTOR蛋白表达水平与p-mTOR/mTOR比值都显著升高,而MCOLN1的表达水平降低。
本研究存在一定局限性:研究表明T2DM状态下小鼠脑部自噬功能受损,推测其与AD样神经病变有密切的联系,但本研究未对两者之间的关系加以验证。
综上所述,在T2DM状态下,小鼠的认知功能下降,同时小鼠海马组织中MCOLN1表达量降低,mTOR活性增强,TFEB的活性降低,自噬功能下降,以及Aβ和p-tau蛋白水平升高;由此推测糖尿病脑病的认知功能降低可能与自噬功能的降低有关。在今后的研究中,需要对MCOLN1、mTOR和TFEB进行靶向调节并观察它们发挥的作用,包括在结构和认知功能等方面对糖尿病脑病的改善作用,为该病的治疗提供实验依据及理论基础。
作者贡献声明
陈奕馨、程丽珍参与了实验设计、实验操作与数据统计;陈奕馨、林祎嘉和苗雅参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by CHEN Yixin and CHENG Lizhen. The manuscript was drafted and revised by CHEN Yixin, LIN Yijia, and MIAO Ya. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献