在先天免疫细胞中,小胶质细胞是神经炎症的主要参与者[1]。小胶质细胞是中枢神经系统中的巨噬细胞,占中枢神经系统细胞总数的10%,参与神经元的发生及可塑性过程,并在脑组织受到损害时充当第一道防线[2]。小胶质细胞可以感知炎症、细菌病毒、毒素或受损细胞的存在,能够产生抗炎因子,清除细菌、病毒和受损细胞,维持神经中枢系统的正常运作,确保神经元行使正常功能[3]。虽然轻度激活的小胶质细胞可以清除细胞碎片和受损的神经元,启动细胞的免疫功能,对大脑有保护作用,但当小胶质细胞在过度激活状态时,也会大量释放促炎和细胞毒性因子加剧脑内炎症的发生发展;同时伴随吞噬能力的下降,使整个大脑处于过度炎症状态,进一步加剧神经元的凋亡[4-5]。因此维持小胶质细胞的正常生理功能以及进一步了解其作用原理是非常重要的。由于小鼠和人类之间遗传和病理生理学的相似性,可利用基因工程小鼠模型深入了解小胶质细胞在与神经炎症相关的疾病发展过程中作用的分子和细胞机制[6]。
目前在炎症中关于STAT3机制的研究大多采用体内抑制剂药物注射等方法,无法排除全身细胞的相互影响;而基因条件性敲除小鼠在理想情况下可在特定类型细胞中实现基因敲除,为生物学机制的深入研究提供更为准确可靠的证据。由于目前尚无相关小鼠模型,故为探究STAT3信号与小胶质细胞的作用,本研究拟构建小胶质细胞Stat3基因条件性敲除小鼠,为进一步深入研究提供动物模型。
1 材料与方法
1.1 实验动物
Stat3fl/fl雄性小鼠购于美国杰克逊实验室,Cx3cr1 creERT2雌性小鼠由上海交通大学基础医学院虞志华教授惠赠,基因小鼠背景均为C57BL/6。所有实验用小鼠均饲养在上海交通大学医学院附属第九人民医院SPF级动物房中,12 h光暗交替,温度25 ℃± 2 ℃,允许其自由进食和饮水。
1.2 主要实验试剂
DEPC处理水[B501005-0100,生工生物工程(上海)股份有限公司;中国];MicroElute Total RNA kit(R6831-01,Omega Bio-Tek公司;美国);PerCP -Cy5.5 Anti CD11b抗体(550993,BD公司;美国);APC -Cy7 Anti CD45抗体(557659,BD公司;美国);APC Anti F4/80抗体(566787,BD公司;美国);APC Anti-CD86抗体(558703,BD公司;美国);PE-Cy7 Anti-CD206抗体(25-2061-82,BD公司;美国)。
1.3 小鼠的繁育
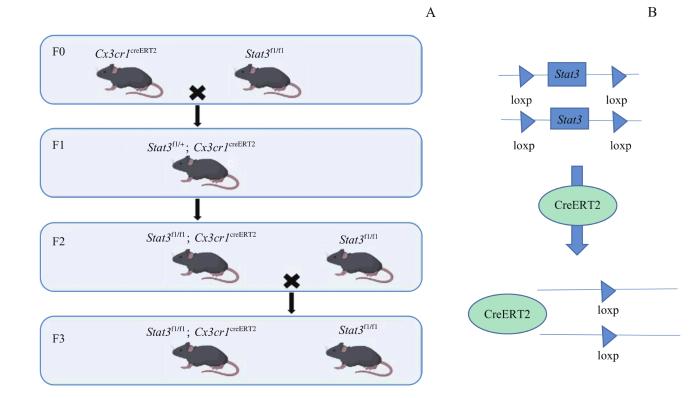
以Stat3fl/fl与Cx3cr1creERT2基因型的小鼠为F0代,杂交获得Stat3fl/+; Cx3cr1 creERT2为F1代。F1代自交,获得Stat3fl/fl; Cx3cr1 creERT2为F2代。F2代与Stat3fl/fl交配,最终同时获得数量相近的条件敲除小鼠(conditional knockout,CKO)、对照小鼠(wild type,WT)仔鼠为F3代,进行后续实验。
1.4 小鼠基因型鉴定
小鼠3周龄时利用剪脚趾标号,将所剪脚趾置于1.5 mL的EP管中,加入裂解液,置于55 ℃烘箱过夜,第二天取出待其温度到室温后16 200×g离心3 min,吸出上清至新1.5 mL的EP管,加入等量异丙醇,颠倒混匀,16 200× g离心3min,弃上清,加2倍体积70% 乙醇,涡旋后,16 200×g离心3 min,弃上清,ddH2O溶解后4 ℃保存待用。采用20 μL扩增体系,2×PCR Mix 10 μL,上下游引物各1 μL,样品2 μL,ddH2O补足到20 μL。引物序列如表1。配置好扩增体系后,置于PCR反应仪中,开启反应扩增程序,结束后配置2%琼脂糖凝胶电泳。凝胶成像仪成像后判定基因型。
表1 PCR引物序列
Tab 1
| Primer | Sequence (5'→3') | Primer Type |
|---|---|---|
| Cx3cr1 | AAGACTCACGTGGACCTGCT | Common forward |
| CGGTTATTCAACTTGCACCA | Mutant reverse | |
| AGGATGTTGACTTCCGAGTTG | Wild type reverse | |
| Stat3 | TTGACCTGTGCTCCTACAAAA | Forward A |
| CCCTAGATTAGGCCAGCACA | Reverse A |
1.5 基因诱导敲除
1.5.1 他莫昔芬配置
称取他莫昔芬粉末加入玉米油中,配置成20 mg/mL,37 ℃避光摇晃至其充分溶解后,置于4 ℃保存备用。
1.5.2 体内给药
小鼠6周龄时腹腔注射他莫昔芬玉米油溶液,每只小鼠注射剂量为0.1 mL,间隔24 h给药,连续给药5 d,2周后分别随机选取4只WT小鼠及4只CKO小鼠进行基因敲除效率的验证。
1.6 基因敲除效率验证
1.6.1 组织切片免疫荧光
小鼠冰上灌注后取脑置于4%多聚甲醛(PFA),4 ℃固定48 h,20%和30%蔗糖梯度脱水,冰冻切片包埋剂(OCT)包埋后制备冰冻切片,磷酸盐缓冲液(PBS)清洗后封闭,STAT3和离子钙接头蛋白(IBA1)一抗共同4 ℃孵育过夜,PBS清洗后,37 ℃避光孵育辣根过氧化物酶标记的二抗30 min,PBS清洗后,滴加含4′, 6-二脒基-2-苯基吲哚(DAPI)的荧光防淬灭封片剂后封片,荧光显微镜下拍照。
1.6.2 免疫磁珠分选法(magnetic activated cell sorting,MACS)提取小胶质细胞
脑组织灌流后取出剪碎,消化后过70目筛网,4 ℃离心后用30% percoll重悬沉淀,去除最上层髓鞘及上层液体,PBS清洗细胞沉淀,用100 μL胎牛血清(FBS)重悬得脑组织单细胞悬液。显微镜下细胞计数,每107个细胞重悬于90 μL FBS,加10 μL CD11b磁珠,4 ℃避光孵育15 min,PBS清洗后过柱,得到小胶质细胞。
1.6.3 实时定量PCR检测
取CKO、WT小鼠MACS后的细胞,采用离心柱式提取RNA。超微量核酸蛋白检测仪测定RNA浓度,Takara反转录试剂盒反转为cDNA。采用10 μL反应体系,加入SYBR 5 μL,上下游引物各0.5 μL,cDNA模板1 μL,ddH2O 3 μL,每个样品3个复孔,点板后离心混匀,放入罗氏荧光定量PCR仪开启程序,结束后采用GraphPad Prism 9.0对结果进行分析。
1.6.4 流式细胞术检测
取他莫昔芬诱导后小鼠,制备脑细胞悬液及脾细胞悬液,100 μL PBS重悬106个细胞于流式管中,加入PerCP Cy5.5-CD11b和APC Cy7-CD45流式抗体标记小胶质细胞;加入APC Cy7-CD45和APC-F4/80流式抗体标记脾巨噬细胞,4 ℃避光孵育30 min,PBS清洗;固定破膜后,加入PE-Stat3流式抗体检测STAT3的表达,4 ℃避光孵育30 min,PBS清洗,流式细胞仪检测STAT3的表达。
1.7 脑内神经元和小胶质细胞检测
1.7.1 尼氏染色检测脑内神经元细胞
小鼠经生理盐水灌注后用4% PFA灌注,取脑置于4% PFA中固定24 h,石蜡包埋后切片,脱蜡至95%乙醇,入牢固蓝染色液,室温过夜后95%乙醇洗去多余染色液,蒸馏水冲洗,入分化液分色15 s,入70%乙醇分色30 s,水洗,95%乙醇、100% 乙醇依次脱水,二甲苯透明,中性树胶封固后,显微镜下拍照。
1.7.2 免疫荧光观察小胶质细胞
各组选取截面相近的大脑冰冻切片,PBS清洗后封闭,IBA1一抗共同4 ℃孵育过夜,PBS清洗后,37 ℃避光孵育辣根过氧化物酶标记的二抗30 min,PBS清洗后,滴加含DAPI的荧光防淬灭封片剂后封片,荧光显微镜下拍照。
1.7.3 流式细胞术检测小胶质细胞分型
利用CKO小鼠和WT小鼠制备脑细胞悬液,100 μL PBS重悬106个细胞于流式管中,加入PerCP Cy5.5-CD11b和APC Cy7-CD45流式抗体标记小胶质细胞,4 ℃避光孵育30 min,PBS清洗,固定破膜后,加入APC-CD86流式抗体检测M1型小胶质细胞,加入PE Cy7-CD206流式抗体检测M2型小胶质细胞,4 ℃避光孵育30 min,PBS清洗,流式细胞仪检测。
1.8 统计学分析
用GraphPad Prism 9.0软件进行统计学分析。实验数据用x±s表示,组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠模型的构建
CKO小鼠的繁育如图1所示。F0代Stat3fl/fl与Cx3cr1 creERT2基因型的小鼠杂交,成功获得基因型为Stat3fl/+; Cx3cr1 creERT2的F1代。F1自交,成功获得足够数量基因型为Stat3fl/fl; Cx3cr1 creERT2的F2代。后继续与Stat3fl/fl交配,最终可成功同时获得数量相近的Stat3fl/fl; Cx3cr1 creERT2(CKO)、Stat3fl/fl(WT)实验鼠。
图1
图1
小鼠模型构建示意
Note:A. Schematic diagram of mice breeding. B. Schematic diagram of Stat3 gene knockdown.
Fig 1
Schematic diagram of the construction of mice
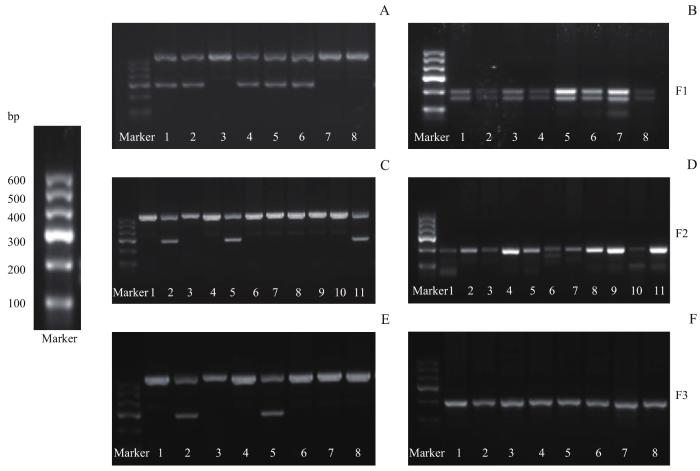
2.2 小鼠的基因型鉴定
表2 基因型对应的特异性引物条带
Tab 2
| Primer | Genotype | Location |
|---|---|---|
| Cx3cr1 | WT | 695 bp |
| Cx3cr1creERT2 | 300 bp; 695 bp | |
| Stat3 | Stat3fl/+ | 146 bp; 187 bp |
| Stat3fl/fl | 187 bp |
图2
图2
小鼠基因型鉴定结果
Note: A/B. Cx3cr1 creERT2 and Stat3fl/fl genotype identification results of F1 generation mice, respectively. C/D. Cx3cr1 creERT2 and Stat3fl/fl genotype identification results of F2 generation mice, respectively. E/F. Cx3cr1 creERT2 and Stat3fl/fl genotype identification results of F3 generation mice, respectively.
Fig2
Genotype identification of mice
2.3 他莫昔芬诱导后小胶质细胞STAT3变化情况
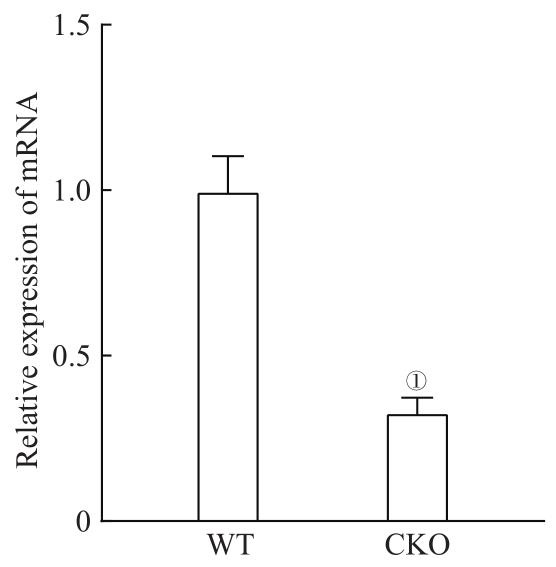
2.3.1 CKO小鼠小胶质细胞Stat3 mRNA表达变化
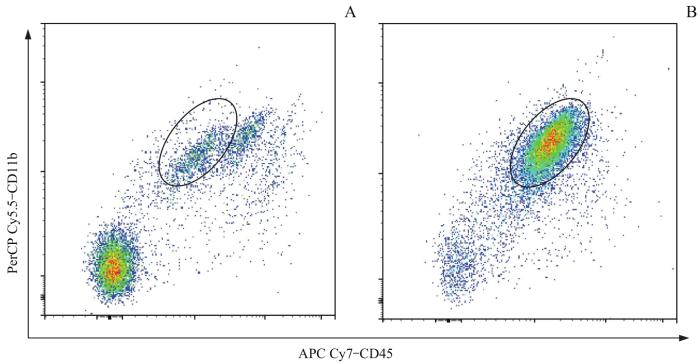
图3
图3
流式细胞术检测MACS后小胶质细胞的纯度变化
Note: A.Microglia proportion before MACS. B.Microglia proportion after MACS.
Fig 3
Detection of microglial purity changes after MACS by flow cytometry
图4
图4
小胶质细胞 Stat3 mRNA表达情况
Note:①P=0.001, compared with the WT mice.
Fig 4
Stat3 mRNA expression in microglia
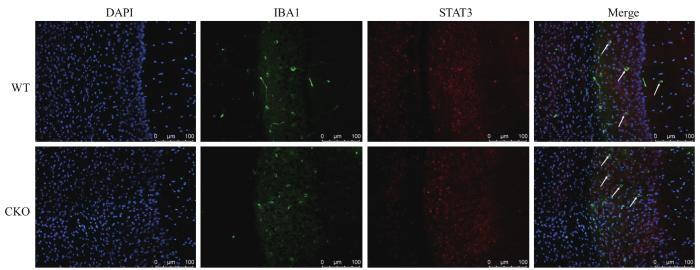
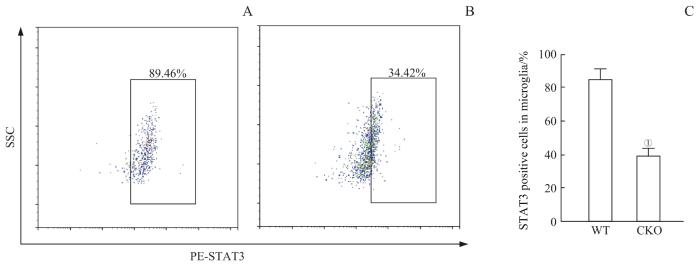
2.3.2 CKO小鼠小胶质细胞STAT3蛋白表达变化WT与CKO组小鼠大脑切片免疫染色,绿色荧光为IBA1标记的小胶质细胞,红色荧光为标记的STAT3,蓝色荧光为DAPI标记的细胞核。结果显示,如图5,与WT组相比CKO组的小胶质细胞STAT3荧光强度较弱,说明CKO组小鼠小胶质细胞内STAT3蛋白表达减少。该结果表明小鼠腹腔注射他莫昔芬后,CKO小鼠小胶质细胞中的STAT3表达降低,可实现STAT3蛋白层面的敲除。通过流式细胞术对CKO和WT小鼠小胶质细胞中的胞内因子STAT3进行分析。结果显示如图6,WT组小胶质细胞中STAT3阳性细胞占比为(85.30±5.69)%,CKO组小胶质细胞中STAT3阳性细胞占比为(39.70±3.88)%,差异具有统计学意义(P=0.001),说明在CKO小鼠在蛋白水平上可以实现小胶质细胞STAT3的敲除。
图5
图5
免疫荧光检测小胶质细胞内STAT3的表达变化
Note: DAPI staining (blue) and STAT3 staining (red) in microglia represented by IBA1 (green). White arrows indicate microglia. Scale bar=100 μm.
Fig5
Detection of changes in STAT3 expression in microglia by immunofluorescence
图6
图6
流式细胞术检测小鼠小胶质细胞中STAT3变化
Note: A. Detection of STAT3-positive cells in microglia of the WT mice by flow cytometry. B. Detection of STAT3-positive cells in microglia of the CKO mice by flow cytometry. C. Statistics on the percentage of STAT3-positive cells in microglia. ①P=0.001, compared with the WT mice.
Fig 6
Detection of STAT3 changes in mice microglia by flow cytometry
2.3.3 流式细胞术检测CKO小鼠脾巨噬细胞的变化
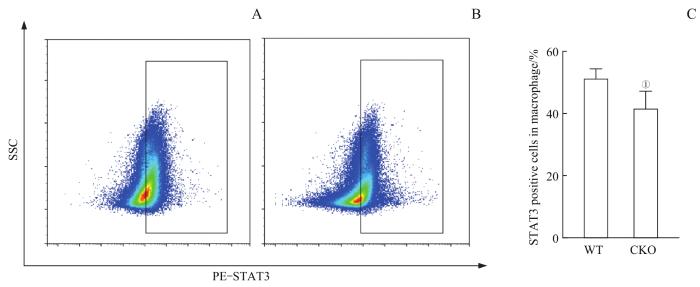
通过流式细胞术对2组小鼠脾巨噬细胞中的胞内因子STAT3进行分析,如图7,WT组脾巨噬细胞中STAT3阳性细胞占比为(54.75±3.87)%,CKO组的脾巨噬细胞中STAT3阳性细胞占比为(40.76±6.01)%,2组差异无统计学意义。上述结果提示,相较小胶质细胞中STAT3的变化,脾巨噬细胞STAT3的变化较不明显,且CKO与WT小鼠比较无显著差异,小鼠可用于STAT3机制的进一步研究。
图7
图7
流式细胞术检测小鼠脾巨噬细胞中STAT3变化
Note: A. Detection of STAT3-positive cells in splenic macrophage of the WT mice by flow cytometry. B. Detection of STAT3-positive cells in splenic macrophage of the CKO mice by flow cytometry. C. Statistics on the percentage of STAT3-positive cells in splenic macrophage. ①P=0.098, compared with the WT mice.
Fig 7
Detection of STAT3 changes in mice splenic macrophage by flow cytometry
2.4 脑内神经元和小胶质细胞的情况
2.4.1 尼氏染色检测神经元的情况
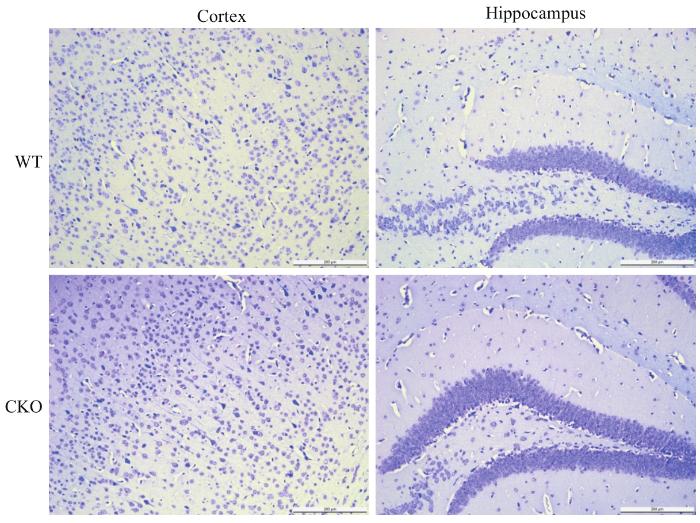
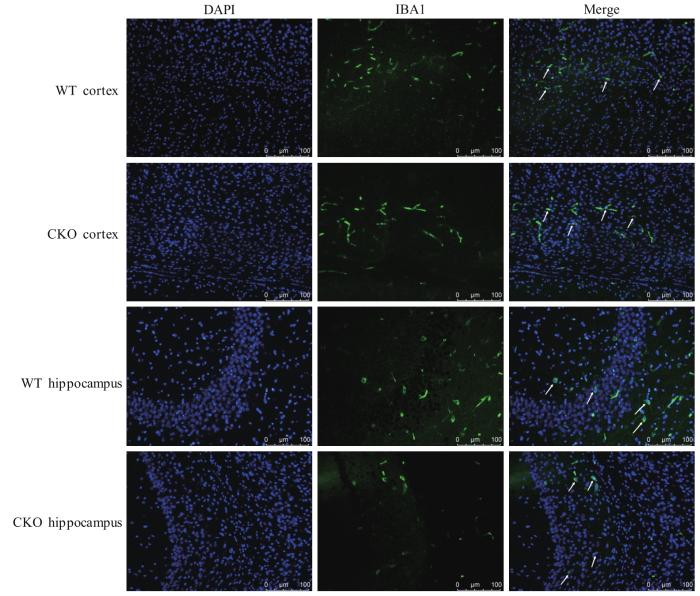
观察小鼠皮层及海马区域神经元数目及形态变化,结果如图8,CKO组与WT组小鼠皮层和海马区域染色结果未见明显差异,说明CKO小鼠的神经元未受到显著影响。
图8
图8
尼氏染色检测神经元的变化
Note: Scale bar=200 μm.
Fig 8
Detection of the changes in neurons by Nissl staining
2.4.2 小胶质细胞的情况
图9
图9
免疫荧光检测小胶质细胞变化
Note: DAPI staining (blue) and microglia represented by IBA1 (green). Scale bar=100 μm.
Fig 9
Detection of the changes of microglia by immunofluorescence
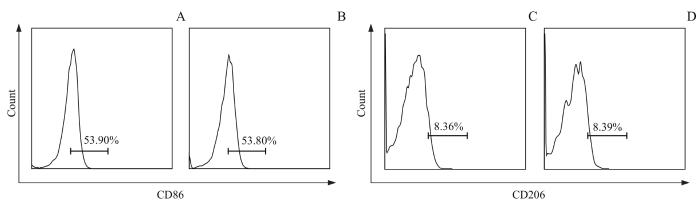
图10
图10
流式细胞术检测小胶质细胞表型的变化
Note: A. Detection of the CD86-positive cells of microglia in the WT mice by flow cytometry. B. Detection of the CD86-positive cells of microglia in the CKO mice by flow cytometry. C. Detection of the CD206-positive cells of microglia in the WT mice by flow cytometry. D. Detection of the CD206-positive cells of microglia in the CKO mice by flow cytometry.
Fig 10
Detection of the type in mice microglia by flow cytometry
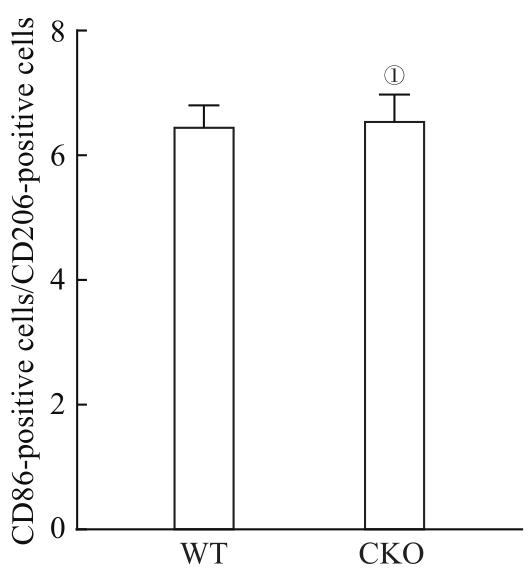
图11
图11
M1型小胶质细胞与M2型小胶质细胞比例的变化
Note: ①P=0.859, compared with the WT mice.
Fig 11
Changes of M1 microglia/M2 microglia
3 讨论
STAT3信号通路是疾病中普遍存在的信号级联。一方面,STAT3在不同条件下参与不同细胞类型的各种信号通路。在发生阿尔茨海默病时,STAT3信号通路被激活后可导致β-分泌酶(β-site APP cleaving enzyme 1,BACE1)上调,进而影响星形胶质细胞代谢并使Aβ产生增加,同时参与调节神经元毒性,影响AD的病理过程[13]。REICHENBACH等[14]在阿尔茨海默病模型小鼠中特异性条件敲除星形胶质细胞中的Stat3基因后,发现Aβ水平降低,促炎细胞因子激活减少,小鼠学习记忆能力较对照组提升,提示抑制STAT3可能通过影响APP代谢,减轻神经炎症来纠正学习记忆能力的损害。在一些研究中,也有证据表明STAT3激活会降低大脑的恢复能力,阻断STAT3通路时可逆转该结果[15]。另一方面,神经炎症时,小胶质细胞和星形胶质细胞被激活可以产生促炎细胞因子,导致修复功能损伤,并激活STAT3信号[16-17]。有研究表明P. gingivalis-LPS造成的牙周炎症可激活JAK2/STAT3信号通路导致外周及中枢的炎症因子水平上调,引起小胶质细胞的活化,同时导致小鼠学习记忆能力下降,且这些症状在应用STAT3抑制剂后有明显改善[18]。上述研究提示,STAT3信号介导的小胶质细胞活化可能在神经和牙周炎症的发生发展中起重要作用。
小胶质细胞STAT3信号激活在牙周炎促进认知损害中的作用机制尚不明确,且目前尚无成熟的小胶质细胞Stat3基因条件性敲除的小鼠模型。本研究在构建小鼠模型后不仅验证了其敲除效率,还利用流式细胞术分析了CKO小鼠与WT小鼠的小胶质细胞、小胶质细胞(中枢巨噬细胞)和外周巨噬细胞的差异,并同时分析了对神经元细胞及小胶质细胞本身的影响,为进一步深入探讨小胶质STAT3信号激活的作用提供了基础。
在实验过程中选用Stat3fl /fl小鼠,与表达Cre重组酶的Cx3cr1 creERT2小鼠进行交配,多代繁育后获得CKO小鼠,并用他莫昔芬对6周龄小鼠进行Stat3基因的诱导敲除。为验证其敲除效率,利用琼脂糖凝胶电泳的方法进行鼠尾基因型鉴定后,提取CKO与WT小鼠的小胶质细胞从基因和蛋白水平分别证实了Stat3的敲除。由于Cx3cr1同时也在巨噬细胞中表达,为证明小胶质细胞中Stat3的特异性敲除,同时检测外周巨噬细胞中STAT3的表达情况,故利用流式细胞术检测CKO与WT小鼠的脾巨噬细胞中STAT3的变化情况,发现CKO小鼠脾巨噬细胞中也有一定程度上的敲除,但无统计学差异,证实了小胶质细胞Stat3基因的特异性敲除。为检测对小鼠神经元的影响,利用尼氏染色观察比较神经元数目,证明了小胶质细胞Stat3基因敲除后,未对其神经元产生影响。为检测对小胶质细胞的影响,利用免疫荧光观察到皮层和海马区域小胶质细胞形态无明显差别;利用流式细胞术观察小胶质细胞极化情况,CKO小鼠与WT小鼠未见明显差异。以上结果表明,本研究成功建立了小胶质细胞Stat3基因敲除小鼠模型,且小鼠小胶质细胞Stat3基因条件性敲除后,未对小胶质细胞产生显著影响。
作者贡献声明
朱晓晨、周薇参与了实验设计以及论文的写作和修改。朱晓晨、谢欣宜、赵旭日、徐丽娜、何智妍负责实验操作。朱晓晨负责数据分析。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by ZHU Xiaochen and ZHOU Wei. The manuscript was drafted and revised by ZHU Xiaochen and ZHOU Wei. The experiments were performed by ZHU Xiaochen, XIE Xinyi, ZHAO Xuri, XU Lina and HE Zhiyan. The results were analyzed by ZHU Xiaochen. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献