G蛋白偶联受体超家族(G protein-coupled receptor,GPCR)是分布于细胞表面的相对分子质量最大、最富于多样性的一个受体超家族[5],是对细胞外刺激作出反应并调节细胞内信号通路的关键蛋白。GPCR在哺乳动物中主要包括5个家族,其中最大的家族是视紫红质家族,其次是黏附性GPCR(adhesion G protein-coupled receptor,aGPCR),而后依次是谷氨酸家族(C类)、Secretin家族(B类)和Frizzled家族[6]。作为GPCR的一个重要分支,aGPCR在人类基因组中共分为9个不同的亚家族,共33名成员,其共同特征是具有超长的N末端结构域和1个7次跨膜结构域[7]。近年来,发现在许多癌症中aGPCR存在异常表达、功能突变,如非小细胞肺癌、乳腺癌、胶质母细胞瘤和黑色素瘤等[8-11]。这类受体及其内源性配体已被证实可以通过激活相应的信号通路影响肿瘤的生长迁移,包括影响癌细胞增殖、血管生成以及侵袭和转移等。ADGRF1是aGPCR家族成员之一,在肺癌、前列腺癌、乳腺癌和肝细胞癌等多种癌症的发生发展过程中被确认为癌基因[12-15]。2010年,LUM等[12]发现孤儿受体ADGRF1作为一种癌基因在肺癌和前列腺癌中过度表达。此外,MA等[13]发现,ADGRF1的缺失可以通过激活白细胞介素-6/信号转导及转录激活蛋白3(interleukin-6/signal transducer and activator of transcription 3,IL-6/STAT3)信号通路来减缓致癌物诱导的肝癌发展。另外一项研究[14]表明,ADGRF1可以作为人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌治疗的一种潜在新靶点。然而,ADGRF1对PDAC发生发展以及预后是否具有重要作用尚未被研究。
为了寻找PDAC新的治疗靶点,本研究基于生物信息学数据库分析ADGRF1的表达与PDAC患者不良预后的关系,通过体外功能试验进一步探究ADGRF1对PDAC细胞增殖的影响及其潜在的分子机制,以期为PDAC的靶向治疗提供新的选择。
1 材料与方法
1.1 试剂及仪器
DMEM培养液、RPMI 1640培养液、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗(Gibco,美国),蛋白酶抑制剂(Bimake,美国),ADGRF1抗体(ThermoFisher Scientific,美国)、β-actin抗体(Proteintech,美国),辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠/兔IgG(二抗,上海圣尔生物科技有限公司),RIPA缓冲液、通用型抗体稀释液(苏州新赛美生物科技有限公司),5×SDS蛋白上样缓冲液(北京索莱宝科技有限公司)。化学发光成像仪(Bio-Rad,美国),实时荧光定量PCR仪(ABI,美国),Aperio数字病理学切片扫描仪(Leica,德国)。
1.2 生物信息学数据库数据挖掘
选择基因表达综合(Gene Expression Omnibus,GEO)数据库中的多个数据集GSE15471、GSE16515、GSE28735、Renji cohort,分析ADGRF1及其他aGPCR家族成员在PDAC组织和正常胰腺组织中的表达。基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中PDAC患者癌组织和正常胰腺组织的转录组测序数据,利用在线数据库GEPIA(
1.3 细胞培养
人PDAC细胞系AsPC-1、BxPC-3、Capan-1、CFPAC-1、PANC-1、MIA PaCa-2、Patu8988、SW1990及正常胰腺导管上皮细胞hTERT-HPNE均购自中国科学院细胞库。细胞培养标准遵循美国模式菌种保藏中心(American Type Culture Collection,ATCC)要求,采用DMEM培养液培养hTERT-HPNE、Capan-1、PANC-1、MIA PaCa-2、Patu8988、SW1990细胞,采用RPMI 1604培养液培养AsPC-1、Bxpc3、CFPAC-1细胞,培养液中均添加10% FBS和1%青霉素-链霉素双抗,所有细胞均保存在37 ℃、5% CO2的恒温培养箱中。
1.4 PDAC细胞中ADGRF1表达水平检测
分别提取野生型hTERT-HPNE、CFPAC-1、AsPC-1、SW1990、Bxpc3、PANC-1、MIA PaCa-2、Capan-1和Patu8988细胞的总RNA,使用PrimeScript™RT Master Mix(Takara,RR036A)合成cDNA后进一步通过实时荧光定量PCR(quantitative real-time PCR,qPCR)检测上述细胞中ADGRF1 mRNA的表达情况。以18s作为内参对照,ADGRF1的表达采用
表1 qPCR引物序列
Tab 1
| 18s | TGCGAGTACTCAACACCAACA | GCATATCTTCGGCCCACA |
| ADGRF1 | TTCGGCAAGTTCGATGAATTAGC | CACGCATGTTCAGATCCACCT |
采用Western blotting实验检测上述细胞中ADGRF1的蛋白表达情况。细胞用含有蛋白酶抑制剂的RIPA缓冲液在冰上洗涤并裂解10 min,然后将蛋白裂解液在4 ℃离心10 min,收集上清液。用5×SDS上样缓冲液制备蛋白质上清液,并在100 ℃下变性5 min,随后用10% PAGE凝胶电泳法分离合适的蛋白质样品,并使用eBlot™L1蛋白转移系统(GenScrip)将蛋白质转移到NC膜上。膜在5%脱脂奶粉和TBST(含0.1% Tween 20的TBS)溶液中室温孵育1 h,然后与抗β-actin、ADGRF1抗体孵育过夜。将膜清洗3次,每次10 min,随后与HPR标记的山羊抗鼠或兔二抗在室温下孵育1 h。化学发光成像仪拍照。
1.5 人类标本中ADGRF1表达量检测
收集2021年9月—12月在上海交通大学医学院附属仁济医院就诊的6例PDAC患者的肿瘤组织以及相应的癌旁组织。组织标本在4%多聚甲醛中完成固定后,经石蜡包埋并切片。随后采用免疫组织化学染色(immunohistochemistry staining,IHC)技术,对上述切片进行染色,ADGRF1抗体的稀释比例为1∶200。染色完成后再行脱水、封片,上述步骤完成后对切片进行扫描并观察细胞染色情况。
1.6 siRNA瞬时转染
在6孔板中接种处于对数生长期的AsPC-1、SW1990细胞,铺板应均匀。待细胞生长至60%~70%融合度时,分别将小干扰RNA(small interfering RNA,siRNA)阴性对照(NC-siRNA)、ADGRF1-siRNA1、ADGRF1-siRNA2转染至上述2种细胞中,转染过程中辅助使用jetPRIME®试剂。随后在37 ℃、5% CO2的恒温培养箱中继续培养12 h并更换培养液,经Western blotting验证转染效率后进行后续研究。用于转染的siRNA由上海吉玛制药技术有限公司合成。siRNA序列见表2。
表2 siRNA序列和过表达引物序列
Tab 2
| NC-siRNA | UUCUCCGAACGUGUCACGUTT | ACGUGACACGUUCGGAGAATT |
| ADGRF1-siRNA1 | UGGUCACAUGGGCUAAUUATT | UAAUUAGCCCAUGUGACCAUA |
| ADGRF1-siRNA2 | UCUCAUUAUAUCUGUCAUUTT | AAUGACAGAUAUAAUGAGAGG |
| ADGRF1 | CGCAAATGGGCGGTAGGCGTG | AGAGACAGCAACCAGGAT |
1.7 稳转株构建及过表达效率分析
将处于对数生长期的Patu8988细胞接种于6孔板中,密度为每孔106个细胞。随后在不同孔中添加ADGRF1-Vector、ADGRF1-OE慢病毒液进行感染,慢病毒感染复数(multiplicity of infection,MOI)为20。慢病毒液由和元生物技术上海有限公司合成。过表达引物序列见表2。转染48 h后在浓度为2.5 μg/mL的嘌呤霉素下筛选14 d,以获取稳定过表达ADGRF1的Patu8988细胞株。提取细胞总蛋白,利用Western blotting检测ADGRF1的过表达效率。
1.8 PDAC肿瘤细胞增殖能力检测
1.8.1 CCK8实验
将成功转染siRNA的AsPC-1、SW1990细胞以及稳定过表达ADGRF1的Patu8988细胞,接种于96孔板中,密度2×103个/孔,在37 ℃、5% CO2的恒温培养箱中培养。在接种的当日及1、2、3 d后弃去旧培养液,更换的新鲜培养液中添加10% CCK8试剂,继续在培养箱中反应1 h,随后在450 nm波长条件下用酶标仪测量细胞的吸光度,并通过GraphPad Prism9.0软件绘制AsPC-1、SW1990、Patu8988细胞的生长曲线。
1.8.2 平板克隆形成实验
分别将PDAC细胞AsPC-1、SW1990均匀接种在6孔板中,细胞密度3×103个/孔,随后每隔3 d观察克隆形成情况并更换培养液,当培养皿中形成肉眼可见的克隆时终止培养。弃去上清液,用磷酸盐缓冲液浸洗2次,再经4%多聚甲醛固定、结晶紫染色、清水润洗并晾干后拍照记录。克隆的数量和大小采用ImageJ软件作进一步的统计与分析。
1.9 RNA测序
成功转染NC-siRNA和ADGRF1-siRNA2的AsPC-1细胞,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)小心浸洗2次。使用RNAiso Plus(Takara,日本)从细胞样品中提取总RNA,体积20 μL,浓度500 ng/μL,用于RNA完整性检测和RNA文库制备。后续提供给上海旭燃生物科技有限公司进行RNA测序(RNA-sequence,RNA-seq)。
1.10 统计学分析
下载的各项数据库资料通过R语言进行分析,实验数据采用GraphPad Prism 9.0和Excel软件进行统计分析。所有数据均用x±s表示。2组间比较采用Student′s t检验,多组间比较采用单因素方差分析或双因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 aGPCR在胰腺癌中的表达情况
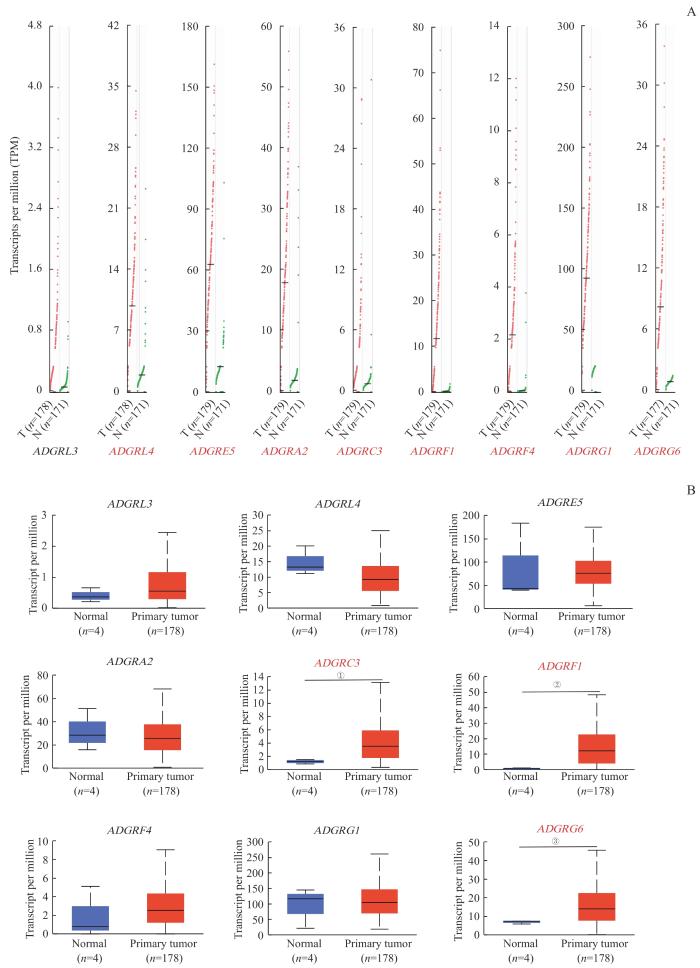
基于Oncomine的GEO数据库比较aGPCR不同家族成员在PDAC和正常胰腺组织中的转录水平,发现ADGRL3、ADGRL4、ADGRE5、ADGRA2、ADGRC3、ADGRF1、ADGRF4、ADGRG1和ADGRG6基因在PDAC组织中高表达。随后,基于TCGA数据库,利用GEPIA数据库和UALCAN在线分析工具进一步分析上述9个基因在PDAC组织和正常胰腺组织中的表达情况。GEPIA分析结果显示,除ADGRL3外,其他8个基因在PDAC组织中的表达水平高于正常胰腺组织(图1A,P<0.05);UALCAN分析结果显示,仅ADGRC3、ADGRF1和ADGRG6基因在PDAC组织中的表达水平高于正常胰腺组织(图1B,P<0.05)。2个分析结果取交集后,筛选出ADGRC3、ADGRF1和ADGRG6进一步分析。
图1
图1
aGPCR在PDAC组织和正常胰腺组织中的表达情况
Note: A. GEPIA analysis showed that eight genes were differentially expressed, namely ADGRL4, ADGRE5, ADGRA2, ADGRC3, ADGRF1, ADGRF4, ADGRG1 and ADGRG6. B. UALCAN analysis showed that three genes were differentially expressed, namely ADGRC3, ADGRF1 and ADGRG6.①P=0.000, ②P=0.000, ③P=0.000, compared with the normal group.
Fig 1
Expression of aGPCR in PDAC and normal pancreatic tissues
2.2 PDAC患者中 ADGRC3 、 ADGRF1 和 ADGRG6 的表达以及其对患者预后、肿瘤分期及分级的影响
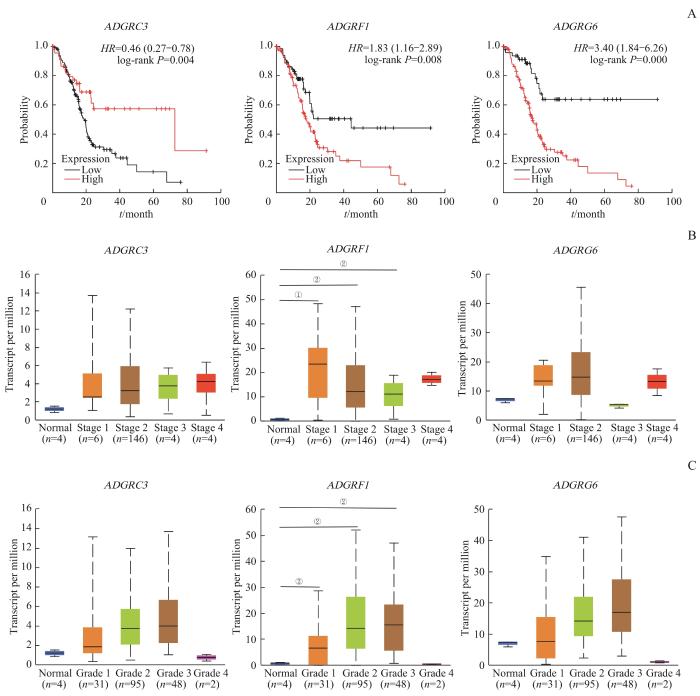
在TCGA数据库中进一步探讨ADGRC3、ADGRF1和ADGRG6在胰腺癌患者生存中的关键作用,使用Kaplan-Meier曲线分析上述3种基因的mRNA水平与PDAC患者生存预后之间的相关性。结果显示,ADGRF1和ADGRG6 mRNA表达水平的升高与胰腺癌患者总生存期呈负相关,而ADGRC3 mRNA表达水平的升高与胰腺癌患者的总生存期呈正相关(图2A,均P<0.05)。继续在TCGA数据库中分析PDAC患者上述3种基因mRNA的表达与肿瘤TNM分期和异型性分级之间的相关性,结果显示,仅ADGRF1 mRNA在TNM分期较晚以及肿瘤异型性分级更高的患者中表达量增多,且ADGRF1 mRNA与TNM分期及肿瘤异型性分级相关性最为显著(图2B、C)。
图2
图2
PDAC患者中 ADGRC3 、 ADGRF1 和 ADGRG6 表达升高对患者预后、肿瘤分期及分级的影响
Note: A. Correlation between ADGRC3, ADGRF1 and ADGRG6 mRNA expression and survival prognosis of patients in TCGA database. B. Correlation between ADGRC3, ADGRF1, and ADGRG6 mRNA expression and TNM staging in PDAC patients in the TCGA database. C. Correlation between ADGRC3, ADGRF1 and ADGRG6 mRNA expression and the heterotypic grading of PDAC patients. ①P=0.031, ②P=0.000, compared with the normal group.
Fig 2
Impact of increased expression of ADGRC3, ADGRF1 and ADGRG6 on patient prognosis, tumor staging, and grading in PDAC patients
2.3 ADGRF1 在PDAC细胞和组织中的表达
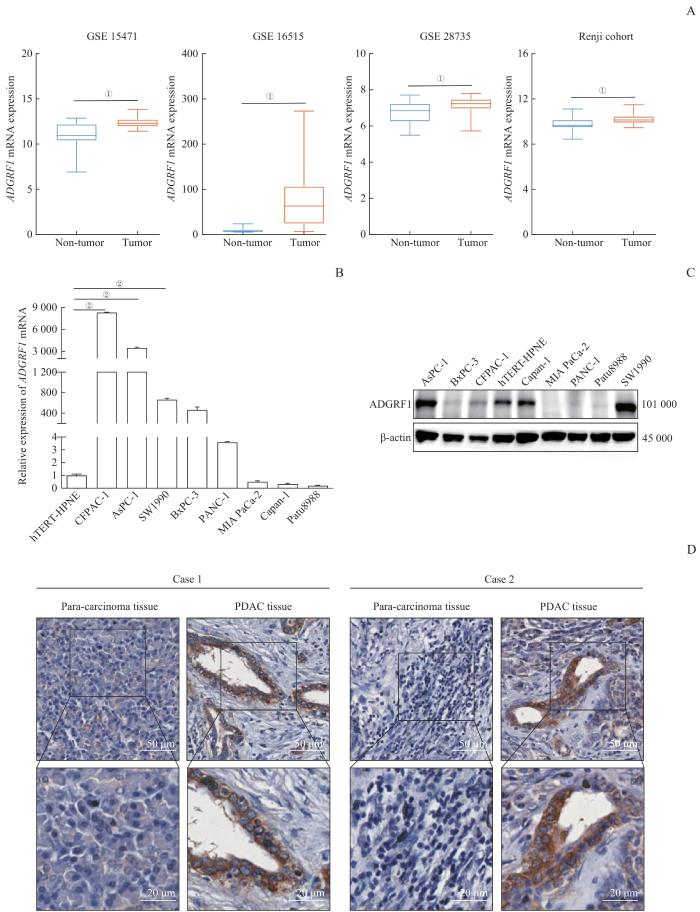
分析GSE15471、GSE16515、GSE28735以及Renji cohort等多个GEO数据集中ADGRF1 mRNA在PDAC组织和正常胰腺组织中的表达差异,结果显示,与正常胰腺组织相比,ADGRF1 mRNA在PDAC组织中的表达水平显著上调(图3A,均P<0.05)。随后采用qPCR和Western blotting检测8种PDAC细胞和正常胰腺导管上皮细胞hTERT-HPNE中ADGRF1的mRNA和蛋白表达水平,结果显示,在PDAC细胞AsPC1和SW1990中ADGRF1的mRNA和蛋白水平均高于hTERT-HPNE细胞(图3B、C)。此外,6例PDAC患者癌组织及邻近非肿瘤组织标本的IHC结果显示,相较于癌旁组织,PDAC组织中的棕黄色染色更深,即PDAC组织中存在更高的ADGRF1蛋白水平(图3D)。
图3
图3
ADGRF1 在PDAC组织和细胞中的表达
Note: A. Expression of ADGRF1 mRNA in PDAC tissues were higher compared to para-carcinoma tissues in GSE15471, GSE16515, GSE28735 and Renji cohort datasets. B. Detection of the mRNA expression of ADGRF1 in eight PDAC cells and hTERT-HPNE cells by qPCR. C. Detection of the protein expression of ADGRF1 in eight PDAC cells and hTERT-HPNE cells by Western blotting. D. IHC was used to detect the expression of ADGRF1 in PDAC tissues and adjacent tissues of PDAC patients. ①P=0.000, compared with the non-tumor group; ②P=0.000, compared with the hTERN-HPNE group.
Fig 3
Analysis of the expression a of ADGRF1 in PDAC tissues and cells
2.4 ADGRF1 对PDAC细胞增殖的影响
为评估ADGRF1对PDAC肿瘤细胞增殖能力的影响,分别利用NC-siRNA、ADGRF1-siRNA1、ADGRF1-siRNA2瞬时转染高表达ADGRF1的PDAC细胞系Aspc1、SW1990,从而建立ADGRF1敲低细胞系。随后采用Western blotting分析ADGRF1在上述2种细胞中的表达变化,结果显示与转染NC-siRNA相比,分别转染ADGRF1-siRNA1、ADGRF1-siRNA2的上述细胞中ADGRF1的表达显著降低(图4A、B)。分别通过CCK8实验、平板克隆形成实验对已转染的Aspc1、SW1990细胞的增殖能力进行检测,结果显示下调ADGRF1的表达使该2种细胞的增殖能力显著降低(图4C~F,均P<0.05)。
图4
图4
ADGRF1 对PDAC细胞增殖的促进作用
Note: A/B. Detection of ADGRF1 expression in AsPC-1 (A) and SW1990 (B) cells by Western blotting. C/D. CCK8 was used to detect the effect of ADGRF1 knockdown on the proliferation ability of AsPC-1 (C) and SW1990 (D) cells. E/F. Plate clonal formation experiment was used to detect the effect of ADGRF1 knockdown on the proliferation ability of AsPC-1 and SW1990 cells. Typical images of cell clones stained with crystal violet (E) and statistical analysis results of formed cell clones (F). G. Detection of ADGRF1 expression in Patu8988 cells by Western blotting. H. Detection of the effect of ADGRF1 overexpression on the proliferation capacity of Patu8988 cells by CCK8. ①P=0.002, ②P=0.000, compared with the NC-siRNA group; ③P=0.002, compared with the ADGRF1-Vector group.
Fig 4
Promoting effect of ADGRF1 on the proliferation of PDAC cells
2.5 RNA-seq结果分析
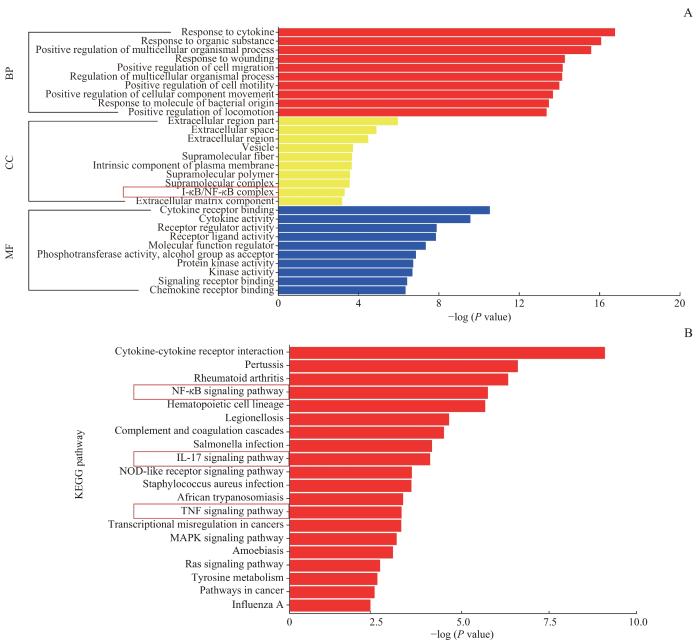
为进一步探索ADGRF1促进PDAC细胞增殖的具体机制,对分别转染NC-siRNA和ADGRF1-siRNA2的PDAC AsPC1细胞进行RNA-seq。基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析结果(图5A、B)显示,ADGRF1的表达与多种免疫相关信号通路有关,包括核因子κB(nuclear factor κB,NF-κB)、白细胞介素-17(interleukin-17,IL-17)以及肿瘤坏死因子(tumor necrosis factor,TNF)信号通路等。
图5
图5
RNA-seq结果的GO和KEGG分析
Note: A. GO enrichment analysis predicted the functional roles of target host genes based on three aspects, including biological processes (BP), cellular components (CC) and molecular functions (MF), and the results of CC suggested that ADGRF1 may be related to the NF-κB signaling pathway. B. KEGG analysis predicted the functions of ADGRF1 and the signaling pathways significantly associated with ADGRF1 alterations including NF-κB, IL-17 and TNF signaling pathways.
Fig 5
GO and KEGG analysis of RNA-seq results
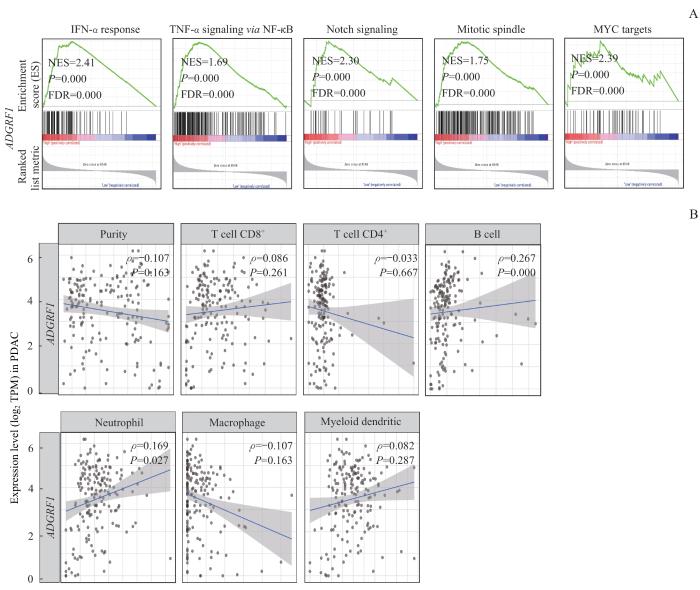
2.6 ADGRF1 在富集分析和免疫浸润分析中的结果
基于RNA-seq的结果,通过基因集富集分析(Gene Set Enrichment Analysis,GSEA)和免疫浸润分析进一步探究ADGRF1与免疫系统存在的潜在关联。GSEA的结果再次表明,ADGRF1的表达与免疫相关信号通路相关,包括干扰素α(interferon-α,IFN-α)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和Notch信号通路等(图6A,均P<0.05),这也和此前RNA-seq的分析结果相吻合。随后基于TCGA数据库对ADGRF1进行免疫浸润分析,研究ADGRF1表达水平与不同类型免疫细胞的相关性。结果显示,ADGRF1表达水平与B细胞和中性粒细胞的相关性最为显著(图6B,均P<0.05)。
图6
图6
ADGRF1 在GSEA富集分析和免疫浸润分析中的结果
Note: A. GSEA enrichment analysis showed that the enrichment of ADGRF1 was related to the immune pathway, including IFN-α, TNF-α and Notch signaling pathways. B. Immune infiltration analysis showed that ADGRF1 was related to B cells and neutrophils.
Fig 6
Results of ADGRF1 in GSEA enrichment analysis and immune infiltration analysis
3 讨论
PDAC是一种恶性程度极高的消化系统肿瘤,多数患者确诊时已处于晚期,系统性治疗效果欠佳,预后较差。手术是PDAC目前最常用的治疗手段,但大多数接受了手术的患者5年总生存率仍不容乐观。
尽管近些年来对于aGPCR的研究进展不断加深,但这类受体的生理功能仍有待进一步探索,尤其是在癌症发生发展中aGPCR从肿瘤起始到转移等各个方面所起的作用还不完全了解。虽然aGPCR的N端结构域以及其他结构域为癌症治疗提供了不同的靶点,但现阶段市面上仍然没有批准任何直接针对aGPCR进行治疗的临床药物,因此作用于aGPCR的药物研发正成为癌症治疗的新方向。一方面,针对aGPCR的N末端特定结构域设计的单克隆抗体可以作为受体的激活剂或抑制剂[16];另一方面,针对GAIN结构域设计的自蛋白水解抑制剂也是一种可能的方向,因为这种蛋白水解作用是某些aGPCR发挥作用的关键,例如ADGRG1[17]。此外,对于已有明确配体的aGPCR,靶向其胞外配体从而干扰蛋白-蛋白相互作用也是一种可行的方法。除了aGPCR自身以外,受体激活的下游信号通路也在癌症发生发展中发挥了重要作用。例如,在乳腺癌中WNT信号通路可以促进肿瘤细胞增殖,而WNT通路抑制剂依地尼酸被证明可减少乳腺癌中的DNA合成从而发挥抗肿瘤作用[18],因此,以aGPCR的下游信号通路作为靶点也是一种潜在的治疗策略。总之,多项证据表明aGPCR能在促进或预防癌症方面发挥重要作用,而且随着人类对aGPCR的认识不断加深以及更多灵敏可靠的检测方法的建立,针对aGPCR的药物开发必然有着广阔的前景。
在本研究中,我们通过多种体外功能实验证实下调ADGRF1能够抑制PDAC细胞的增殖能力,而过表达ADGRF1则产生了相反的结果。此外,RNA测序、GSEA富集分级和免疫浸润分析的结果均提示ADGRF1促进胰腺癌进展的潜在机制与免疫相关信号通路有极大的关联。免疫系统具有识别和消除肿瘤细胞的潜力。在肿瘤发展和转移过程中,免疫系统与肿瘤之间有着密切的相互作用。免疫逃避是癌症的显著特征之一,许多类型的肿瘤可以逃脱免疫监视,提高自身生存率。逃避免疫攻击的机制包括肿瘤突变和肿瘤内免疫抑制微环境的逐步形成。PDAC患者的免疫力减弱,但相关的免疫逃避一直是一个研究不足的领域。ADGRF1作为癌基因存在于多种癌症中,但在癌症中与ADGRF1活性相关的下游信号通路在很大程度上仍是未知的。此前有研究[19]表明,ADGRF1的高表达与骨肉瘤患者的临床分期有关,其过表达增强了骨肉瘤细胞系的增殖、迁移和侵袭能力,但具体机制并未得到进一步阐明。另外,ABDULKAREEM等[20]研究发现ADGRF1与其下游Gαs通路的偶联是促进乳腺癌进展的原因;与这类发现一致的是,G蛋白偶联信号通路下游中环磷酸腺苷(cAMP)依赖性的蛋白激酶(PKA)在多种肿瘤的发生和发展中发挥了重要作用。本研究基于现有的生物信息学分析数据库,数据来源与统计分析具有高度可靠性和可行性;但这项研究仍然存在一定局限性,即ADGRF1促进PDAC细胞系增殖的潜在机制仍有待进一步探索。在这里我们提出2种猜想:① ADGRF1通过影响肿瘤免疫微环境,抑制NF-κB通路或非受体酪氨酸激酶(janus kinase,JAK)-信号转导及转录激活蛋白(interleukin-6/signal transducer and activator of transcription,STAT)信号通路,从而抑制各类杀伤肿瘤的细胞因子产生,促进胰腺癌进展。② ADGRF1的N端结构域解离并激活其下游7次跨膜结构域,进而激活G蛋白偶联信号通路,发挥促肿瘤增殖作用。
综上所述,本研究发现ADGRF1在PDAC患者中高表达,并与PDAC临床分期相关;其可能通过多个免疫相关信号通路促进PDAC进展。深入研究ADGRF1这一新的PDAC生物标志物,将有助于阐明PDAC的发病机制并改善其临床预后。
/Ethics Approval and Patient Consent:All experimental protocols in this study were reviewed and approved by the Scientific Ethics Committee of Renji Hospital, Shanghai Jiao Tong University School of Medicine (Approval Letter No. RA-2021-095), and all experimental protocols were carried out by following the guidelines of Measures for Ethical Review of Biomedical Research Involving Humans. Consent letters have been signed by the research participants or their relatives.
作者贡献声明
陈溯源、张志刚参与了实验设计,陈溯源、木司塔巴·木台力甫完成了实验操作,陈溯源、李冬雪、张志刚参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by CHEN Suyuan and ZHANG Zhigang. The experimental operation was completed by CHEN Suyuan and Musitaba Mutailifu. The manuscript was drafted and revised by CHEN Suyuan, LI Dongxue and ZHANG Zhigang. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献