听力障碍是最常见的致残性疾病之一。世界卫生组织发布的《2021年世界听力报告》预估,至2050年,将有近25亿人患有不同程度的听力损失。其中在所有的听力障碍性疾病中,感音神经性耳聋是最常见的感官和功能缺陷性疾病。其中噪声性耳聋最常见的非遗传性感音神经性耳聋,长时间或过度暴露在环境噪声中会导致听力丧失、耳鸣和听觉过敏[1]。
而位于脑干的耳蜗核(cochlear nucleus,CN)是听神经上行直接支配的核团,是听觉信息上传中枢的第一站。耳蜗核可以根据解剖分为腹侧核和背侧核。其中腹侧核的主要细胞是丛细胞(bushy cell,BC),听神经纤维通过巨大的突触末端(endbulb of held,EH)与BC形成连接,这种特化的突触结构容易受到各种损伤因素影响[2]。既往研究发现,噪声暴露导致腹侧耳蜗核(ventral cochlear nucleus,VCN)的听神经突触丢失,表现为耳蜗核标记囊泡谷氨酸转运蛋白1(vesicular glutamate transporter 1,Vglut1)减少[3-5],并可一直延续到噪声暴露后9个月[6-7]。此外,噪声损伤后的突触结构会发生一定程度的重塑[8-9],但是目前关于EH损伤以及突触可塑性的研究相对匮乏,且机制不明。因此,研究噪声损伤后耳蜗核听觉突触的损伤与修复机制,对于指导耳聋预防及治疗均具有重要意义。而我们前期研究发现,噪声暴露会导致Vglut1标记的突触结构丢失,这种损伤在噪声暴露后第1日即出现,直到第30日Vglut1标记的突触结构有部分的再生,提示耳蜗核突触具可塑性。
此外,星形胶质细胞是中枢神经系统中一类功能重要的胶质细胞。它为神经元提供营养支持、促进突触的形成和功能成熟以及参与血脑屏障形成等。星形胶质细胞与神经突触的关系十分密切,突触周围星形胶质细胞与神经元突触前、突触后结构形成了一种特殊的结构,称作“三方突触(tripartite synapse)”,这是其相互作用的结构基础[10]。突触周围星形胶质细胞在发育过程中协助突触形成[11],参与突触功能调控[12]以及分泌血小板素蛋白(thrombospondin,TSP)家族[13]和分泌性富含半胱氨酸的酸性蛋白(secreted protein acidic and rich in cysteine,SPARC)家族蛋白,参与突触重塑与再生[14-16]。尽管星形胶质细胞与神经突触的密切联系已经在中枢神经系统中有了较为广泛的验证,而在耳蜗核中星形胶质细胞功能研究匮乏,其是否参与到耳蜗核损伤后的突触修复过程目前不得而知。而我们前期实验发现,噪声暴露后耳蜗核星形胶质细胞浸润并明显活化,粗大的突起围绕突触伸长。因此,揭示星形胶质细胞参与耳蜗核听觉突触的相关修复作用及其分子靶点,将为耳聋的预防与治疗提供一个全新的思路。
1 对象与方法
1.1 实验动物
1月龄雄性C57BL/6J小鼠均购自南京集萃药康生物科技股份有限公司。小鼠随机分成2组,分别为噪声暴露组和对照组。噪声暴露组小鼠进行2 h、110 dB声压级(sound pressure level,SPL)、2~20 kHz的宽带噪声暴露。对照组小鼠不做任何处理。
1.2 主要试剂及仪器
豚鼠源Vglut1抗体(Synaptic system,德国),兔源钙结合蛋白2(calretinin,Calb2)抗体、兔源胶质酸性纤维蛋白(glial fibrillary acidic protein,GFAP)抗体、辣根过氧化物酶(peroxidase horseradish,HRP)标记抗兔免疫球蛋白G(immunoglobulin G,IgG)、HRP标记抗鼠IgG、兔源β-actin抗体(Abcam,英国),兔源肌腱膜纤维肉瘤基因B型(v-maf musculoaponeurotic fibrosarcoma oncogene family protein B,Mafb)抗体(Millipore,美国),兔源神经丝蛋白重链(neurofilament-heavy,NF-H)抗体、兔源神经丝蛋白中链(neurofilament-middle,NF-M)抗体、兔源神经丝蛋白轻链(neurofilament-light,NF-L)抗体(Proteintech,美国),二抗山羊抗兔488 IgG、二抗山羊抗鼠555 IgG1抗体、二抗山羊抗鼠647抗体IgG2a、二抗山羊抗豚鼠647抗体IgG2a、含4', 6'-二脒基-2-苯基吲哚(4',6'-diamidino-2-phenylindole,DAPI)封片剂、蛋白酶及磷酸酶抑制剂(Invitrogen,美国)。
XR凝胶成像分析系统(Bio-Rad,美国),5425 R小型台式冷冻离心机(Eppendorf,德国),RZ6听觉电生理工作站、TDT ES1静电宽频扬声器(Tucker-Davis Technologies TDT,美国),Zeiss LSM 880激光共聚集显微镜(卡尔蔡司,德国),Amersham Imager 600化学发光成像仪(通用医疗,英国),TCS SP8激光共聚焦显微镜、CM1520冰冻切片机(莱卡,德国)。
1.3 研究方法
1.3.1 噪声性耳聋小鼠模型构建
事先准备好暴露用铁笼,半径约10 cm,高约12 cm,其内有8个铁丝网隔间。而后,将4只小鼠间隔至于铁笼隔间内。校准:将校准探头放置于铁笼位置,扬声器放置于铁笼正上方约20 cm处,连接喇叭和RZ6听觉电生理工作站系统,调整输出电压为0.85 mV,使探测器检测到噪声强度为110 dB SPL。将小鼠置于安静环境2 h后,转移至铁笼隔间内,连接好扬声器后,进行噪声干预,强度为110 dB SPL,频率为2~20 kHz,暴露时间设置为2 h。在噪声暴露后第1、7、14、30日对小鼠进行听性脑干反应(auditory brainstem response,ABR)检测,选取16 kHz ABR阈值提高40 dB以上小鼠用于后续实验。
1.3.2 小鼠听性脑干反应检测
应用RZ6听觉电生理工作站系统分别对噪声暴露组和对照组小鼠进行ABR测试。通过赛拉嗪(ω=20 mg/kg)和氯胺酮(ω=100 mg/kg)混合腹腔注射对小鼠进行麻醉。将小鼠放置在预热的恒温电热毯上,温度监测探头放置在小鼠腹部底下,使其体温维持在37 ℃。在开放场的模式下开始ABR检测实验,将喇叭放置于小鼠头颅正前方距离双侧耳朵连线中点10 cm处。将3种电极放置于小鼠皮下,包括颅骨顶部正中(记录电极)、左侧的乳突部(参考电极)、右侧的乳突部(接地电极)。连接好电极后,检查各电极间的电阻是否均≤10 Ω;≤10 Ω说明电极摆放合适,能够开始ABR检测。给予小鼠短纯音刺激,刺激频率为4.0、5.6、8.0、11.3、16.0、22.6和32.0 kHz,以及Click刺激,刺激声以5 dB步长从90 dB SPL降至0 dB SPL,以可引起任何明显ABR反应的最小刺激强度作为听力阈值。每只小鼠预计记录30 min,后置于37 ℃恒温垫复苏。
1.3.3 小鼠耳蜗核免疫荧光染色
用赛拉嗪(ω=20 mg/kg)和氯胺酮 (ω=100 mg/kg)混合腹腔注射至小鼠深度麻醉后,用10 mL冰冷的磷酸盐缓冲盐(phosphate buffered saline,PBS)和10 mL冰冷的4%多聚甲醛进行心脏灌流。显微镜下解剖出耳蜗核,在4 ℃下用甲醛固定1 h。随后,标本在PBS中洗涤30 min,在4 ℃下用30%蔗糖脱水2 h。将耳蜗核置最佳切割温度复合物(optimal cutting temperature compound,OCT) 包埋剂中,使用CM1520冰冻切片机制备20 μm厚的切片。然后,在室温下使用1% Triton X-100和5% BSA溶液通透并封闭非特异性结合蛋白60 min,然后用稀释液(1%牛血清白蛋白(BSA)、0.3% Triton X-100)稀释一抗,稀释后的一抗在4 ℃孵育过夜。将切片用PBS清洗3次,每次10 min,用稀释液稀释二抗后,室温避光孵育1 h,再清洗切片3次,每次10 min,洗去游离二抗。最后,使用含DAPI封片液在每张玻片上室温下处理10 min。然后,用显微镜盖玻片覆盖切片。利用TCS SP8激光共聚焦显微镜获得共聚焦图像。
1.3.4 小鼠耳蜗核蛋白质印迹实验
用赛拉嗪(ω=20 mg/kg)和氯胺酮(ω=100 mg/kg)混合腹腔注射至小鼠深度麻醉后,立即在冰冷的PBS中解剖出耳蜗核。每个样品收集4~6个耳蜗核并混合,在含有蛋白酶抑制剂和磷酸酶抑制剂的放射免疫沉淀法(radio immuno precipitation assay,RIPA)裂解液中裂解。然后,样品以13 000×g的速度在4 ℃下离心20 min。收集上清液,并使用BCA(bicinchoninic acid)蛋白质定量试剂盒确定总蛋白质浓度。相等量的总蛋白质被加载到8%的Bis-tris凝胶中。在80 V的电泳条件下电泳90 min后,蛋白质以400 mA的电流转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,转膜时间为35 min。在室温下,使用5% BSA封闭1 h,用稀释液(1% BSA)稀释一抗,并在4 ℃过夜孵育。然后,用TBST缓冲液清洗10 min,3次,后膜与HRP偶联的二级抗体在室温下孵育1 h,并重复洗涤步骤。最后,使用Amersham Imager 600化学发光成像仪进行增强型化学发光实验,可视化蛋白质条带。使用ImageJ软件计算目标蛋白质的相对密度。
1.4 统计学分析
使用GraphPad Prism 9.0软件对数据进行分析。定量资料用
2 结果
2.1 噪声性聋模型建立
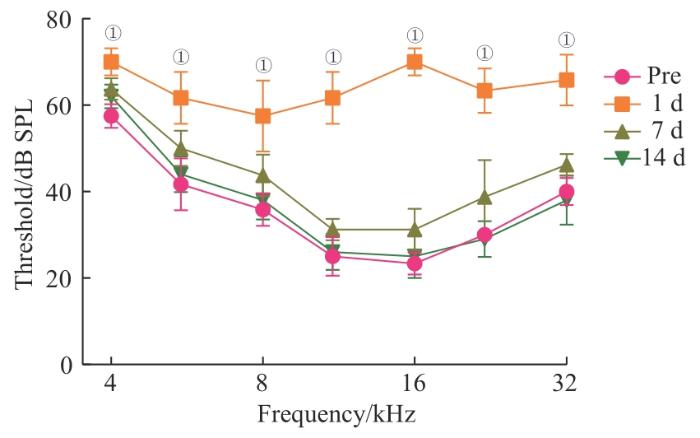
ABR结果提示(图1),相较噪声暴露前,噪声暴露后第1日小鼠听觉阈值在4.0、5.6、8.0、11.0、16.0、22.0、32.0 kHz显著提升(均P=0.000,nmice=6),而噪声暴露后第7、14日听觉阈值逐渐恢复至暴露前水平(均P>0.05,nmice=6)。该结果提示:该强度噪声造成了小鼠听觉出现暂时性阈值上升(temporal threshold shit,TTS),提示噪声性耳聋小鼠造模成功。
图1
图1
噪声性损伤小鼠模型建立
Note: Comparison of mouse auditory brainstem response (ABR) thresholds after noise exposure. ①P=0.000, compared with the Pre (control) group.
Fig 1
Establishment of a noise-induced hearing loss mouse model
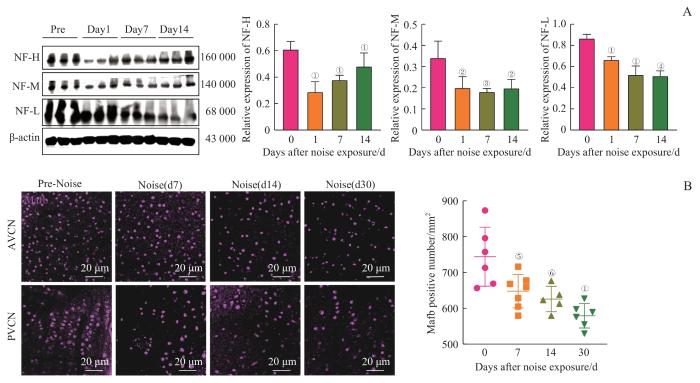
2.2 噪声暴露导致耳蜗核神经元变性丢失
图2
图2
噪声暴露导致耳蜗核神经元变性丢失
Note: A. Western blotting and grayscale analysis of cochlear nucleus in mice after noise exposure, showing significant downregulation of neurofilament-associated proteins, indicating neuronal degeneration. B. Immunofluorescence staining (MafB) of bushy cells in mice after noise exposure and corresponding statistical analysis. ①P=0.000, ②P=0.004, ③P=0.001, ④P=0.016, ⑤P=0.013, ⑥P=0.005, compared with the D0 (control) group.
Fig 2
Noise exposure leads to degeneration and loss of cochlear nucleus neurons
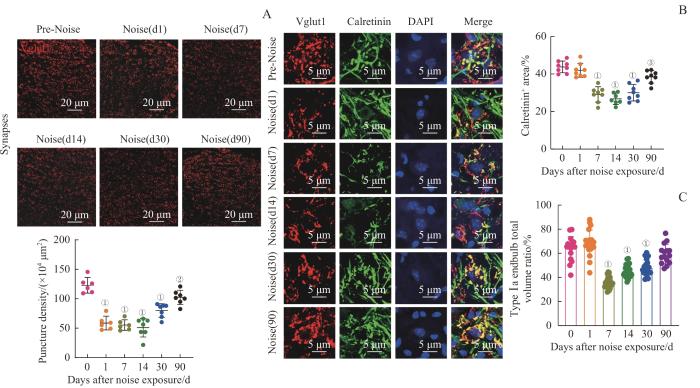
2.3 噪声暴露导致耳蜗核丛细胞听觉突触丢失
听神经纤维与位于耳蜗核腹侧核的丛细胞形成特化巨大的EH,从而保证声音信号的高保真传递。因此,我们通过免疫荧光实验观察噪声暴露对于耳蜗核EH突触的损伤情况,发现噪声暴露导致Vglut1标记的耳蜗核丛细胞听觉突触明显丢失,而这种突触损伤,在噪声暴露后第1日即十分明显(nmice=6,均P<0.05,图3A)。然而,Calb2标记的Ⅰa型听神经纤维也表现出延迟噪声暴露后损伤,即噪声暴露后7 d才出现明显的丢失,这提示Ⅰb、Ⅰc型听神经纤维可能在噪声暴露后损伤发生较早,而Ⅰa型听神经纤维损伤发生较晚(nmice=6,第1日P=0.775,第7、14、30、90日均P<0.05,图3B)。此外,Ⅰa型听神经纤维也表现出一定的修复。高分辨率(×63)共聚焦成像也可以观察到,丛细胞周围听觉突触在噪声暴露后7 d丢失明显,在90 d明显恢复。结果提示,噪声暴露会导致耳蜗核丛细胞听觉突触损伤明显,且突触丢失呈现一定的可塑性,在暴露后第90日逐渐恢复(图3C)。
图3
图3
噪声暴露导致耳蜗核丛细胞听觉突触丢失
Note:A. Immunofluorescence staining (Vglut1) of cochlear nucleus auditory nerve synapses after noise exposure. B. Immunofluorescence staining (×63) of cochlear nucleus auditory nerve synapses after noise exposure, showing auditory nerve synapses (Vglut1), Ⅰa-type auditory nerve (Calretinin), and cell nuclei (DAPI). C. Statistical analysis of the proportion of Ⅰa-type auditory nerve synapses after noise exposure. ①P=0.000, ②P=0.023, ③P=0.024, compared with the D0 (control) group.
Fig 3
Noise exposure leads to the loss of auditory synapses in the cochlear nucleus bushy cells
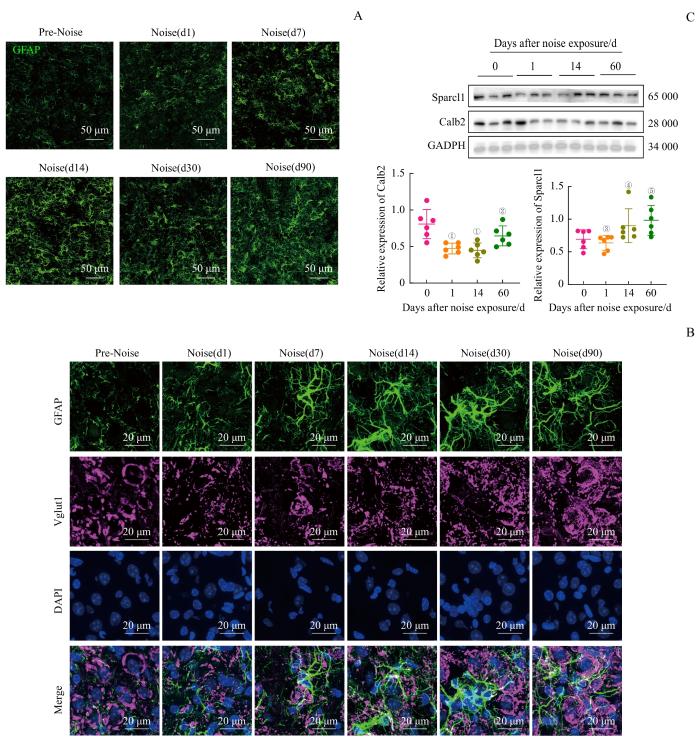
2.4 噪声暴露导致耳蜗核星形胶质细胞激活
星形胶质细胞参与兴奋性突触的组装与成熟[11],并在突触功能调控中发挥重要作用[12]。因此,探究星形胶质细胞参与耳蜗核突触损伤修复相关机制具有重要意义。通过GFAP标记耳蜗核星形胶质细胞,提示噪声暴露前,星形胶质细胞密度相对稀疏,分布在耳蜗核周围、颗粒细胞区和听觉神经根周围,突起较少。而噪声暴露后第7日,星形胶质细胞明显活化,细胞数目和突起增多明显(图4A)。此外,激活的星形胶质细胞多围绕Vglut1阳性的突触长出巨大的突起(图4B)。而SPARC样蛋白1(SPARC-like protein 1,Sparcl1)是星形胶质细胞分泌,用于兴奋性突触组装和成熟的关键蛋白[17]。Western blotting结果提示:噪声暴露后,耳蜗核Calb2蛋白表达在噪声暴露后第1、14日明显下调(nmice=6,均P=0.001);而Sparcl1蛋白在第14日(nmice=6,P=0.019)和第60日(nmice=6,P=0.048)明显上调(图4C)。
图4
图4
噪声暴露导致耳蜗核星形胶质细胞激活
Note: A. Immunofluorescence staining (GFAP) of cochlear nucleus astrocytes after noise exposure. B. Immunofluorescence staining (×63) of cochlear nucleus auditory nerve synapses and astrocytes after noise exposure, showing auditory nerve synapses (Vglut1), astrocytes (GFAP), and cell nuclei (DAPI). C. Western blotting results of cochlear nucleus after noise exposure. ①P=0.001, ②P=0.130, ③P=0.929, ④P=0.019, ⑤P=0.048, compared with the D0 (control) group.
Fig 4
Noise exposure leads to the activation of cochlear nucleus astrocytes
3 讨论
本研究发现:①给予小鼠110 dB SPL、持续时间2 h噪声暴露后,小鼠ABR听觉阈值出现暂时性上升。②噪声暴露导致腹侧耳蜗核神经元丢失(MafB阳性)。Western blotting结果提示神经纤维相关蛋白(如NF-H、NF-M、NF-L)表达下调,提示噪声暴露造成耳蜗核神经元变性。③噪声暴露导致EH结构破坏。免疫荧光结果发现Vglut1、Calb2标记的突触结构破坏减少,提示噪声暴露对于听神经突触造成了损伤。④噪声暴露还激活了星形胶质细胞。免疫荧光实验发现,通过GFAP成功标记星形胶质细胞,并且发现星形胶质细胞在噪声暴露后大量聚集在耳蜗核腹侧核,并且具备活化形态,如围绕突触的巨大突起等。结合听神经突触在噪声暴露后60 d开始逐渐恢复,以及星形胶质细胞持续活化,提示星形胶质细胞可能参与到突触重塑与神经可塑性过程。
内毛细胞(inner hair cell,IHC)和外毛细胞(outer hair cell,OHC)都由螺旋神经节神经元(spiral ganglion neuron,SGN)支配。其中Ⅰ型SGN纤维支配IHC,而Ⅱ型SGN支配OHC,其中Ⅰ型SGN将声音信息传输到中枢神经系统,而Ⅱ型SGN主要负责损伤感知与疼痛信号传递[18]。SUN等[19]通过单细胞测序技术,发现Ⅰ型SGN可分为Ⅰa、Ⅰb、Ⅰc亚型,且Calb2、Calb1、POU结构域4类转录因子1(POU domain class 5 transcription factor 1,Pou4f1)可分别对亚型进行标记,且这3类亚型的Ⅰ型SGN纤维对于损伤易感性均存在差异。一项针对衰老小鼠耳蜗核的研究[20]发现,Ⅰa亚型SGN纤维损伤发生较晚,Ⅰb/Ⅰc亚型则损伤发生较早。同样,本研究发现这种亚型特异性的损伤也存在于噪声暴露模型。噪声暴露后小鼠耳蜗核Calb2阳性突触丢失表现出滞后性,即直到损伤后第7日才出现明显丢失,这提示Ⅰb/Ⅰc纤维在噪声损伤早期即发生损伤。
星形胶质细胞在神经系统中具有重要的功能,包括神经元营养、血脑屏障形成以及突触功能调控等,其中星形胶质细胞与突触联系尤为紧密[21]。星形胶质细胞与突触前后结构锚定形成三方突触结构,通过分泌TSP以及Hevin(又称Sparcl1)蛋白来促进兴奋性突触组装与成熟[17,22]。此外,星形胶质细胞在听觉神经系统发育和突触形成中也有重要作用。以往针对耳蜗核发育的研究[23]发现,星形胶质细胞在耳蜗核腹侧核富集明显,其中损伤后第14日(postnatal day 14,P14)的富集最为明显(P14时,小鼠耳道开放,是听觉形成关键时期)。星形胶质细胞还能够在体外介导螺旋神经节与耳蜗核神经元体外形成突触连接。
而先前对于耳蜗核损伤后星形胶质细胞的相关研究相对匮乏。本研究发现,噪声暴露后星形胶质细胞富集于耳蜗核endbulb突触结构周围,而富集的星形胶质细胞究竟是来源于有丝分裂增殖(proliferation),还是仅仅只是活化(reactivation),这是一个值得探究的研究方向。此外,一项针对星形胶质细胞转录组的研究[24]发现,星形胶质细胞在分子水平可分为A1和A2型。其中,A1型高表达炎症相关基因,参与突触破坏和神经系统炎症;而A2型高表达神经营养因子相关基因,参与神经突触可塑性以及神经元支持。本研究通过Western blotting实验证实,星形胶质细胞分泌的成突触蛋白Sparcl1在噪声暴露后的耳蜗核明显上调,提示耳蜗核噪声暴露后富集的星形胶质细胞可能归属A2型,即可能参与耳蜗核突触的重塑与修复过程。但是,其是否还存在其他分子细胞机制参与突触重塑目前还尚不明确,故未来将结合RNA-Seq、ATAC-seq等技术筛选可能的分子靶点,为治疗噪声及其他类型的听觉神经系统损伤以及寻找神经突触再生可能靶点奠定基础。
作者贡献声明
刘辉辉、汪照炎、王美建参与了课题指导,周卫军、刘宏超、蔡瑞捷参与了实验设计与实验操作;周卫军、刘思迪参与了数据整理、论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
LIU Huihui, WANG Zhaoyan and WANG Meijian participated in project guidance. ZHOU Weijun, LIU Hongchao, and CAI Ruijie participated in experimental design and operation. ZHOU Weijun and LIU Sidi participated in data collation, paper writing, and revision. All authors have read the final manuscript and agreed to the submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献