[1]
CHOOI Y C, DING C, MAGKOS F. The epidemiology of obesity[J]. Metabolism, 2019, 92: 6-10.
[本文引用: 1]
[2]
KOLIAKI C, DALAMAGA M, LIATIS S. Update on the obesity epidemic: after the sudden rise, is the upward trajectory beginning to flatten?[J]. Curr Obes Rep, 2023, 12(4): 514-527.
[本文引用: 1]
[3]
CHEN K, SHEN Z W, GU W J, et al. Prevalence of obesity and associated complications in China: a cross-sectional, real-world study in 15.8 million adults[J]. Diabetes Obes Metab, 2023, 25(11): 3390-3399.
[本文引用: 1]
[4]
CONGDON P, AMUGSI D. Editorial: the obesity epidemic: causes, context, prevention[J]. Front Public Health, 2022, 10: 1030180.
[本文引用: 2]
[5]
ROH E, CHOI K M. Hormonal gut-brain signaling for the treatment of obesity[J]. Int J Mol Sci, 2023, 24(4): 3384.
[本文引用: 1]
[6]
TARRAGON E, MORENO J J. Role of endocannabinoids on sweet taste perception, food preference, and obesity-related disorders[J]. Chem Senses, 2017, 43(1): 3-16.
[本文引用: 1]
[7]
OUSTRIC P, THIVEL D, DALTON M, et al. Measuring food preference and reward: application and cross-cultural adaptation of the Leeds Food Preference Questionnaire in human experimental research[J]. Food Qual Prefer, 2020, 80: 103824.
[本文引用: 1]
[8]
DE BRUIJN S E M, DE VRIES Y C, DE GRAAF C, et al. The reliability and validity of the Macronutrient and Taste Preference Ranking Task: a new method to measure food preferences[J]. Food Qual Prefer, 2017, 57: 32-40.
[本文引用: 1]
[9]
EDWIN THANARAJAH S, DIFELICEANTONIO A G, ALBUS K, et al. Habitual daily intake of a sweet and fatty snack modulates reward processing in humans[J]. Cell Metab, 2023, 35(4): 571-584.e6.
[本文引用: 1]
[10]
VAN GALEN K A, SCHRANTEE A, TER HORST K W, et al. Brain responses to nutrients are severely impaired and not reversed by weight loss in humans with obesity: a randomized crossover study[J]. Nat Metab, 2023, 5(6): 1059-1072.
[本文引用: 1]
[11]
LI M T, TAN H E, LU Z Y, et al. Gut-brain circuits for fat preference[J]. Nature, 2022, 610(7933): 722-730.
[本文引用: 5]
[12]
TAN H E, SISTI A C, JIN H, et al. The gut-brain axis mediates sugar preference[J]. Nature, 2020, 580(7804): 511-516.
[本文引用: 4]
[13]
ELIAN V, POPOVICI V, KARAMPELAS O, et al. Risks and benefits of SGLT-2 inhibitors for type 1 diabetes patients using automated insulin delivery systems: a literature review[J]. Int J Mol Sci, 2024, 25(4): 1972.
[本文引用: 1]
[14]
KAELBERER M M, BUCHANAN K L, KLEIN M E, et al. A gut-brain neural circuit for nutrient sensory transduction[J]. Science, 2018, 361(6408): eaat5236.
[本文引用: 3]
[15]
JAIME-LARA R B, BROOKS B E, VIZIOLI C, et al. A systematic review of the biological mediators of fat taste and smell[J]. Physiol Rev, 2023, 103(1): 855-918.
[本文引用: 1]
[16]
SPANIER B, ROHM F. Proton coupled oligopeptide transporter 1 (PepT1) function, regulation, and influence on the intestinal homeostasis[J]. Compr Physiol, 2018, 8(2): 843-869.
[本文引用: 1]
[17]
QIAN L, LI N, LU X C, et al. Enhanced BCAT1 activity and BCAA metabolism promotes RhoC activity in cancer progression[J]. Nat Metab, 2023, 5(7): 1159-1173.
[本文引用: 1]
[18]
BERTHOUD H R, MORRISON C D, ACKROFF K, et al. Learning of food preferences: mechanisms and implications for obesity & metabolic diseases[J]. Int J Obes (Lond), 2021, 45(10): 2156-2168.
[本文引用: 2]
[19]
LIU W W, BOHÓRQUEZ D V. The neural basis of sugar preference[J]. Nat Rev Neurosci, 2022, 23(10): 584-595.
[本文引用: 1]
[20]
KHAN M S, SPANN R A, MÜNZBERG H, et al. Protein appetite at the interface between nutrient sensing and physiological homeostasis[J]. Nutrients, 2021, 13(11): 4103.
[本文引用: 1]
[21]
MÜNZBERG H, BERTHOUD H R, NEUHUBER W L. Sensory spinal interoceptive pathways and energy balance regulation[J]. Mol Metab, 2023, 78: 101817.
[本文引用: 1]
[22]
HUANG K P, GOODSON M L, VANG W, et al. Leptin signaling in vagal afferent neurons supports the absorption and storage of nutrients from high-fat diet[J]. Int J Obes (Lond), 2021, 45(2): 348-357.
[本文引用: 1]
[23]
WOODS C A, GUTTMAN Z R, HUANG D, et al. Insulin receptor activation in the nucleus accumbens reflects nutritive value of a recently ingested meal[J]. Physiol Behav, 2016, 159: 52-63.
[本文引用: 1]
[24]
GUZMÁN A, HERNÁNDEZ-CORONADO C G, ROSALES-TORRES A M, et al. Leptin regulates neuropeptides associated with food intake and GnRH secretion[J]. Ann Endocrinol, 2019, 80(1): 38-46.
[本文引用: 1]
[25]
JENSEN-CODY S O, FLIPPO K H, CLAFLIN K E, et al. FGF21 signals to glutamatergic neurons in the ventromedial hypothalamus to suppress carbohydrate intake[J]. Cell Metab, 2020, 32(2): 273-286.e6.
[本文引用: 1]
[26]
HILL C M, LAEGER T, DEHNER M, et al. FGF21 signals protein status to the brain and adaptively regulates food choice and metabolism[J]. Cell Rep, 2019, 27(10): 2934-2947.e3.
[本文引用: 1]
[27]
FLIPPO K H, JENSEN-CODY S O, CLAFLIN K E, et al. FGF21 signaling in glutamatergic neurons is required for weight loss associated with dietary protein dilution[J]. Sci Rep, 2020, 10(1): 19521.
[本文引用: 1]
[28]
YU K B, HSIAO E Y. Roles for the gut microbiota in regulating neuronal feeding circuits[J]. J Clin Invest, 2021, 131(10): e143772.
[本文引用: 1]
[29]
TREVELLINE B K, KOHL K D. The gut microbiome influences host diet selection behavior[J]. Proc Natl Acad Sci USA, 2022, 119(17): e2117537119.
[本文引用: 2]
[30]
YAO Z P, SCOTT K. Serotonergic neurons translate taste detection into internal nutrient regulation[J]. Neuron, 2022, 110(6): 1036-1050.e7.
[本文引用: 1]
[31]
DE WOUTERS D′OPLINTER A, RASTELLI M, VAN HUL M, et al. Gut microbes participate in food preference alterations during obesity[J]. Gut Microbes, 2021, 13(1): 1959242.
[本文引用: 2]
[32]
FAN S J, GUO W W, XIAO D, et al. Microbiota-gut-brain axis drives overeating disorders[J]. Cell Metab, 2023, 35(11): 2011-2027.e7.
[本文引用: 1]
[33]
WATTS A G, KANOSKI S E, SANCHEZ-WATTS G, et al. The physiological control of eating: signals, neurons, and networks[J]. Physiol Rev, 2022, 102(2): 689-813.
[本文引用: 1]
[34]
TELLEZ L A, HAN W F, ZHANG X B, et al. Separate circuitries encode the hedonic and nutritional values of sugar[J]. Nat Neurosci, 2016, 19(3): 465-470.
[本文引用: 1]
[35]
GEISLER C E, HAYES M R. Metabolic hormone action in the VTA: reward-directed behavior and mechanistic insights[J]. Physiol Behav, 2023, 268: 114236.
[本文引用: 1]
[36]
HAN W F, TELLEZ L A, PERKINS M H, et al. A neural circuit for gut-induced reward[J]. Cell, 2018, 175(3): 887-888.
[本文引用: 1]
[37]
FERNANDES A B, ALVES DA SILVA J, ALMEIDA J, et al. Postingestive modulation of food seeking depends on vagus-mediated dopamine neuron activity[J]. Neuron, 2020, 106(5): 778-788.e6.
[本文引用: 1]
[38]
BERRIOS J, LI C A, MADARA J C, et al. Food cue regulation of AGRP hunger neurons guides learning[J]. Nature, 2021, 595(7869): 695-700.
[本文引用: 1]
[39]
SAYAR-ATASOY N, YAVUZ Y, LAULE C, et al. Opioidergic signaling contributes to food-mediated suppression of AgRP neurons[J]. Cell Rep, 2024, 43(1): 113630.
[本文引用: 1]
[40]
NYEMA N T, MCKNIGHT A D, VARGAS-ELVIRA A G, et al. AgRP neuron activity promotes associations between sensory and nutritive signals to guide flavor preference[J]. Mol Metab, 2023, 78: 101833.
[本文引用: 1]
[41]
LIU H L, HE Y, BAI J L, et al. Hypothalamic Grb10 enhances leptin signalling and promotes weight loss[J]. Nat Metab, 2023, 5(1): 147-164.
[本文引用: 1]
[42]
BEAULIEU K, HOPKINS M, GIBBONS C, et al. Exercise training reduces reward for high-fat food in adults with overweight/obesity[J]. Med Sci Sports Exerc, 2020, 52(4): 900-908.
[本文引用: 1]
[43]
THACKRAY A E, HINTON E C, ALANAZI T M, et al. Exploring the acute effects of running on cerebral blood flow and food cue reactivity in healthy young men using functional magnetic resonance imaging[J]. Hum Brain Mapp, 2023, 44(9): 3815-3832.
[本文引用: 1]
[44]
ALABDULJABBAR K, AL-NAJIM W, LE ROUX C W. Food preferences after bariatric surgery: a review update[J]. Intern Emerg Med, 2023, 18(2): 351-358.
[本文引用: 1]
[45]
LI Y Q, PENG Y, SHEN Y B, et al. Dietary polyphenols: regulate the advanced glycation end products-RAGE axis and the microbiota-gut-brain axis to prevent neurodegenerative diseases[J]. Crit Rev Food Sci Nutr, 2023, 63(29): 9816-9842.
[本文引用: 2]
[46]
LI Y, QIN C, DONG L Z, et al. Whole grain benefit: synergistic effect of oat phenolic compounds and β-glucan on hyperlipidemia via gut microbiota in high-fat-diet mice[J]. Food Funct, 2022, 13(24): 12686-12696.
[47]
WENINGER S N, HERMAN C, MEYER R K, et al. Oligofructose improves small intestinal lipid-sensing mechanisms via alterations to the small intestinal microbiota[J]. Microbiome, 2023, 11(1): 169.
[本文引用: 1]
1
... 肥胖是一种由于体内脂肪过度堆积而导致的代谢性疾病,其与糖尿病、心血管疾病、高血压、血脂异常等多种疾病的发生风险密切相关[1 ] .在全球范围内,肥胖现象日益普遍,预计到2035年超重及肥胖人群的比例将超过半数[2 ] .研究显示我国的超重人群占比达34.8%、肥胖人群占比达14.1%[3 ] ,肥胖已成为影响国民健康的重大挑战.且现有研究表明,过量摄入高糖及高脂食物、缺乏运动(能量摄入超过能量消耗)是导致肥胖的主要原因[4 ] ;特别是随着现代食品工业的迅猛发展,高糖、高脂食品的消费模式也成为了加剧肥胖问题的重要因素[4 ] .因此,深入探讨影响高糖、高脂食物偏好的病理生理机制,对于预防和治疗肥胖以及促进健康饮食至关重要.本文主要针对食物偏好的概念、评估方式及机制研究,以及高糖和高脂食物信息通过肠-脑轴传递的机制、调控食物偏好的奖赏神经回路、食物偏好行为在肥胖治疗中的具体应用进行综述,以期为食物偏好领域的研究和肥胖治疗提供参考和提示. ...
1
... 肥胖是一种由于体内脂肪过度堆积而导致的代谢性疾病,其与糖尿病、心血管疾病、高血压、血脂异常等多种疾病的发生风险密切相关[1 ] .在全球范围内,肥胖现象日益普遍,预计到2035年超重及肥胖人群的比例将超过半数[2 ] .研究显示我国的超重人群占比达34.8%、肥胖人群占比达14.1%[3 ] ,肥胖已成为影响国民健康的重大挑战.且现有研究表明,过量摄入高糖及高脂食物、缺乏运动(能量摄入超过能量消耗)是导致肥胖的主要原因[4 ] ;特别是随着现代食品工业的迅猛发展,高糖、高脂食品的消费模式也成为了加剧肥胖问题的重要因素[4 ] .因此,深入探讨影响高糖、高脂食物偏好的病理生理机制,对于预防和治疗肥胖以及促进健康饮食至关重要.本文主要针对食物偏好的概念、评估方式及机制研究,以及高糖和高脂食物信息通过肠-脑轴传递的机制、调控食物偏好的奖赏神经回路、食物偏好行为在肥胖治疗中的具体应用进行综述,以期为食物偏好领域的研究和肥胖治疗提供参考和提示. ...
1
... 肥胖是一种由于体内脂肪过度堆积而导致的代谢性疾病,其与糖尿病、心血管疾病、高血压、血脂异常等多种疾病的发生风险密切相关[1 ] .在全球范围内,肥胖现象日益普遍,预计到2035年超重及肥胖人群的比例将超过半数[2 ] .研究显示我国的超重人群占比达34.8%、肥胖人群占比达14.1%[3 ] ,肥胖已成为影响国民健康的重大挑战.且现有研究表明,过量摄入高糖及高脂食物、缺乏运动(能量摄入超过能量消耗)是导致肥胖的主要原因[4 ] ;特别是随着现代食品工业的迅猛发展,高糖、高脂食品的消费模式也成为了加剧肥胖问题的重要因素[4 ] .因此,深入探讨影响高糖、高脂食物偏好的病理生理机制,对于预防和治疗肥胖以及促进健康饮食至关重要.本文主要针对食物偏好的概念、评估方式及机制研究,以及高糖和高脂食物信息通过肠-脑轴传递的机制、调控食物偏好的奖赏神经回路、食物偏好行为在肥胖治疗中的具体应用进行综述,以期为食物偏好领域的研究和肥胖治疗提供参考和提示. ...
2
... 肥胖是一种由于体内脂肪过度堆积而导致的代谢性疾病,其与糖尿病、心血管疾病、高血压、血脂异常等多种疾病的发生风险密切相关[1 ] .在全球范围内,肥胖现象日益普遍,预计到2035年超重及肥胖人群的比例将超过半数[2 ] .研究显示我国的超重人群占比达34.8%、肥胖人群占比达14.1%[3 ] ,肥胖已成为影响国民健康的重大挑战.且现有研究表明,过量摄入高糖及高脂食物、缺乏运动(能量摄入超过能量消耗)是导致肥胖的主要原因[4 ] ;特别是随着现代食品工业的迅猛发展,高糖、高脂食品的消费模式也成为了加剧肥胖问题的重要因素[4 ] .因此,深入探讨影响高糖、高脂食物偏好的病理生理机制,对于预防和治疗肥胖以及促进健康饮食至关重要.本文主要针对食物偏好的概念、评估方式及机制研究,以及高糖和高脂食物信息通过肠-脑轴传递的机制、调控食物偏好的奖赏神经回路、食物偏好行为在肥胖治疗中的具体应用进行综述,以期为食物偏好领域的研究和肥胖治疗提供参考和提示. ...
... [4 ].因此,深入探讨影响高糖、高脂食物偏好的病理生理机制,对于预防和治疗肥胖以及促进健康饮食至关重要.本文主要针对食物偏好的概念、评估方式及机制研究,以及高糖和高脂食物信息通过肠-脑轴传递的机制、调控食物偏好的奖赏神经回路、食物偏好行为在肥胖治疗中的具体应用进行综述,以期为食物偏好领域的研究和肥胖治疗提供参考和提示. ...
1
... 食物偏好,即个体对特定食物的喜好程度,其形成与食物在胃肠道消化后产生的饱腹感、满足感和奖赏感等生理效应密切相关[5 ] .美味的食物能刺激奖赏系统,促使大脑释放多巴胺等神经递质带来愉快的体验,进而增强对该类食物的偏好[6 ] . ...
1
... 食物偏好,即个体对特定食物的喜好程度,其形成与食物在胃肠道消化后产生的饱腹感、满足感和奖赏感等生理效应密切相关[5 ] .美味的食物能刺激奖赏系统,促使大脑释放多巴胺等神经递质带来愉快的体验,进而增强对该类食物的偏好[6 ] . ...
1
... 在临床研究与动物实验中,相关人员已采用了多种方法对食物偏好行为进行评估,并对其背后的机制进行深入探索.临床研究中,问卷调查是评估个体食物偏好特征的最为便捷的方式.如Leeds食物偏好问卷通过要求参与者在甜味、咸味、低脂、高脂这4种食物类别中进行选择,来衡量个体对食物的显性喜好和隐性渴望[7 ] ;宏量营养素和口味偏好排序任务通过要求参与者对不同口味和营养成分类别的食物图片进行排序,检验不同因素对个体食物偏好变化的影响[8 ] .同时,这些问卷的调查结果也为理解食物偏好提供了行为层面的数据.为进一步了解这些偏好背后的深层机制,研究人员通过结合神经影像学技术对个体在食物刺激下的激活脑区、食物偏好的神经调控网络进行探索[9 ] .VAN GALEN等[10 ] 向受试者胃内输注葡萄糖溶液后,借助功能磁共振技术对受试者的脑区激活情况进行分析,结果发现肥胖受试者在纹状体、额叶、岛叶等脑区的神经活动信号比正常体质量受试者更高,提示肥胖受试者的食物偏好调控网络存在损伤.动物实验中,由于无法进行问卷填写,双瓶偏好实验成为评估其食物偏好的主要方法;该实验提供2个装有不同食物或溶液的瓶子,允许动物自由选择,通过记录动物的食物或溶液摄入量和舔舐次数来计算其偏好指数,以评估动物对特定食物的偏好特征[11 ] .而后,有研究人员在双瓶偏好实验基础上,通过操控特定基因的表达或阻断特定的信号通路来观察并验证神经递质、受体及下游信号分子在食物偏好形成与改变过程中的具体作用,从而构建出更加全面、细致的食物偏好行为调控网络[12 ] .这一结果有助于识别调节食物偏好的关键分子,并为肥胖潜在的干预策略提供一定的理论基础. ...
1
... 在临床研究与动物实验中,相关人员已采用了多种方法对食物偏好行为进行评估,并对其背后的机制进行深入探索.临床研究中,问卷调查是评估个体食物偏好特征的最为便捷的方式.如Leeds食物偏好问卷通过要求参与者在甜味、咸味、低脂、高脂这4种食物类别中进行选择,来衡量个体对食物的显性喜好和隐性渴望[7 ] ;宏量营养素和口味偏好排序任务通过要求参与者对不同口味和营养成分类别的食物图片进行排序,检验不同因素对个体食物偏好变化的影响[8 ] .同时,这些问卷的调查结果也为理解食物偏好提供了行为层面的数据.为进一步了解这些偏好背后的深层机制,研究人员通过结合神经影像学技术对个体在食物刺激下的激活脑区、食物偏好的神经调控网络进行探索[9 ] .VAN GALEN等[10 ] 向受试者胃内输注葡萄糖溶液后,借助功能磁共振技术对受试者的脑区激活情况进行分析,结果发现肥胖受试者在纹状体、额叶、岛叶等脑区的神经活动信号比正常体质量受试者更高,提示肥胖受试者的食物偏好调控网络存在损伤.动物实验中,由于无法进行问卷填写,双瓶偏好实验成为评估其食物偏好的主要方法;该实验提供2个装有不同食物或溶液的瓶子,允许动物自由选择,通过记录动物的食物或溶液摄入量和舔舐次数来计算其偏好指数,以评估动物对特定食物的偏好特征[11 ] .而后,有研究人员在双瓶偏好实验基础上,通过操控特定基因的表达或阻断特定的信号通路来观察并验证神经递质、受体及下游信号分子在食物偏好形成与改变过程中的具体作用,从而构建出更加全面、细致的食物偏好行为调控网络[12 ] .这一结果有助于识别调节食物偏好的关键分子,并为肥胖潜在的干预策略提供一定的理论基础. ...
1
... 在临床研究与动物实验中,相关人员已采用了多种方法对食物偏好行为进行评估,并对其背后的机制进行深入探索.临床研究中,问卷调查是评估个体食物偏好特征的最为便捷的方式.如Leeds食物偏好问卷通过要求参与者在甜味、咸味、低脂、高脂这4种食物类别中进行选择,来衡量个体对食物的显性喜好和隐性渴望[7 ] ;宏量营养素和口味偏好排序任务通过要求参与者对不同口味和营养成分类别的食物图片进行排序,检验不同因素对个体食物偏好变化的影响[8 ] .同时,这些问卷的调查结果也为理解食物偏好提供了行为层面的数据.为进一步了解这些偏好背后的深层机制,研究人员通过结合神经影像学技术对个体在食物刺激下的激活脑区、食物偏好的神经调控网络进行探索[9 ] .VAN GALEN等[10 ] 向受试者胃内输注葡萄糖溶液后,借助功能磁共振技术对受试者的脑区激活情况进行分析,结果发现肥胖受试者在纹状体、额叶、岛叶等脑区的神经活动信号比正常体质量受试者更高,提示肥胖受试者的食物偏好调控网络存在损伤.动物实验中,由于无法进行问卷填写,双瓶偏好实验成为评估其食物偏好的主要方法;该实验提供2个装有不同食物或溶液的瓶子,允许动物自由选择,通过记录动物的食物或溶液摄入量和舔舐次数来计算其偏好指数,以评估动物对特定食物的偏好特征[11 ] .而后,有研究人员在双瓶偏好实验基础上,通过操控特定基因的表达或阻断特定的信号通路来观察并验证神经递质、受体及下游信号分子在食物偏好形成与改变过程中的具体作用,从而构建出更加全面、细致的食物偏好行为调控网络[12 ] .这一结果有助于识别调节食物偏好的关键分子,并为肥胖潜在的干预策略提供一定的理论基础. ...
1
... 在临床研究与动物实验中,相关人员已采用了多种方法对食物偏好行为进行评估,并对其背后的机制进行深入探索.临床研究中,问卷调查是评估个体食物偏好特征的最为便捷的方式.如Leeds食物偏好问卷通过要求参与者在甜味、咸味、低脂、高脂这4种食物类别中进行选择,来衡量个体对食物的显性喜好和隐性渴望[7 ] ;宏量营养素和口味偏好排序任务通过要求参与者对不同口味和营养成分类别的食物图片进行排序,检验不同因素对个体食物偏好变化的影响[8 ] .同时,这些问卷的调查结果也为理解食物偏好提供了行为层面的数据.为进一步了解这些偏好背后的深层机制,研究人员通过结合神经影像学技术对个体在食物刺激下的激活脑区、食物偏好的神经调控网络进行探索[9 ] .VAN GALEN等[10 ] 向受试者胃内输注葡萄糖溶液后,借助功能磁共振技术对受试者的脑区激活情况进行分析,结果发现肥胖受试者在纹状体、额叶、岛叶等脑区的神经活动信号比正常体质量受试者更高,提示肥胖受试者的食物偏好调控网络存在损伤.动物实验中,由于无法进行问卷填写,双瓶偏好实验成为评估其食物偏好的主要方法;该实验提供2个装有不同食物或溶液的瓶子,允许动物自由选择,通过记录动物的食物或溶液摄入量和舔舐次数来计算其偏好指数,以评估动物对特定食物的偏好特征[11 ] .而后,有研究人员在双瓶偏好实验基础上,通过操控特定基因的表达或阻断特定的信号通路来观察并验证神经递质、受体及下游信号分子在食物偏好形成与改变过程中的具体作用,从而构建出更加全面、细致的食物偏好行为调控网络[12 ] .这一结果有助于识别调节食物偏好的关键分子,并为肥胖潜在的干预策略提供一定的理论基础. ...
5
... 在临床研究与动物实验中,相关人员已采用了多种方法对食物偏好行为进行评估,并对其背后的机制进行深入探索.临床研究中,问卷调查是评估个体食物偏好特征的最为便捷的方式.如Leeds食物偏好问卷通过要求参与者在甜味、咸味、低脂、高脂这4种食物类别中进行选择,来衡量个体对食物的显性喜好和隐性渴望[7 ] ;宏量营养素和口味偏好排序任务通过要求参与者对不同口味和营养成分类别的食物图片进行排序,检验不同因素对个体食物偏好变化的影响[8 ] .同时,这些问卷的调查结果也为理解食物偏好提供了行为层面的数据.为进一步了解这些偏好背后的深层机制,研究人员通过结合神经影像学技术对个体在食物刺激下的激活脑区、食物偏好的神经调控网络进行探索[9 ] .VAN GALEN等[10 ] 向受试者胃内输注葡萄糖溶液后,借助功能磁共振技术对受试者的脑区激活情况进行分析,结果发现肥胖受试者在纹状体、额叶、岛叶等脑区的神经活动信号比正常体质量受试者更高,提示肥胖受试者的食物偏好调控网络存在损伤.动物实验中,由于无法进行问卷填写,双瓶偏好实验成为评估其食物偏好的主要方法;该实验提供2个装有不同食物或溶液的瓶子,允许动物自由选择,通过记录动物的食物或溶液摄入量和舔舐次数来计算其偏好指数,以评估动物对特定食物的偏好特征[11 ] .而后,有研究人员在双瓶偏好实验基础上,通过操控特定基因的表达或阻断特定的信号通路来观察并验证神经递质、受体及下游信号分子在食物偏好形成与改变过程中的具体作用,从而构建出更加全面、细致的食物偏好行为调控网络[12 ] .这一结果有助于识别调节食物偏好的关键分子,并为肥胖潜在的干预策略提供一定的理论基础. ...
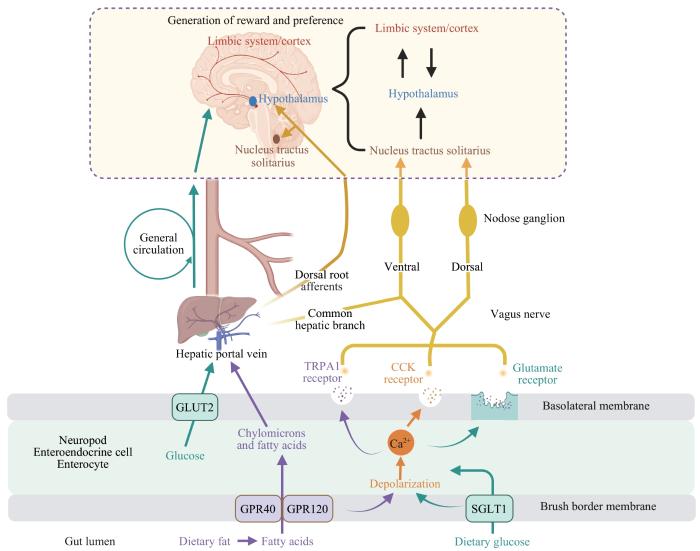
... 在肠道中,食物中的糖类可被胰液、胆汁酸和微生物分解成单糖,这一过程涉及化学信号的释放.具体来说,葡萄糖和半乳糖通过钠-葡萄糖共转运蛋白1(sodium glucose cotransporter 1,SGLT1)进入肠细胞刷状缘,并依赖葡萄糖转运蛋白2在基底膜完成跨膜转运,进入血液循环[13 ] .值得注意的是,葡萄糖在胃肠道内消化吸收的过程中除了会释放化学信号外还能释放电信号.表达SGLT1的神经足细胞在检测到葡萄糖信号后会释放谷氨酸作为神经递质,该神经递质能通过突触间隙作用于迷走传入神经的末梢以激活这些神经纤维[14 ] .此外,作为调节因子,肠道内分泌细胞释放的胆囊收缩素(cholecystokinin,CCK)也能作用于迷走传入神经,参与对糖类偏好的调控[11 ] . ...
... 在肠道中脂肪会被消化成脂肪酸,并通过多种肠道脂肪酸传感器如G蛋白偶联受体40(G protein-coupled receptor 40,GPR40)、GPR120、分化簇36等进入血液循环[15 ] ;其中GPR40和GPR120在脂肪偏好的信号传递中发挥了关键作用,有研究[11 ] 发现Gpr40/Gpr120 双基因敲除的小鼠无法传递脂肪信号.此外,脂肪酸还能刺激肠道内分泌细胞并增加胞内的钙离子浓度,这使得钙离子发生内流并触发了电生理活动,进而激活迷走传入神经亚群.与此同时,这些被激活的亚群可通过神经-内分泌途径调控机体对脂肪的偏好. ...
... 研究[14 ] 发现,体外培养的肠道内分泌细胞可直接与迷走传入神经形成突触,并以谷氨酸为神经递质将肠腔内的食物信息快速传递给大脑.且相关研究[19 ] 发现,食物可通过激活特定的肠道迷走传入神经亚群,将信号传递到大脑中不同的神经元集群,从而调节能量摄入.具体来说,葡萄糖的信号通过表达SGLT1受体的迷走传入神经传递[14 ] ,脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
... 孤束核的神经元能接收肠道迷走传入神经传递的信号.动物研究[12 ] 发现,葡萄糖在十二指肠被吸收后,可通过迷走传入神经-孤束核回路激活小鼠孤束核中表达前脑啡肽的神经元.这种激活对于区分天然糖分和人工甜味剂至关重要.使用破伤风毒素抑制孤束核中表达前脑啡肽的神经元的突触活动后,小鼠辨别葡萄糖或人工甜味剂的能力会消失,而用特定药物激活这些神经元时小鼠可对原本无偏好的饮料口味产生新的偏好[12 ] .同时,经肠道吸收的脂肪也能通过迷走传入神经-孤束核回路显著激活孤束核神经元,如利用病毒载体特异性诱导孤束核尾部的神经元死亡后小鼠的脂肪偏好行为会消失[11 ] .除了直接的神经信号外,孤束核的神经元也可接收并响应来自血液循环的瘦素信号.瘦素作为一种关键的饱腹感信号,通过与孤束核神经元内的瘦素受体相结合,来增加孤束核神经元的兴奋性,进而影响个体对食物的摄入和偏好[33 ] .总结上述研究我们发现,孤束核神经元可通过综合迷走传入神经传递的信号和激素水平的反馈,在食物摄入和偏好中发挥关键作用. ...
4
... 在临床研究与动物实验中,相关人员已采用了多种方法对食物偏好行为进行评估,并对其背后的机制进行深入探索.临床研究中,问卷调查是评估个体食物偏好特征的最为便捷的方式.如Leeds食物偏好问卷通过要求参与者在甜味、咸味、低脂、高脂这4种食物类别中进行选择,来衡量个体对食物的显性喜好和隐性渴望[7 ] ;宏量营养素和口味偏好排序任务通过要求参与者对不同口味和营养成分类别的食物图片进行排序,检验不同因素对个体食物偏好变化的影响[8 ] .同时,这些问卷的调查结果也为理解食物偏好提供了行为层面的数据.为进一步了解这些偏好背后的深层机制,研究人员通过结合神经影像学技术对个体在食物刺激下的激活脑区、食物偏好的神经调控网络进行探索[9 ] .VAN GALEN等[10 ] 向受试者胃内输注葡萄糖溶液后,借助功能磁共振技术对受试者的脑区激活情况进行分析,结果发现肥胖受试者在纹状体、额叶、岛叶等脑区的神经活动信号比正常体质量受试者更高,提示肥胖受试者的食物偏好调控网络存在损伤.动物实验中,由于无法进行问卷填写,双瓶偏好实验成为评估其食物偏好的主要方法;该实验提供2个装有不同食物或溶液的瓶子,允许动物自由选择,通过记录动物的食物或溶液摄入量和舔舐次数来计算其偏好指数,以评估动物对特定食物的偏好特征[11 ] .而后,有研究人员在双瓶偏好实验基础上,通过操控特定基因的表达或阻断特定的信号通路来观察并验证神经递质、受体及下游信号分子在食物偏好形成与改变过程中的具体作用,从而构建出更加全面、细致的食物偏好行为调控网络[12 ] .这一结果有助于识别调节食物偏好的关键分子,并为肥胖潜在的干预策略提供一定的理论基础. ...
... 孤束核的神经元能接收肠道迷走传入神经传递的信号.动物研究[12 ] 发现,葡萄糖在十二指肠被吸收后,可通过迷走传入神经-孤束核回路激活小鼠孤束核中表达前脑啡肽的神经元.这种激活对于区分天然糖分和人工甜味剂至关重要.使用破伤风毒素抑制孤束核中表达前脑啡肽的神经元的突触活动后,小鼠辨别葡萄糖或人工甜味剂的能力会消失,而用特定药物激活这些神经元时小鼠可对原本无偏好的饮料口味产生新的偏好[12 ] .同时,经肠道吸收的脂肪也能通过迷走传入神经-孤束核回路显著激活孤束核神经元,如利用病毒载体特异性诱导孤束核尾部的神经元死亡后小鼠的脂肪偏好行为会消失[11 ] .除了直接的神经信号外,孤束核的神经元也可接收并响应来自血液循环的瘦素信号.瘦素作为一种关键的饱腹感信号,通过与孤束核神经元内的瘦素受体相结合,来增加孤束核神经元的兴奋性,进而影响个体对食物的摄入和偏好[33 ] .总结上述研究我们发现,孤束核神经元可通过综合迷走传入神经传递的信号和激素水平的反馈,在食物摄入和偏好中发挥关键作用. ...
... [12 ].同时,经肠道吸收的脂肪也能通过迷走传入神经-孤束核回路显著激活孤束核神经元,如利用病毒载体特异性诱导孤束核尾部的神经元死亡后小鼠的脂肪偏好行为会消失[11 ] .除了直接的神经信号外,孤束核的神经元也可接收并响应来自血液循环的瘦素信号.瘦素作为一种关键的饱腹感信号,通过与孤束核神经元内的瘦素受体相结合,来增加孤束核神经元的兴奋性,进而影响个体对食物的摄入和偏好[33 ] .总结上述研究我们发现,孤束核神经元可通过综合迷走传入神经传递的信号和激素水平的反馈,在食物摄入和偏好中发挥关键作用. ...
... 个体对食物的偏好具有可塑性,这一特性在肥胖治疗中具有较大的潜力和价值.现有研究[42 -43 ] 表明教育和运动干预可重塑个体的食物认知及偏好,并引导个体倾向健康饮食,减少其对高糖、高脂食物的偏好.同时,胃肠减重手术已被证明是治疗肥胖的有效手段.在减重手术后,较高比例的患者不仅降低了食物摄入量还改变了食物偏好,即对高热量食物的偏好减少、对低热量食物的偏好增加[44 ] ;而食物摄入和偏好的改变可能与胃肠减重手术对患者胃肠道内的食物感知与信号传递机制的影响有关.除了减重手术外,研究人员也在积极探索非手术的干预方式.例如,动物实验中通过化学遗传学方法刺激小鼠孤束核中表达前脑啡肽的神经元(模拟糖脂吸收后下游信号通路的激活)后发现,小鼠从偏好更甜的葡萄味溶液转为偏好不甜的樱桃味溶液[12 ] .此外,肠道菌群组成和功能的调节也是非手术干预策略中的一个重要方向,通过调整其组成和功能,研究人员能够调节与食物摄入相关的信号转导过程,进而影响个体对食物的偏好.有研究将Faecalibacterium prausnitzii 菌定植到过度进食障碍小鼠的肠道中后发现,该小鼠的食物摄入量有所减少且对高能量和美味食物的偏好降低[31 ] ;在饮用水中补充益生元——低聚果糖能增加大鼠小肠中Bifidobacterium 菌的相对丰度,改善其肠道脂质感应机制,从而调节其食物摄入量并治疗肥胖[45 ] . ...
1
... 在肠道中,食物中的糖类可被胰液、胆汁酸和微生物分解成单糖,这一过程涉及化学信号的释放.具体来说,葡萄糖和半乳糖通过钠-葡萄糖共转运蛋白1(sodium glucose cotransporter 1,SGLT1)进入肠细胞刷状缘,并依赖葡萄糖转运蛋白2在基底膜完成跨膜转运,进入血液循环[13 ] .值得注意的是,葡萄糖在胃肠道内消化吸收的过程中除了会释放化学信号外还能释放电信号.表达SGLT1的神经足细胞在检测到葡萄糖信号后会释放谷氨酸作为神经递质,该神经递质能通过突触间隙作用于迷走传入神经的末梢以激活这些神经纤维[14 ] .此外,作为调节因子,肠道内分泌细胞释放的胆囊收缩素(cholecystokinin,CCK)也能作用于迷走传入神经,参与对糖类偏好的调控[11 ] . ...
3
... 在肠道中,食物中的糖类可被胰液、胆汁酸和微生物分解成单糖,这一过程涉及化学信号的释放.具体来说,葡萄糖和半乳糖通过钠-葡萄糖共转运蛋白1(sodium glucose cotransporter 1,SGLT1)进入肠细胞刷状缘,并依赖葡萄糖转运蛋白2在基底膜完成跨膜转运,进入血液循环[13 ] .值得注意的是,葡萄糖在胃肠道内消化吸收的过程中除了会释放化学信号外还能释放电信号.表达SGLT1的神经足细胞在检测到葡萄糖信号后会释放谷氨酸作为神经递质,该神经递质能通过突触间隙作用于迷走传入神经的末梢以激活这些神经纤维[14 ] .此外,作为调节因子,肠道内分泌细胞释放的胆囊收缩素(cholecystokinin,CCK)也能作用于迷走传入神经,参与对糖类偏好的调控[11 ] . ...
... 研究[14 ] 发现,体外培养的肠道内分泌细胞可直接与迷走传入神经形成突触,并以谷氨酸为神经递质将肠腔内的食物信息快速传递给大脑.且相关研究[19 ] 发现,食物可通过激活特定的肠道迷走传入神经亚群,将信号传递到大脑中不同的神经元集群,从而调节能量摄入.具体来说,葡萄糖的信号通过表达SGLT1受体的迷走传入神经传递[14 ] ,脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
... [14 ],脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
1
... 在肠道中脂肪会被消化成脂肪酸,并通过多种肠道脂肪酸传感器如G蛋白偶联受体40(G protein-coupled receptor 40,GPR40)、GPR120、分化簇36等进入血液循环[15 ] ;其中GPR40和GPR120在脂肪偏好的信号传递中发挥了关键作用,有研究[11 ] 发现Gpr40/Gpr120 双基因敲除的小鼠无法传递脂肪信号.此外,脂肪酸还能刺激肠道内分泌细胞并增加胞内的钙离子浓度,这使得钙离子发生内流并触发了电生理活动,进而激活迷走传入神经亚群.与此同时,这些被激活的亚群可通过神经-内分泌途径调控机体对脂肪的偏好. ...
1
... 在胃肠道中,膳食蛋白先经胃蛋白酶和胰蛋白酶水解,分解成小分子肽和单氨基酸,随后通过肠道中的肽转运蛋白1(peptide transporter 1,PEPT1)进入肠细胞,接着这些小分子肽和氨基酸会进一步通过相应的PEPT1或氨基酸转运体从细胞的基底外侧膜转运至肠道的固有层,以供身体进一步利用[16 ] .虽然膳食蛋白的消化和吸收过程并不直接涉及信号传递,但蛋白质的代谢产物特别是氨基酸在体内发挥着关键的信号分子功能[17 ] ,如其信号传递可能由一种或多种常见氨基酸介导.然而,目前对于这些关键氨基酸的具体种类及其感应机制尚缺乏深入的理解,这仍将是未来研究的重点. ...
1
... 在胃肠道中,膳食蛋白先经胃蛋白酶和胰蛋白酶水解,分解成小分子肽和单氨基酸,随后通过肠道中的肽转运蛋白1(peptide transporter 1,PEPT1)进入肠细胞,接着这些小分子肽和氨基酸会进一步通过相应的PEPT1或氨基酸转运体从细胞的基底外侧膜转运至肠道的固有层,以供身体进一步利用[16 ] .虽然膳食蛋白的消化和吸收过程并不直接涉及信号传递,但蛋白质的代谢产物特别是氨基酸在体内发挥着关键的信号分子功能[17 ] ,如其信号传递可能由一种或多种常见氨基酸介导.然而,目前对于这些关键氨基酸的具体种类及其感应机制尚缺乏深入的理解,这仍将是未来研究的重点. ...
2
... 食物在肠道完成信号转导后,会通过神经通路、体液通路及肠道菌群介导的肠-脑轴传递至食物奖赏相关的脑区,从而激活或抑制不同的神经元,以调节机体的食欲和食物偏好[18 ] .目前,对食物偏好的机制研究主要集中在高糖和高脂食物上,它们被普遍认为与肥胖的关系更为密切,其具体信号传递途径见图1 . ...
... 在食物消化和吸收过程中,代谢产物和相关激素[如胰岛素、瘦素和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等]会通过血液循环到达大脑,且对大脑后脑区、下丘脑基底内侧正中突起等血脑屏障较弱或缺乏的区域影响尤为显著[18 ] .上述信号分子在进入大脑后,能够与特定受体结合并激活或抑制相关神经通路,以调节摄食行为.具体而言,胰岛素可通过调节腹侧纹状体多巴胺释放,来增强大鼠对糖类的偏好[23 ] ;瘦素可通过调节下丘脑刺鼠相关肽(agouti-related peptide,AgRP)神经元影响小鼠的食物选择[24 ] ;FGF21能够与下丘脑腹内侧核谷氨酸能神经元上的受体结合,抑制小鼠对糖和甜味剂的偏好[25 ] .此外,FGF21还能通过激活谷氨酸能神经元,上调机体对富含蛋白质食物的偏好[26 -27 ] . ...
1
... 研究[14 ] 发现,体外培养的肠道内分泌细胞可直接与迷走传入神经形成突触,并以谷氨酸为神经递质将肠腔内的食物信息快速传递给大脑.且相关研究[19 ] 发现,食物可通过激活特定的肠道迷走传入神经亚群,将信号传递到大脑中不同的神经元集群,从而调节能量摄入.具体来说,葡萄糖的信号通过表达SGLT1受体的迷走传入神经传递[14 ] ,脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
1
... 研究[14 ] 发现,体外培养的肠道内分泌细胞可直接与迷走传入神经形成突触,并以谷氨酸为神经递质将肠腔内的食物信息快速传递给大脑.且相关研究[19 ] 发现,食物可通过激活特定的肠道迷走传入神经亚群,将信号传递到大脑中不同的神经元集群,从而调节能量摄入.具体来说,葡萄糖的信号通过表达SGLT1受体的迷走传入神经传递[14 ] ,脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
1
... 研究[14 ] 发现,体外培养的肠道内分泌细胞可直接与迷走传入神经形成突触,并以谷氨酸为神经递质将肠腔内的食物信息快速传递给大脑.且相关研究[19 ] 发现,食物可通过激活特定的肠道迷走传入神经亚群,将信号传递到大脑中不同的神经元集群,从而调节能量摄入.具体来说,葡萄糖的信号通过表达SGLT1受体的迷走传入神经传递[14 ] ,脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
1
... 研究[14 ] 发现,体外培养的肠道内分泌细胞可直接与迷走传入神经形成突触,并以谷氨酸为神经递质将肠腔内的食物信息快速传递给大脑.且相关研究[19 ] 发现,食物可通过激活特定的肠道迷走传入神经亚群,将信号传递到大脑中不同的神经元集群,从而调节能量摄入.具体来说,葡萄糖的信号通过表达SGLT1受体的迷走传入神经传递[14 ] ,脂肪的信号通过表达瞬时受体电位锚蛋白1的迷走传入神经传递,而表达CCK受体的迷走传入神经能同时传递糖类和脂肪的信号[11 ] ;同时蛋白质的信号也能通过迷走传入神经传递,有研究发现迷走传入神经全切断术可降低小鼠对蛋白质的偏好[20 ] ,但其具体参与调控蛋白质偏好的迷走传入神经亚群尚有待进一步研究.除迷走传入神经外,这些信号的传递还涉及内脏神经,且该类神经可调控整个胃肠道和相关腺体,并通过背根神经与大脑相连[21 ] .尽管已有研究显示外科手术阻断内脏神经传入纤维能降低小鼠对葡萄糖的偏好[22 ] ,但内脏神经传入纤维在糖类、脂肪和蛋白质信号传递中的作用机制尚不清楚. ...
1
... 在食物消化和吸收过程中,代谢产物和相关激素[如胰岛素、瘦素和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等]会通过血液循环到达大脑,且对大脑后脑区、下丘脑基底内侧正中突起等血脑屏障较弱或缺乏的区域影响尤为显著[18 ] .上述信号分子在进入大脑后,能够与特定受体结合并激活或抑制相关神经通路,以调节摄食行为.具体而言,胰岛素可通过调节腹侧纹状体多巴胺释放,来增强大鼠对糖类的偏好[23 ] ;瘦素可通过调节下丘脑刺鼠相关肽(agouti-related peptide,AgRP)神经元影响小鼠的食物选择[24 ] ;FGF21能够与下丘脑腹内侧核谷氨酸能神经元上的受体结合,抑制小鼠对糖和甜味剂的偏好[25 ] .此外,FGF21还能通过激活谷氨酸能神经元,上调机体对富含蛋白质食物的偏好[26 -27 ] . ...
1
... 在食物消化和吸收过程中,代谢产物和相关激素[如胰岛素、瘦素和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等]会通过血液循环到达大脑,且对大脑后脑区、下丘脑基底内侧正中突起等血脑屏障较弱或缺乏的区域影响尤为显著[18 ] .上述信号分子在进入大脑后,能够与特定受体结合并激活或抑制相关神经通路,以调节摄食行为.具体而言,胰岛素可通过调节腹侧纹状体多巴胺释放,来增强大鼠对糖类的偏好[23 ] ;瘦素可通过调节下丘脑刺鼠相关肽(agouti-related peptide,AgRP)神经元影响小鼠的食物选择[24 ] ;FGF21能够与下丘脑腹内侧核谷氨酸能神经元上的受体结合,抑制小鼠对糖和甜味剂的偏好[25 ] .此外,FGF21还能通过激活谷氨酸能神经元,上调机体对富含蛋白质食物的偏好[26 -27 ] . ...
1
... 在食物消化和吸收过程中,代谢产物和相关激素[如胰岛素、瘦素和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等]会通过血液循环到达大脑,且对大脑后脑区、下丘脑基底内侧正中突起等血脑屏障较弱或缺乏的区域影响尤为显著[18 ] .上述信号分子在进入大脑后,能够与特定受体结合并激活或抑制相关神经通路,以调节摄食行为.具体而言,胰岛素可通过调节腹侧纹状体多巴胺释放,来增强大鼠对糖类的偏好[23 ] ;瘦素可通过调节下丘脑刺鼠相关肽(agouti-related peptide,AgRP)神经元影响小鼠的食物选择[24 ] ;FGF21能够与下丘脑腹内侧核谷氨酸能神经元上的受体结合,抑制小鼠对糖和甜味剂的偏好[25 ] .此外,FGF21还能通过激活谷氨酸能神经元,上调机体对富含蛋白质食物的偏好[26 -27 ] . ...
1
... 在食物消化和吸收过程中,代谢产物和相关激素[如胰岛素、瘦素和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等]会通过血液循环到达大脑,且对大脑后脑区、下丘脑基底内侧正中突起等血脑屏障较弱或缺乏的区域影响尤为显著[18 ] .上述信号分子在进入大脑后,能够与特定受体结合并激活或抑制相关神经通路,以调节摄食行为.具体而言,胰岛素可通过调节腹侧纹状体多巴胺释放,来增强大鼠对糖类的偏好[23 ] ;瘦素可通过调节下丘脑刺鼠相关肽(agouti-related peptide,AgRP)神经元影响小鼠的食物选择[24 ] ;FGF21能够与下丘脑腹内侧核谷氨酸能神经元上的受体结合,抑制小鼠对糖和甜味剂的偏好[25 ] .此外,FGF21还能通过激活谷氨酸能神经元,上调机体对富含蛋白质食物的偏好[26 -27 ] . ...
1
... 在食物消化和吸收过程中,代谢产物和相关激素[如胰岛素、瘦素和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等]会通过血液循环到达大脑,且对大脑后脑区、下丘脑基底内侧正中突起等血脑屏障较弱或缺乏的区域影响尤为显著[18 ] .上述信号分子在进入大脑后,能够与特定受体结合并激活或抑制相关神经通路,以调节摄食行为.具体而言,胰岛素可通过调节腹侧纹状体多巴胺释放,来增强大鼠对糖类的偏好[23 ] ;瘦素可通过调节下丘脑刺鼠相关肽(agouti-related peptide,AgRP)神经元影响小鼠的食物选择[24 ] ;FGF21能够与下丘脑腹内侧核谷氨酸能神经元上的受体结合,抑制小鼠对糖和甜味剂的偏好[25 ] .此外,FGF21还能通过激活谷氨酸能神经元,上调机体对富含蛋白质食物的偏好[26 -27 ] . ...
1
... 研究[28 ] 显示,肠道菌群可通过产生神经活性物质调控宿主的食物偏好行为.有研究发现,将草食性山地田鼠的肠道菌群移植给无菌小鼠后,无菌小鼠体内的色氨酸生成增加[29 ] ;而增加的色氨酸在进入大脑后会转变为血清素,后者作为一种重要的神经递质能有效调控宿主的进食行为[30 ] .且研究[29 ] 还发现,血清素可显著减少无菌小鼠对碳水化合物的摄入,进而影响其对食物类型的选择.此外,肠道菌群能重塑小鼠食物摄入的奖赏回路.研究[31 ] 发现,将肥胖小鼠的肠道菌群移植给正常体质量的小鼠后,后者可表现出与肥胖小鼠相似的食物偏好模式,这表明肠道菌群的改变与肥胖相关的奖赏和愉悦食物摄入的失调有关;同时,该研究还发现Parabacteroides 菌与高脂、高蔗糖食物摄入之间存在显著正相关,提示该菌可能通过肠-脑轴机制影响食物的奖赏回路,从而进一步改变宿主对食物的偏好性.另有研究[32 ] 表明,过度进食小鼠的肠道中的益生菌及犬尿酸等代谢物的水平均有显著下降,并伴随肠迷走传入神经-孤束核-丘脑室旁核环路过度兴奋,该小鼠表现为对可口食物的过度偏好.上述研究均提示肠道菌群在调节宿主摄食行为中发挥了一定作用,但具体机制仍需要深入的研究和探索. ...
2
... 研究[28 ] 显示,肠道菌群可通过产生神经活性物质调控宿主的食物偏好行为.有研究发现,将草食性山地田鼠的肠道菌群移植给无菌小鼠后,无菌小鼠体内的色氨酸生成增加[29 ] ;而增加的色氨酸在进入大脑后会转变为血清素,后者作为一种重要的神经递质能有效调控宿主的进食行为[30 ] .且研究[29 ] 还发现,血清素可显著减少无菌小鼠对碳水化合物的摄入,进而影响其对食物类型的选择.此外,肠道菌群能重塑小鼠食物摄入的奖赏回路.研究[31 ] 发现,将肥胖小鼠的肠道菌群移植给正常体质量的小鼠后,后者可表现出与肥胖小鼠相似的食物偏好模式,这表明肠道菌群的改变与肥胖相关的奖赏和愉悦食物摄入的失调有关;同时,该研究还发现Parabacteroides 菌与高脂、高蔗糖食物摄入之间存在显著正相关,提示该菌可能通过肠-脑轴机制影响食物的奖赏回路,从而进一步改变宿主对食物的偏好性.另有研究[32 ] 表明,过度进食小鼠的肠道中的益生菌及犬尿酸等代谢物的水平均有显著下降,并伴随肠迷走传入神经-孤束核-丘脑室旁核环路过度兴奋,该小鼠表现为对可口食物的过度偏好.上述研究均提示肠道菌群在调节宿主摄食行为中发挥了一定作用,但具体机制仍需要深入的研究和探索. ...
... [29 ]还发现,血清素可显著减少无菌小鼠对碳水化合物的摄入,进而影响其对食物类型的选择.此外,肠道菌群能重塑小鼠食物摄入的奖赏回路.研究[31 ] 发现,将肥胖小鼠的肠道菌群移植给正常体质量的小鼠后,后者可表现出与肥胖小鼠相似的食物偏好模式,这表明肠道菌群的改变与肥胖相关的奖赏和愉悦食物摄入的失调有关;同时,该研究还发现Parabacteroides 菌与高脂、高蔗糖食物摄入之间存在显著正相关,提示该菌可能通过肠-脑轴机制影响食物的奖赏回路,从而进一步改变宿主对食物的偏好性.另有研究[32 ] 表明,过度进食小鼠的肠道中的益生菌及犬尿酸等代谢物的水平均有显著下降,并伴随肠迷走传入神经-孤束核-丘脑室旁核环路过度兴奋,该小鼠表现为对可口食物的过度偏好.上述研究均提示肠道菌群在调节宿主摄食行为中发挥了一定作用,但具体机制仍需要深入的研究和探索. ...
1
... 研究[28 ] 显示,肠道菌群可通过产生神经活性物质调控宿主的食物偏好行为.有研究发现,将草食性山地田鼠的肠道菌群移植给无菌小鼠后,无菌小鼠体内的色氨酸生成增加[29 ] ;而增加的色氨酸在进入大脑后会转变为血清素,后者作为一种重要的神经递质能有效调控宿主的进食行为[30 ] .且研究[29 ] 还发现,血清素可显著减少无菌小鼠对碳水化合物的摄入,进而影响其对食物类型的选择.此外,肠道菌群能重塑小鼠食物摄入的奖赏回路.研究[31 ] 发现,将肥胖小鼠的肠道菌群移植给正常体质量的小鼠后,后者可表现出与肥胖小鼠相似的食物偏好模式,这表明肠道菌群的改变与肥胖相关的奖赏和愉悦食物摄入的失调有关;同时,该研究还发现Parabacteroides 菌与高脂、高蔗糖食物摄入之间存在显著正相关,提示该菌可能通过肠-脑轴机制影响食物的奖赏回路,从而进一步改变宿主对食物的偏好性.另有研究[32 ] 表明,过度进食小鼠的肠道中的益生菌及犬尿酸等代谢物的水平均有显著下降,并伴随肠迷走传入神经-孤束核-丘脑室旁核环路过度兴奋,该小鼠表现为对可口食物的过度偏好.上述研究均提示肠道菌群在调节宿主摄食行为中发挥了一定作用,但具体机制仍需要深入的研究和探索. ...
2
... 研究[28 ] 显示,肠道菌群可通过产生神经活性物质调控宿主的食物偏好行为.有研究发现,将草食性山地田鼠的肠道菌群移植给无菌小鼠后,无菌小鼠体内的色氨酸生成增加[29 ] ;而增加的色氨酸在进入大脑后会转变为血清素,后者作为一种重要的神经递质能有效调控宿主的进食行为[30 ] .且研究[29 ] 还发现,血清素可显著减少无菌小鼠对碳水化合物的摄入,进而影响其对食物类型的选择.此外,肠道菌群能重塑小鼠食物摄入的奖赏回路.研究[31 ] 发现,将肥胖小鼠的肠道菌群移植给正常体质量的小鼠后,后者可表现出与肥胖小鼠相似的食物偏好模式,这表明肠道菌群的改变与肥胖相关的奖赏和愉悦食物摄入的失调有关;同时,该研究还发现Parabacteroides 菌与高脂、高蔗糖食物摄入之间存在显著正相关,提示该菌可能通过肠-脑轴机制影响食物的奖赏回路,从而进一步改变宿主对食物的偏好性.另有研究[32 ] 表明,过度进食小鼠的肠道中的益生菌及犬尿酸等代谢物的水平均有显著下降,并伴随肠迷走传入神经-孤束核-丘脑室旁核环路过度兴奋,该小鼠表现为对可口食物的过度偏好.上述研究均提示肠道菌群在调节宿主摄食行为中发挥了一定作用,但具体机制仍需要深入的研究和探索. ...
... 个体对食物的偏好具有可塑性,这一特性在肥胖治疗中具有较大的潜力和价值.现有研究[42 -43 ] 表明教育和运动干预可重塑个体的食物认知及偏好,并引导个体倾向健康饮食,减少其对高糖、高脂食物的偏好.同时,胃肠减重手术已被证明是治疗肥胖的有效手段.在减重手术后,较高比例的患者不仅降低了食物摄入量还改变了食物偏好,即对高热量食物的偏好减少、对低热量食物的偏好增加[44 ] ;而食物摄入和偏好的改变可能与胃肠减重手术对患者胃肠道内的食物感知与信号传递机制的影响有关.除了减重手术外,研究人员也在积极探索非手术的干预方式.例如,动物实验中通过化学遗传学方法刺激小鼠孤束核中表达前脑啡肽的神经元(模拟糖脂吸收后下游信号通路的激活)后发现,小鼠从偏好更甜的葡萄味溶液转为偏好不甜的樱桃味溶液[12 ] .此外,肠道菌群组成和功能的调节也是非手术干预策略中的一个重要方向,通过调整其组成和功能,研究人员能够调节与食物摄入相关的信号转导过程,进而影响个体对食物的偏好.有研究将Faecalibacterium prausnitzii 菌定植到过度进食障碍小鼠的肠道中后发现,该小鼠的食物摄入量有所减少且对高能量和美味食物的偏好降低[31 ] ;在饮用水中补充益生元——低聚果糖能增加大鼠小肠中Bifidobacterium 菌的相对丰度,改善其肠道脂质感应机制,从而调节其食物摄入量并治疗肥胖[45 ] . ...
1
... 研究[28 ] 显示,肠道菌群可通过产生神经活性物质调控宿主的食物偏好行为.有研究发现,将草食性山地田鼠的肠道菌群移植给无菌小鼠后,无菌小鼠体内的色氨酸生成增加[29 ] ;而增加的色氨酸在进入大脑后会转变为血清素,后者作为一种重要的神经递质能有效调控宿主的进食行为[30 ] .且研究[29 ] 还发现,血清素可显著减少无菌小鼠对碳水化合物的摄入,进而影响其对食物类型的选择.此外,肠道菌群能重塑小鼠食物摄入的奖赏回路.研究[31 ] 发现,将肥胖小鼠的肠道菌群移植给正常体质量的小鼠后,后者可表现出与肥胖小鼠相似的食物偏好模式,这表明肠道菌群的改变与肥胖相关的奖赏和愉悦食物摄入的失调有关;同时,该研究还发现Parabacteroides 菌与高脂、高蔗糖食物摄入之间存在显著正相关,提示该菌可能通过肠-脑轴机制影响食物的奖赏回路,从而进一步改变宿主对食物的偏好性.另有研究[32 ] 表明,过度进食小鼠的肠道中的益生菌及犬尿酸等代谢物的水平均有显著下降,并伴随肠迷走传入神经-孤束核-丘脑室旁核环路过度兴奋,该小鼠表现为对可口食物的过度偏好.上述研究均提示肠道菌群在调节宿主摄食行为中发挥了一定作用,但具体机制仍需要深入的研究和探索. ...
1
... 孤束核的神经元能接收肠道迷走传入神经传递的信号.动物研究[12 ] 发现,葡萄糖在十二指肠被吸收后,可通过迷走传入神经-孤束核回路激活小鼠孤束核中表达前脑啡肽的神经元.这种激活对于区分天然糖分和人工甜味剂至关重要.使用破伤风毒素抑制孤束核中表达前脑啡肽的神经元的突触活动后,小鼠辨别葡萄糖或人工甜味剂的能力会消失,而用特定药物激活这些神经元时小鼠可对原本无偏好的饮料口味产生新的偏好[12 ] .同时,经肠道吸收的脂肪也能通过迷走传入神经-孤束核回路显著激活孤束核神经元,如利用病毒载体特异性诱导孤束核尾部的神经元死亡后小鼠的脂肪偏好行为会消失[11 ] .除了直接的神经信号外,孤束核的神经元也可接收并响应来自血液循环的瘦素信号.瘦素作为一种关键的饱腹感信号,通过与孤束核神经元内的瘦素受体相结合,来增加孤束核神经元的兴奋性,进而影响个体对食物的摄入和偏好[33 ] .总结上述研究我们发现,孤束核神经元可通过综合迷走传入神经传递的信号和激素水平的反馈,在食物摄入和偏好中发挥关键作用. ...
1
... 多巴胺奖赏回路包括从腹侧被盖区到腹侧纹状体的中脑边缘系统和从黑质致密部到背侧纹状体的黑质纹状体系统,且该2个系统的激活对于食物的奖赏效应至关重要.研究[34 -35 ] 显示,口服或胃内输注蔗糖能有效引发这2个系统中的神经元活动,并促进多巴胺的释放.同时,有研究发现迷走传入神经在这一过程中亦发挥了精细的调节作用.右侧迷走传入神经的激活可特异性增加背侧纹状体多巴胺的释放[36 ] ,这可能与食物摄入后的奖赏感和满足感有关.而左侧迷走传入神经的激活可特异性增加腹侧被盖区多巴胺能神经元的活动[37 ] .这些研究的发现均揭示出多巴胺奖赏回路在食物选择和摄入中的复杂机制以及迷走传入神经在协调食物奖赏和动机行为中的作用. ...
1
... 多巴胺奖赏回路包括从腹侧被盖区到腹侧纹状体的中脑边缘系统和从黑质致密部到背侧纹状体的黑质纹状体系统,且该2个系统的激活对于食物的奖赏效应至关重要.研究[34 -35 ] 显示,口服或胃内输注蔗糖能有效引发这2个系统中的神经元活动,并促进多巴胺的释放.同时,有研究发现迷走传入神经在这一过程中亦发挥了精细的调节作用.右侧迷走传入神经的激活可特异性增加背侧纹状体多巴胺的释放[36 ] ,这可能与食物摄入后的奖赏感和满足感有关.而左侧迷走传入神经的激活可特异性增加腹侧被盖区多巴胺能神经元的活动[37 ] .这些研究的发现均揭示出多巴胺奖赏回路在食物选择和摄入中的复杂机制以及迷走传入神经在协调食物奖赏和动机行为中的作用. ...
1
... 多巴胺奖赏回路包括从腹侧被盖区到腹侧纹状体的中脑边缘系统和从黑质致密部到背侧纹状体的黑质纹状体系统,且该2个系统的激活对于食物的奖赏效应至关重要.研究[34 -35 ] 显示,口服或胃内输注蔗糖能有效引发这2个系统中的神经元活动,并促进多巴胺的释放.同时,有研究发现迷走传入神经在这一过程中亦发挥了精细的调节作用.右侧迷走传入神经的激活可特异性增加背侧纹状体多巴胺的释放[36 ] ,这可能与食物摄入后的奖赏感和满足感有关.而左侧迷走传入神经的激活可特异性增加腹侧被盖区多巴胺能神经元的活动[37 ] .这些研究的发现均揭示出多巴胺奖赏回路在食物选择和摄入中的复杂机制以及迷走传入神经在协调食物奖赏和动机行为中的作用. ...
1
... 多巴胺奖赏回路包括从腹侧被盖区到腹侧纹状体的中脑边缘系统和从黑质致密部到背侧纹状体的黑质纹状体系统,且该2个系统的激活对于食物的奖赏效应至关重要.研究[34 -35 ] 显示,口服或胃内输注蔗糖能有效引发这2个系统中的神经元活动,并促进多巴胺的释放.同时,有研究发现迷走传入神经在这一过程中亦发挥了精细的调节作用.右侧迷走传入神经的激活可特异性增加背侧纹状体多巴胺的释放[36 ] ,这可能与食物摄入后的奖赏感和满足感有关.而左侧迷走传入神经的激活可特异性增加腹侧被盖区多巴胺能神经元的活动[37 ] .这些研究的发现均揭示出多巴胺奖赏回路在食物选择和摄入中的复杂机制以及迷走传入神经在协调食物奖赏和动机行为中的作用. ...
1
... 下丘脑弓状核的AgRP神经元是调控食物摄入的关键神经元,该神经元可接受来自神经回路和瘦素的调节.动物研究[38 ] 表明,AgRP神经元的活动受外侧下丘脑谷氨酸能神经元到背内侧下丘脑γ-氨基丁酸能神经元的神经回路调节,干扰该回路可抑制AgRP神经元并减少小鼠对食物的摄入.特别当AgRP神经元被抑制后,小鼠对食物的奖赏效应会增强,其口味偏好也会发生逆转[39 -40 ] .此外,AgRP神经元能够表达有功能性的瘦素受体,这使得瘦素能直接作用于该神经元并抑制其活性[41 ] ;这一调节机制可确保机体在能量充足时减少进食,以避免发生过度肥胖.上述结果均表明AgRP神经元在食物摄入的调节中发挥着较复杂的作用,且与食物奖赏、偏好的形成密切相关. ...
1
... 下丘脑弓状核的AgRP神经元是调控食物摄入的关键神经元,该神经元可接受来自神经回路和瘦素的调节.动物研究[38 ] 表明,AgRP神经元的活动受外侧下丘脑谷氨酸能神经元到背内侧下丘脑γ-氨基丁酸能神经元的神经回路调节,干扰该回路可抑制AgRP神经元并减少小鼠对食物的摄入.特别当AgRP神经元被抑制后,小鼠对食物的奖赏效应会增强,其口味偏好也会发生逆转[39 -40 ] .此外,AgRP神经元能够表达有功能性的瘦素受体,这使得瘦素能直接作用于该神经元并抑制其活性[41 ] ;这一调节机制可确保机体在能量充足时减少进食,以避免发生过度肥胖.上述结果均表明AgRP神经元在食物摄入的调节中发挥着较复杂的作用,且与食物奖赏、偏好的形成密切相关. ...
1
... 下丘脑弓状核的AgRP神经元是调控食物摄入的关键神经元,该神经元可接受来自神经回路和瘦素的调节.动物研究[38 ] 表明,AgRP神经元的活动受外侧下丘脑谷氨酸能神经元到背内侧下丘脑γ-氨基丁酸能神经元的神经回路调节,干扰该回路可抑制AgRP神经元并减少小鼠对食物的摄入.特别当AgRP神经元被抑制后,小鼠对食物的奖赏效应会增强,其口味偏好也会发生逆转[39 -40 ] .此外,AgRP神经元能够表达有功能性的瘦素受体,这使得瘦素能直接作用于该神经元并抑制其活性[41 ] ;这一调节机制可确保机体在能量充足时减少进食,以避免发生过度肥胖.上述结果均表明AgRP神经元在食物摄入的调节中发挥着较复杂的作用,且与食物奖赏、偏好的形成密切相关. ...
1
... 下丘脑弓状核的AgRP神经元是调控食物摄入的关键神经元,该神经元可接受来自神经回路和瘦素的调节.动物研究[38 ] 表明,AgRP神经元的活动受外侧下丘脑谷氨酸能神经元到背内侧下丘脑γ-氨基丁酸能神经元的神经回路调节,干扰该回路可抑制AgRP神经元并减少小鼠对食物的摄入.特别当AgRP神经元被抑制后,小鼠对食物的奖赏效应会增强,其口味偏好也会发生逆转[39 -40 ] .此外,AgRP神经元能够表达有功能性的瘦素受体,这使得瘦素能直接作用于该神经元并抑制其活性[41 ] ;这一调节机制可确保机体在能量充足时减少进食,以避免发生过度肥胖.上述结果均表明AgRP神经元在食物摄入的调节中发挥着较复杂的作用,且与食物奖赏、偏好的形成密切相关. ...
1
... 个体对食物的偏好具有可塑性,这一特性在肥胖治疗中具有较大的潜力和价值.现有研究[42 -43 ] 表明教育和运动干预可重塑个体的食物认知及偏好,并引导个体倾向健康饮食,减少其对高糖、高脂食物的偏好.同时,胃肠减重手术已被证明是治疗肥胖的有效手段.在减重手术后,较高比例的患者不仅降低了食物摄入量还改变了食物偏好,即对高热量食物的偏好减少、对低热量食物的偏好增加[44 ] ;而食物摄入和偏好的改变可能与胃肠减重手术对患者胃肠道内的食物感知与信号传递机制的影响有关.除了减重手术外,研究人员也在积极探索非手术的干预方式.例如,动物实验中通过化学遗传学方法刺激小鼠孤束核中表达前脑啡肽的神经元(模拟糖脂吸收后下游信号通路的激活)后发现,小鼠从偏好更甜的葡萄味溶液转为偏好不甜的樱桃味溶液[12 ] .此外,肠道菌群组成和功能的调节也是非手术干预策略中的一个重要方向,通过调整其组成和功能,研究人员能够调节与食物摄入相关的信号转导过程,进而影响个体对食物的偏好.有研究将Faecalibacterium prausnitzii 菌定植到过度进食障碍小鼠的肠道中后发现,该小鼠的食物摄入量有所减少且对高能量和美味食物的偏好降低[31 ] ;在饮用水中补充益生元——低聚果糖能增加大鼠小肠中Bifidobacterium 菌的相对丰度,改善其肠道脂质感应机制,从而调节其食物摄入量并治疗肥胖[45 ] . ...
1
... 个体对食物的偏好具有可塑性,这一特性在肥胖治疗中具有较大的潜力和价值.现有研究[42 -43 ] 表明教育和运动干预可重塑个体的食物认知及偏好,并引导个体倾向健康饮食,减少其对高糖、高脂食物的偏好.同时,胃肠减重手术已被证明是治疗肥胖的有效手段.在减重手术后,较高比例的患者不仅降低了食物摄入量还改变了食物偏好,即对高热量食物的偏好减少、对低热量食物的偏好增加[44 ] ;而食物摄入和偏好的改变可能与胃肠减重手术对患者胃肠道内的食物感知与信号传递机制的影响有关.除了减重手术外,研究人员也在积极探索非手术的干预方式.例如,动物实验中通过化学遗传学方法刺激小鼠孤束核中表达前脑啡肽的神经元(模拟糖脂吸收后下游信号通路的激活)后发现,小鼠从偏好更甜的葡萄味溶液转为偏好不甜的樱桃味溶液[12 ] .此外,肠道菌群组成和功能的调节也是非手术干预策略中的一个重要方向,通过调整其组成和功能,研究人员能够调节与食物摄入相关的信号转导过程,进而影响个体对食物的偏好.有研究将Faecalibacterium prausnitzii 菌定植到过度进食障碍小鼠的肠道中后发现,该小鼠的食物摄入量有所减少且对高能量和美味食物的偏好降低[31 ] ;在饮用水中补充益生元——低聚果糖能增加大鼠小肠中Bifidobacterium 菌的相对丰度,改善其肠道脂质感应机制,从而调节其食物摄入量并治疗肥胖[45 ] . ...
1
... 个体对食物的偏好具有可塑性,这一特性在肥胖治疗中具有较大的潜力和价值.现有研究[42 -43 ] 表明教育和运动干预可重塑个体的食物认知及偏好,并引导个体倾向健康饮食,减少其对高糖、高脂食物的偏好.同时,胃肠减重手术已被证明是治疗肥胖的有效手段.在减重手术后,较高比例的患者不仅降低了食物摄入量还改变了食物偏好,即对高热量食物的偏好减少、对低热量食物的偏好增加[44 ] ;而食物摄入和偏好的改变可能与胃肠减重手术对患者胃肠道内的食物感知与信号传递机制的影响有关.除了减重手术外,研究人员也在积极探索非手术的干预方式.例如,动物实验中通过化学遗传学方法刺激小鼠孤束核中表达前脑啡肽的神经元(模拟糖脂吸收后下游信号通路的激活)后发现,小鼠从偏好更甜的葡萄味溶液转为偏好不甜的樱桃味溶液[12 ] .此外,肠道菌群组成和功能的调节也是非手术干预策略中的一个重要方向,通过调整其组成和功能,研究人员能够调节与食物摄入相关的信号转导过程,进而影响个体对食物的偏好.有研究将Faecalibacterium prausnitzii 菌定植到过度进食障碍小鼠的肠道中后发现,该小鼠的食物摄入量有所减少且对高能量和美味食物的偏好降低[31 ] ;在饮用水中补充益生元——低聚果糖能增加大鼠小肠中Bifidobacterium 菌的相对丰度,改善其肠道脂质感应机制,从而调节其食物摄入量并治疗肥胖[45 ] . ...
2
... 个体对食物的偏好具有可塑性,这一特性在肥胖治疗中具有较大的潜力和价值.现有研究[42 -43 ] 表明教育和运动干预可重塑个体的食物认知及偏好,并引导个体倾向健康饮食,减少其对高糖、高脂食物的偏好.同时,胃肠减重手术已被证明是治疗肥胖的有效手段.在减重手术后,较高比例的患者不仅降低了食物摄入量还改变了食物偏好,即对高热量食物的偏好减少、对低热量食物的偏好增加[44 ] ;而食物摄入和偏好的改变可能与胃肠减重手术对患者胃肠道内的食物感知与信号传递机制的影响有关.除了减重手术外,研究人员也在积极探索非手术的干预方式.例如,动物实验中通过化学遗传学方法刺激小鼠孤束核中表达前脑啡肽的神经元(模拟糖脂吸收后下游信号通路的激活)后发现,小鼠从偏好更甜的葡萄味溶液转为偏好不甜的樱桃味溶液[12 ] .此外,肠道菌群组成和功能的调节也是非手术干预策略中的一个重要方向,通过调整其组成和功能,研究人员能够调节与食物摄入相关的信号转导过程,进而影响个体对食物的偏好.有研究将Faecalibacterium prausnitzii 菌定植到过度进食障碍小鼠的肠道中后发现,该小鼠的食物摄入量有所减少且对高能量和美味食物的偏好降低[31 ] ;在饮用水中补充益生元——低聚果糖能增加大鼠小肠中Bifidobacterium 菌的相对丰度,改善其肠道脂质感应机制,从而调节其食物摄入量并治疗肥胖[45 ] . ...
... 肥胖是一种慢性代谢性疾病,其发生、发展与对高糖、高脂食物的偏好行为密切相关.食物在胃肠道消化吸收时可释放化学或电信号,这些信号能够通过神经、体液通路以及肠道菌群介导的肠-脑轴传递至中枢神经系统,并通过激活或抑制孤束核神经元、多巴胺奖赏回路和下丘脑中的相关神经通路来调节个体的摄食行为和食物偏好[45 -47 ] ;其中,关于内脏神经和肠道菌群在糖类和脂肪信号传递中的具体作用机制尚不清楚,仍值得进一步研究.在利用食物偏好的神经生理机制治疗肥胖方面,减重手术已被证实能有效减轻个体的体质量并改变食物偏好,但手术并不适用于所有肥胖患者且存在一定的风险和副作用,而如何通过化学遗传学等非手术的方法来模拟手术对食物偏好的影响将是未来关注的方向.目前,肠道菌群干预在动物模型中已显示出调节食物偏好和体质量的潜力,但其在肥胖人群治疗中的应用前景仍需深入探索.因此,继续深入理解食物偏好形成的神经生理机制,不仅有助于揭示肥胖的发病机制,更能为开发新的治疗策略提供靶点,从而为临床治疗提供新的思路. ...
1
... 肥胖是一种慢性代谢性疾病,其发生、发展与对高糖、高脂食物的偏好行为密切相关.食物在胃肠道消化吸收时可释放化学或电信号,这些信号能够通过神经、体液通路以及肠道菌群介导的肠-脑轴传递至中枢神经系统,并通过激活或抑制孤束核神经元、多巴胺奖赏回路和下丘脑中的相关神经通路来调节个体的摄食行为和食物偏好[45 -47 ] ;其中,关于内脏神经和肠道菌群在糖类和脂肪信号传递中的具体作用机制尚不清楚,仍值得进一步研究.在利用食物偏好的神经生理机制治疗肥胖方面,减重手术已被证实能有效减轻个体的体质量并改变食物偏好,但手术并不适用于所有肥胖患者且存在一定的风险和副作用,而如何通过化学遗传学等非手术的方法来模拟手术对食物偏好的影响将是未来关注的方向.目前,肠道菌群干预在动物模型中已显示出调节食物偏好和体质量的潜力,但其在肥胖人群治疗中的应用前景仍需深入探索.因此,继续深入理解食物偏好形成的神经生理机制,不仅有助于揭示肥胖的发病机制,更能为开发新的治疗策略提供靶点,从而为临床治疗提供新的思路. ...