HEN甲基转移酶1(HEN methyltransferase 1,HENMT1)是一种小RNA 2'-O-甲基转移酶的编码基因,是小RNA成熟过程中的关键因素,其同源基因在真核生物和古细菌中高度保守[6-7]。目前关于HENMT1在疾病中作用的研究较少,且主要集中在成年生殖细胞中抑制转座元素以及精子发生过程中的重要作用[8-9]。已有研究表明,HENMT1在多种癌症中表达失调。例如,HENMT1在膀胱尿路上皮癌、宫颈癌、结肠癌、食管癌、胰腺癌、直肠癌和胃癌等多种肿瘤中呈现上调,而在脑低级别胶质瘤中则表现为下调[10]。特别是在卵巢癌中,HENMT1的表达水平随着肿瘤分级的增加而升高,提示其与肿瘤恶性程度密切相关[11]。因此,HENMT1可能在肿瘤的发生和发展过程中发挥重要作用,并有望成为潜在的肿瘤生物标志物。
基于此,本研究以胃癌为重点开展一系列实验,拟深入解析HENMT1在调控胃癌细胞增殖和迁移中的分子机制。
1 材料与方法
1.1 主要试剂与材料
DMEM培养基、RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)购自以色列Biological Industries公司。RIPA缓冲液、二喹啉甲酸(bicinchoninic acid,BCA)定量试剂盒、Invitrogen TRIzol RNA提取试剂、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自陕西先锋生物科技有限公司。蛋白酶抑制剂、磷酸酶抑制剂、CCK-8溶液购自上海陶术生物科技有限公司。Polyplus 脂质体转染试剂购自上海泽迈生物技术有限公司。反转录试剂盒和实时定量PCR(qPCR)试剂盒购自北京全式金生物技术有限公司。Transwell小室购自美国Millicell公司。抗体HENMT1购自美国GeneTex公司。兔源E-钙黏蛋白(E-CADHERIN)抗体、兔源β-连环蛋白(β-CATENIN)抗体、兔源Twist相关蛋白1(twist family bHLH transcription factor 1,TWIST1)抗体、兔源基质金属蛋白酶-9(matrix metalloproteinase-9,MMP9)抗体、兔源基质金属蛋白酶-2(matrix metalloproteinase-2,MMP2)抗体、鼠源磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)抗体、鼠源蛋白激酶B(Protein kinase B,AKT)抗体、鼠源磷酸化-AKT(Ser473)(p-AKT)抗体、鼠源哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体、鼠源磷酸化-mTOR(Ser2448)(p-mTOR)抗体、兔源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自武汉三鹰生物技术有限公司。兔源磷酸化-PI3K p85 alpha(Tyr607)(p-PI3K)抗体购自江苏亲科生物研究中心有限公司。
1.2 方法
1.2.1 生物信息学分析
利用基因表达水平值的交互式分析平台(Gene Expression Profiling Interactive Analysis,GEPIA)分析HENMT1在胃癌组织和胃正常组织中的差异表达;通过Kaplan-Meier Plotter分析HENMT1表达与患者总生存期的相关性,通过BEST工具探究HENMT1与胃癌患者临床特征的相关性。
1.2.2 细胞培养
人胃黏膜上皮细胞(human gastric epithelial cells,GES-1),人胃癌细胞MKN28、HGC27和AGS均来自延安大学医学院医学研究实验中心,均为贴壁细胞。MKN28细胞和HGC27细胞的培养基为含10% FBS的RPMI 1640培养基,GES-1细胞和AGS细胞培养于含10% FBS的DMEM培养基中,所有细胞置于含5% CO2、37 ℃的细胞孵育箱内培养。
1.2.3 Western blotting检测
采用RIPA裂解液提取各组细胞的蛋白质,采用BCA法测定各组蛋白质浓度。取20 μg蛋白样品经SDS-PAGE电泳后转至PVDF膜,与特异性一抗孵育,4 ℃过夜。洗膜后与二抗室温孵育1 h,取适量化学发光液A、B液,按照等体积混匀后加至PVDF膜上,通过Syngene GBox系统采集图像。
1.2.4 RNA提取、cDNA合成、实时荧光定量PCR
采用TRIzol试剂提取各组总RNA,总RNA通过反转录试剂盒反转录为cDNA,同时使用qPCR试剂盒(SYBR法)对HENMT1进行扩增。qPCR的条件为:初始变性94 ℃ 30 s;94 ℃ 5 s,退火60℃ 15 s,延伸72 ℃ 10 s,40个循环。引物由北京擎科生物科技股份有限公司合成,引物序列如表1所示。HENMT1 mRNA的相对表达量采用2-ΔΔCT法进行量化,并用内参基因GAPDH进行归一化。
表1 qPCR引物序列
Tab 1
1.2.5 siRNA合成和转染
设计特异针对HENMT1基因的siRNA序列,由上海吉玛公司合成,序列如表2所示。采用Polyplus转染法将 siHENMT1和siNC分别转染至胃癌细胞中。
表2 siRNA序列
Tab 2
1.2.6 CCK-8实验
GC细胞系MKN28、HGC27和AGS分别接种于96孔细胞培养板中。在转染24、48和72 h时向96孔中加入约10 μL CCK-8溶液,并在37 ℃下培养2 h,通过MD多功能酶标仪在λ=450 nm处测量各组吸光值。
1.2.7 细胞克隆形成实验
将转染 24 h 后的GC细胞系MKN28、HGC27和AGS以800个/孔分别接种于6孔板中,置于37 ℃、5% CO2培养箱中继续培养7~10 d。PBS清洗细胞2次,随后用4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,冲洗、干燥并拍照。
1.2.8 细胞划痕实验
将GC细胞系MKN28、HGC27和AGS分别接种于6孔板中,细胞进行转染并继续培养6 h后用200 μL移液器嘴尖垂直划线,拍照前用PBS冲洗3次,并更换为含1% FBS的培养液继续培养(此时记为 0 h),分别于0、24 和 48 h 拍照。
1.2.9 Transwell迁移实验
将转染24 h后的GC细胞系MKN28、HGC27和AGS接种于上室(含1% FBS的培养液),下室为600 μL含10% FBS 的培养液,置于37 ℃、5% CO2培养箱中继续培养48 h。4%多聚甲醛固定20 min,0.1% 结晶紫染色30 min,采用湿拍法进行拍照。
1.2.10 740 Y-P和3-MA处理
细胞转染siHENMT1/over-HENMT1 6 h后加入740 Y-P/3-MA,根据实验需求进行后续实验。740 Y-P的终浓度为10 μmol/L,3-MA的终浓度为10 μmol/L。
1.3 统计学方法
用SPSS 26.0和GraphPad Prism 8.0软件进行统计学分析。符合正态分布的定量数据用x±s表示。2组间比较采用独立样本t检验,使用单因素方差分析及事后检验进行多组间比较。P<0.05表示差异具有统计学意义。
2 结 果
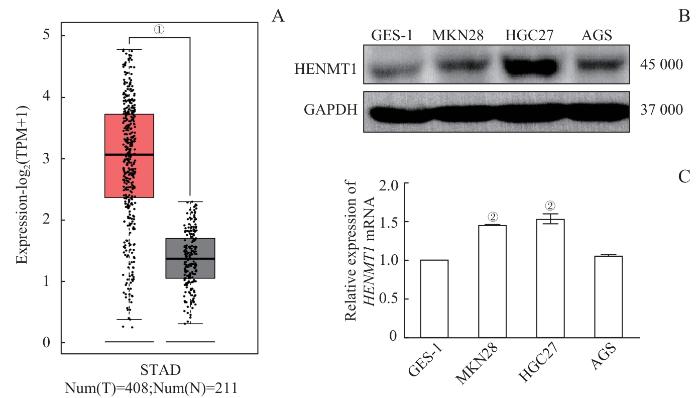
2.1 HENMT1 在胃癌中的表达
图1
图1
HENMT1 在胃癌中的表达
Note: A. Analysis of HENMT1 expression in GC was conducted using the GEPIA database. B/C. The expression levels of HENMT1 in various GC cell lines were further examined through Western blotting (B) and qPCR (C). ①P<0.05; ②P<0.001, compared with the GES-1 group. STAD—Stomach adenocarcinoma; T—tumor; N—Normal.
Fig 1
Expression of HENMT1 in GC
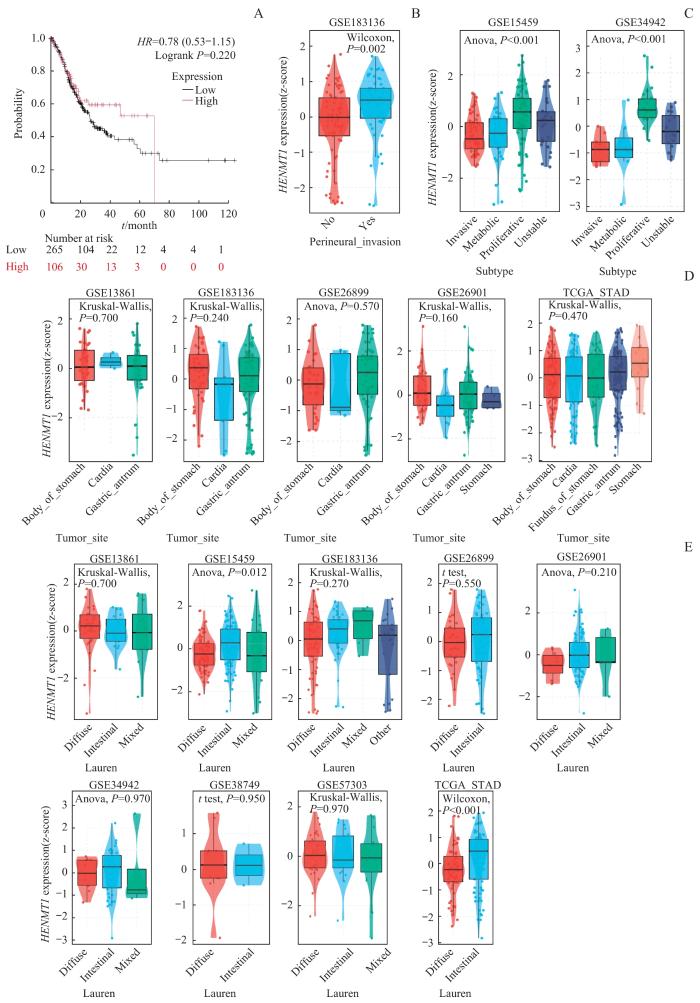
2.2 HENMT1 在胃癌中的临床相关性分析
通过Kaplan-Meier Plotter分析HENMT1表达与患者总生存期的相关性,结果显示HENMT1表达与患者总生存期无显著相关性(图2A)。同时通过BEST在线数据库分析了HENMT1表达与临床胃癌患者的神经侵袭、胃癌亚型、肿瘤发生部位以及胃癌Lauren分型的相关性。结果发现,在具有神经侵袭的胃癌患者中,HENMT1的表达显著高于无神经侵袭的患者(图2B)。胃癌亚型分析结果显示,HENMT1的表达在不同亚型之间存在差异,尤其是在增殖型胃癌中表现出较高的表达水平(图2C)。此外,通过对GSE13861、GSE183136、GSE26899、GSE26901和TCGA-STAD数据集的分析结果表明,HENMT1的表达与胃癌发生的具体部位(如胃体、贲门、胃窦、全胃)无显著相关性(图2D)。HENMT1表达与临床胃癌Lauren分型相关性的结果显示,仅在GSE15459和TCGA-STAD数据集中,HENMT1的表达与Lauren分型(肠型、弥漫型、混合型)呈现相关性,且在肠型胃癌中有更高的表达(图2E)。
图2
图2
HENMT1在胃癌中的临床相关性分析
Note: A. The association between HENMT1 expression and overall survival was analyzed by Kaplan-Meier Plotter. The link between HENMT1 expression and clinical factors in GC patients was analyzed with BEST, including neuroinvasion (B), cancer subtypes (C), tumor site (D) and Lauren classification (E).
Fig 2
Clinical correlation analysis of HENMT1 in GC
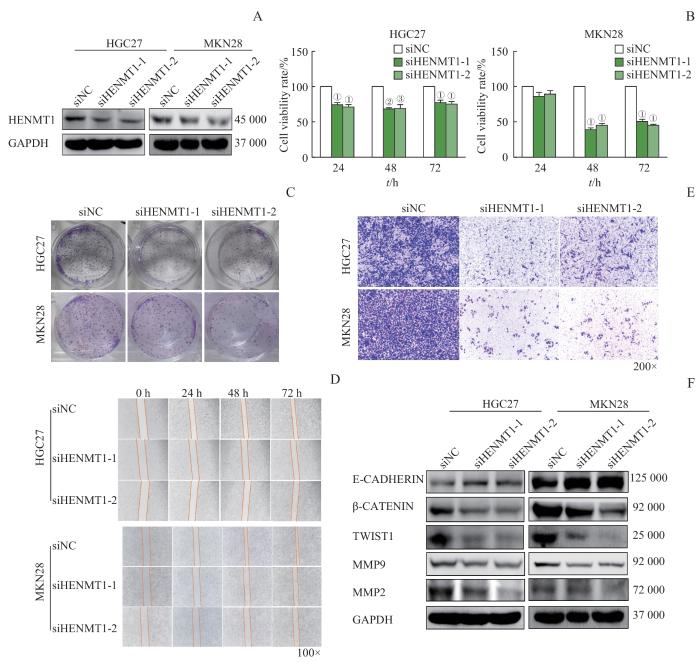
2.3 沉默 HENMT1 抑制胃癌细胞的增殖和迁移
为了进一步明确HENMT1在胃癌中的作用,针对HENMT1设计靶向干扰小片段(siHENMT1),并探究其对胃癌细胞生物学功能的影响。我们首先在HENMT1相对高表达的胃癌细胞系HGC27和MKN28中转染siHENMT1,并通过Western blotting实验观察其干扰效率;结果显示,与对照组siNC相比,siHENMT1组中HENMT1的蛋白表达水平显著下降(图3A)。CCK-8实验结果表明,与siNC组相比,siHENMT1组中HGC27和MKN28细胞活力明显受到抑制(图3B)。细胞克隆形成实验结果显示,转染siHENMT1后,HGC27和MKN28细胞的克隆形成能力显著降低(图3C)。这些结果表明,沉默HENMT1能够有效抑制胃癌细胞的增殖。
图3
图3
沉默 HENMT1 抑制胃癌细胞的增殖和迁移
Note: A. siHENMT1 efficiency was assessed via Western blotting. B. HENMT1's impact on GC cell viability was evaluated using CCK-8 assay. C. The impact of HENMT1 on clonogenic potential was evaluated through colony formation assay. D/E. Cell scratch and Transwell assay were conducted to analyze HENMT1's influence on cell migration. F. Changes in migration-related proteins were identified using Western blotting. ①P<0.001, ②P=0.002, ③P=0.027, compared with the siNC group.
Fig 3
Silencing HENMT1 inhibits proliferation and migration of GC cells
此外,细胞划痕试验结果显示,与siNC组相比,siHENMT1组中HGC27和MKN28细胞的愈合能力减弱(图3D)。Transwell实验的结果也进一步证实,转染siHENMT1后,HGC27和MKN28细胞的穿膜迁移能力显著降低(图3E)。这些结果共同证明了沉默HENMT1能够抑制胃癌细胞的迁移能力。同时,我们通过Western blotting实验检测了细胞迁移相关蛋白质的变化;结果表明,胃癌细胞系HGC27和MKN28中,转染siHENMT1后,E-CADHERIN表达升高,而β-CATENIN、TWIST1、MMP9、MMP2表达则降低(图3F)。综上,沉默HENMT1不仅抑制胃癌细胞的增殖,还显著抑制其迁移潜能。
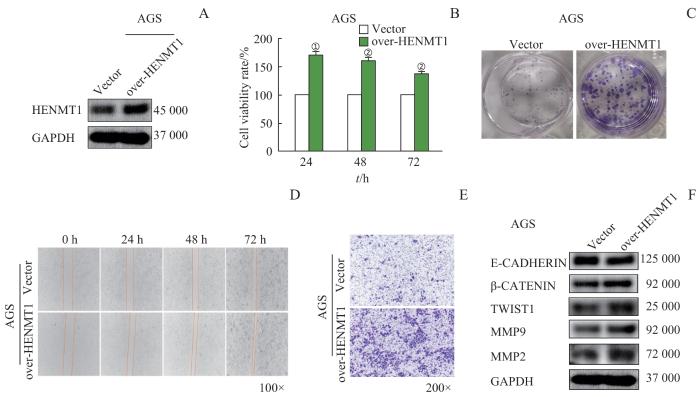
2.4 HENMT1 促进胃癌细胞的增殖和迁移
图4
图4
HENMT1 促进胃癌细胞的增殖和迁移
Note: A. The efficacy of the HENMT1 overexpression plasmid was assessed through Western blotting. B/C. CCK-8 assay and clone formation assay were utilized to assess the HENMT1 effects on cell proliferation in gastric cancer cells. D/E. The influence of HENMT1 on cell migration was investigated using cell scratch and Transwell assays. F. Changes in migration-related proteins were identified via Western blotting. ①P=0.002, ②P=0.003, compared with the Vector group.
Fig 4
HENMT1 promotes proliferation and migration of gastric cancer cells
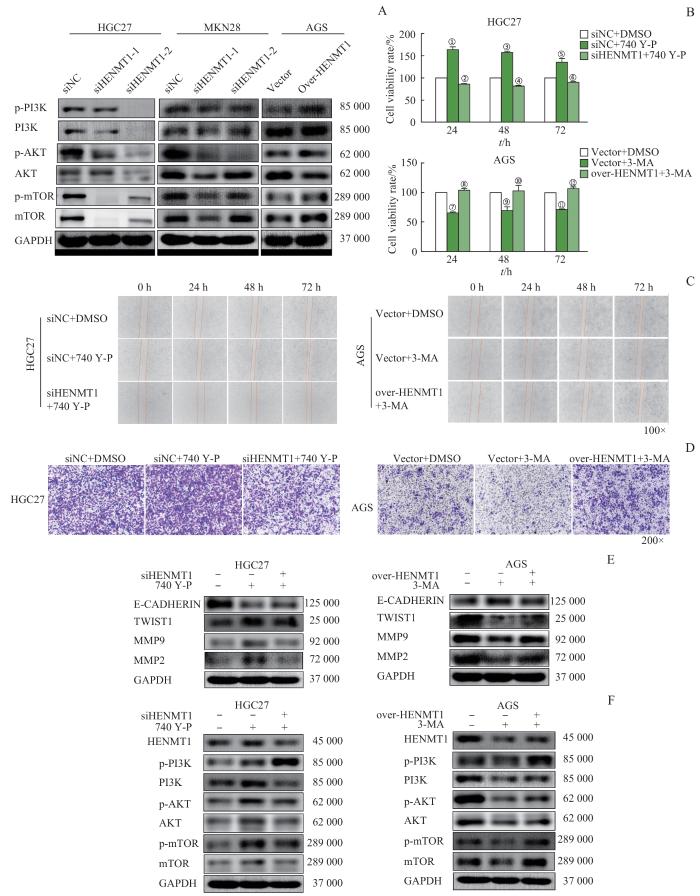
2.5 HENMT1 通过PI3K-AKT-mTOR信号通路调控胃癌细胞的增殖和迁移
为了探讨HENMT1是否通过PI3K-AKT-mTOR信号通路调控胃癌细胞的生长和转移,我们首先通过Western blotting实验检测HENMT1对PI3K-AKT-mTOR信号通路关键蛋白质的影响。结果显示:在胃癌细胞系HGC27和MKN28中,与siNC组相比,转染siHENMT1组中PI3K-AKT-mTOR信号通路关键蛋白质p-PI3K、p-AKT、p-mTOR表达降低,PI3K、AKT、mTOR的总蛋白水平也降低;相反,在过表达HENMT1的AGS细胞系中,p-PI3K、p-AKT、p-mTOR以及相关总蛋白的表达水平均升高(图5A)。这些结果表明HENMT1可能通过PI3K-AKT-mTOR信号通路调控胃癌细胞的功能。
图5
图5
HENMT1 通过PI3K-AKT-mTOR信号通路调控胃癌细胞的增殖和迁移
Note: A. Western blotting was used to assess HENMT1's impact on key protein expression in the PI3K-AKT-mTOR pathway in GC cell line. B. The impact of si/over HENMT1 with 740 Y-P/3-MA on HGC27 and AGS GC cell survival was evaluated using the CCK-8 assay. C/D. The impact of si/over HENMT1 with 740 Y-P/3-MA on the migration of GC cell lines HGC27 and AGS was assessed through cell scratch (C) and Transwell assay (D). E/F. Western blotting was employed to assess protein changes linked to cell migration (E) and key components of the PI3K-AKT-mTOR pathway (F) in HGC27 and AGS GC cell lines following combined treatment with si/over HENMT1 and 740 Y-P/3MA.①P=0.010, ③P=0.002, ⑤P=0.045, compared with the siNC+DMSO group; ②P=0.005, ④P<0.001, ⑥P=0.028, compared with the siNC+740 Y-P group; ⑦P<0.001, ⑨P=0.033, ⑪P=0.030, compared with the Vector+DMSO group; ⑧P<0.001, ⑩P=0.030, ⑫P=0.003, compared with the Vector+3-MA group.
Fig 5
HENMT1 regulates proliferation and migration of GC cells via PI3K-AKT-mTOR signaling pathway
通过CCK-8实验、细胞划痕实验和Transwell实验以进一步评估HENMT1是否通过PI3K-AKT-mTOR信号通路影响胃癌细胞的增殖和迁移。CCK-8实验结果表明:在HGC27细胞系中,与siNC+740 Y-P组相比,转染siHENMT1+740 Y-P组HGC27细胞增殖能力降低;而在AGS细胞系中,与Vector+3-MA相比,over-HENMT1+3-MA组AGS细胞的增殖能力则显著增加(图5B)。此外,细胞划痕实验和Transwell实验结果显示:在HGC27细胞系中,siHENMT1+740 Y-P组的迁移能力显著低于siNC+740 Y-P组;而在AGS细胞系中,over-HENMT1+3-MA组相较于Vector+3-MA组表现出更强的迁移能力(图5C、D)。同时,我们通过Western blotting实验检测了细胞迁移相关蛋白质的变化,结果:在HGC27细胞系中,与siNC+740 Y-P组相比,转染siHENMT1+740 Y-P组E-CADHERIN表达升高,TWIST1、MMP9、MMP2表达则降低;在AGS细胞系中则结果相反,如图5E所示。联合使用HENMT1干扰/过表达与PI3K-AKT-mTOR信号通路激活剂740 Y-P/抑制剂3-MA处理HGC27和AGS细胞系,Western blotting结果显示:在HGC27细胞系中,与siNC+740 Y-P组相比,转染siHENMT1+740 Y-P组p-PI3K、p-AKT、p-mTOR表达下降,PI3K、AKT、mTOR总蛋白的表达也有所减少;在AGS细胞系中则结果相反(图5F)。综上所述,HENMT1通过PI3K-AKT-mTOR信号通路调控胃癌细胞的增殖和迁移能力。
3 讨 论
本研究探讨了HENMT1在GC中的作用及其相关机制。首先,通过生物信息学分析和细胞实验验证发现,HENMT1在GC组织中的表达显著升高,这一结果与BEGIK等[10]的研究一致。同时,我们利用BEST在线工具分析了HENMT1的表达与GC临床特征的相关性。研究显示,在有神经侵袭的GC患者中,HENMT1的表达水平显著高于无神经侵袭患者;这一结果表明,HENMT1可能与胃癌神经侵袭密切相关。此外,HENMT1的表达与增殖型GC亚型密切相关,并且在Lauren分型肠型GC中表现出更高的表达水平,提示HENMT1可能在增殖型GC的发展中发挥重要作用,同时也为HENMT1可能作为肠型GC标志物的潜在应用提供了线索。然而,HENMT1的表达与GC发生部位(胃体、贲门、胃窦、全胃)之间未见显著相关性。不仅如此,有其他研究发现,HENMT1在卵巢癌中从G2期到G3期的表达显著增加[11]。有学者发现HENMT1的表达与临床标志物MKI67呈正相关,两者联合能够提高诊断效率[13-14]。此外,HENMT1的表达水平还与食管癌组织中多种免疫细胞类型(如B细胞、Tregs、中性粒细胞、CD4记忆激活型T细胞等)的浸润密切相关[13]。基于上述背景,本研究进一步通过细胞功能实验探讨了HENMT1在GC中的作用。实验结果显示,沉默HENMT1显著抑制胃癌细胞的增殖和迁移能力,而HENMT1的过表达则促进了这些功能。MKN28具有高转移性;HGC27是源自淋巴结转移的胃癌细胞,也具有迁移能力;而AGS源自未经治疗的GC组织,转移能力较弱。实验过程中我们发现HENMT1对上述细胞均有促迁移作用,提示其不仅能促进胃癌细胞的迁移,也可能在胃癌细胞的上皮间质转化过程中发挥作用。综上所述,HENMT1在GC中异常高表达,可能在GC的发生和发展过程中发挥关键作用,提示其作为潜在的治疗靶点具有重要价值。
PI3K-AKT-mTOR信号通路的失调广泛存在于多种肿瘤进展的病理过程中,包括GC。该信号通路参与了许多重要的癌症相关过程,如细胞凋亡、自噬、细胞生长、存活和增殖[15-20]。在GC中,PI3K-AKT-mTOR通路通过抑制细胞凋亡,诱导化疗耐药表型,促进转移、血管生成以及上皮-间充质转化(EMT)来推动肿瘤的恶性发展[21]。FATTAHI等[15]也在关于GC的综述中详细论述了该信号通路在GC发展、预后和转移中的核心作用。基于这些背景,推测HENMT1可能通过调控PI3K-AKT-mTOR信号通路参与胃癌的增殖和迁移,因此,我们进行了相应的细胞实验。结果显示,沉默HENMT1后,PI3K-AKT-mTOR信号通路的关键蛋白质p-PI3K、p-AKT和p-mTOR的表达明显降低,PI3K、AKT和mTOR的表达也随之下降;而过表达HENMT1则导致相反的结果。为进一步验证该通路的介导作用,我们使用了PI3K激活剂(740 Y-P)和PI3K抑制剂(3-MA)。在HGC27胃癌细胞系中,siHENMT1联合740 Y-P能够逆转740 Y-P所引发的胃癌细胞增殖和迁移促进效应;同样,在AGS胃癌细胞系中,over-HENMT1联合3-MA则逆转了3-MA抑制的细胞增殖和迁移。综上所述,这些结果表明HENMT1通过激活PI3K-AKT-mTOR信号通路,促进了胃癌细胞的增殖和迁移。
我们的研究揭示了HENMT1在GC中的高表达,并首次明确其作为促癌基因的作用,同时发现HENMT1通过直接激活PI3K-AKT-mTOR信号通路促进胃癌细胞的增殖和迁移。该研究结果表明,HENMT1在GC发生发展过程中具有重要作用,且有望成为一种潜在的肿瘤生物标志物。这一发现为深入理解胃癌的分子机制提供了新的思路,并提示HENMT1可能成为未来胃癌治疗的潜在靶点。
作者贡献声明
杨娜负责实验设计和实验操作,刘俊丽负责实验操作和生物信息学分析,白静、杨思怡负责实验材料的准备和数据分析,杨娜、张华华负责论文的撰写和校正,韩继明、张华华负责课题的监管和指导。所有作者均阅读并同意最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study design and experiments were completed by YANG Na. Experiments and bioinformatics analyses were performed by LIU Junli. The preparation of experimental materials and data analysis were carried out by BAI Jing and YANG Siyi. The manuscript was drafted and revised by YANG Na and ZHANG Huahua. Project supervision and guidance were provided by Han Jiming and Zhang Huahua. All authors have read the last version of paper and consented to submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献