前列腺癌目前已经成为威胁男性健康的第二大恶性肿瘤[1]。该疾病的进展高度依赖于雄激素受体(androgen receptor,AR)对转录的调节作用,因而去雄激素治疗是前列腺癌的一线治疗方案之一。根据去雄激素治疗的有效性,临床上也将前列腺癌分为雄激素依赖型和雄激素非依赖型[2]。大部分早期前列腺癌都属于雄激素依赖型,对去势治疗敏感,有更好的治疗预期。然而,在前列腺癌的进展过程中,由于AR过表达或异常激活等机制的影响,雄激素依赖型前列腺癌最终可能转变为雄激素非依赖型前列腺癌,导致原本有效的治疗手段失效,肿瘤恶性程度升高,患者预后变差。因此,迫切需要一种新的治疗方法以应对去势抵抗型前列腺癌的威胁。
KH型剪接调节蛋白(KH-type splicing regulatory protein,KHSRP)是一种能够在转录层面通过多种途径影响基因表达的蛋白质。例如,它可以通过与mRNA的3' 非翻译区(untranslated region,UTR)结合,促进mRNA降解,从而调节下游基因的表达[3]。此外,KHSRP还可以通过调控miRNA成熟的过程来影响雄激素非依赖型前列腺癌的进展[4]。不过,目前尚未研究KHSRP在雄激素依赖型前列腺癌中的功能。为进一步了解KHSRP对mRNA的调控是否影响雄激素依赖型前列腺癌细胞的增殖能力,并探究其调控作用与AR通路的关联,本研究重点关注KHSRP在前列腺癌由雄激素依赖型转变为非依赖型的过程中发挥的潜在作用。
1 材料与方法
1.1 细胞培养
LNCaP和DU145前列腺癌细胞株购自中国科学院细胞库。HEK293T细胞为本实验室保存。使用含有10%胎牛血清的RPMI-1640培养基培养LNCaP细胞,使用含有10%胎牛血清的DMEM培养基培养DU145细胞。所有细胞均常规培养在37 ℃、含5%二氧化碳的加湿培养箱中。
1.2 主要试剂和仪器
胎牛血清、DMEM高糖培养基和RPMI-1640培养基购自美国Hyclone。抗KHSRP抗体(ab150393)购自英国Abcam,抗锚定蛋白3(ankyrin 3,ANK3)抗体(sc-12719)、抗AR抗体(sc-7305)、抗β-肌动蛋白(β-actin)抗体(sc-47778)购自美国Santa Cruz,蛋白酶抑制剂(#5872)、抗血凝素(hemagglutinin,HA)抗体(C29F4,#3724)、抗兔IgG二抗(#7074)、抗小鼠IgG二抗(#7076)购自美国Cell Signaling Technology,抗α微管蛋白(α-tubulin)抗体(Cat66031-1-Ig)购自美国Proteintech,TRIzol购自美国Invitrogen,脂质体转染试剂购自上海翌圣生物科技股份有限公司,反转录试剂盒和实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)试剂购自日本Takara。所有设备和仪器由上海精准医学研究院提供。实时荧光定量PCR仪购自瑞士Roche。酶标仪购自美国PerkinElmer。超灵敏多功能成像仪购自美国General Electric。
1.3 慢病毒质粒的构建
pGreenPuro-Dual质粒和辅助包装质粒均为本实验室保存。在pGreenPuro-Dual基础上自制慢病毒载体,在1次感染中同时敲低内源蛋白并表达外源蛋白,相关描述已在此前发表的文章中提及[5]。将基于pGreenPuro-Dual自制的慢病毒载体作为空载对照质粒,分别针对KHSRP的3' UTR和编码序列(coding sequence,CDS)设计并合成KHSRP的短发夹RNA(short hairpin RNA,shRNA);将shRNA通过T4 DNA连接酶连接至BamH Ⅰ和EcoR Ⅰ-HF双酶切后的空载对照质粒上;将连接后的载体转化至trans5α感受态细胞,使用氨苄抗生素筛选并送测序鉴定,鉴定成功后抽提sh-KHSRP质粒。设计携带HA标签的KHSRP的PCR引物,PCR扩增目的片段,进行琼脂糖凝胶电泳,切胶回收目的基因;将PCR产物通过DNA重组酶连接到Nhe Ⅰ和Xba Ⅰ-HF双酶切后的sh-KHSRP质粒上,通过氨苄抗生素筛选后送测序鉴定,鉴定成功后抽提sh-KHSRP-HA-KHSRP质粒。慢病毒质粒构建所用引物序列见表1。
表 1 慢病毒质粒构建所用引物序列
Tab 1
| Primer | Sequence (5′→3′) |
|---|---|
| sh-KHSRP-UTR-F | GATCCGCTGAGGATAAAGCAATTCATTCTCGAGAATGAATTGCTTTATCCTCAGCTTTTTG |
| sh-KHSRP-UTR-R | AATTCAAAAAGCTGAGGATAAAGCAATTCATTCTCGAGAATGAATTGCTTTATCCTCAGCG |
| sh-KHSRP-CDS-F | GATCCGCCCGAGAAGATTGCTCATATACTCGAGTATATGAGCAATCTTCTCGGGCTTTTTG |
| sh-KHSRP-CDS-R | AATTCAAAAAGCCCGAGAAGATTGCTCATATACTCGAGTATATGAGCAATCTTCTCGGGCG |
| HA-KHSRP-F | TTTTGACCTCCATAGAAGATTATGGGTACCTATCCTTACGA |
| HA-KHSRP-R | GCGTCTAGGAAGAGCTCGATCAGTTAGAGGAGAACTTGTCT |
1.4 慢病毒的包装和稳转细胞株的构建
将慢病毒的辅助包装质粒(pCMV-dR8.2、pMD2.G)与目的质粒(空载对照、sh-KHSRP、sh-KHSRP-HA-KHSRP)用脂质体转染试剂转染至HEK293T细胞。培养48 h后,收集病毒上清液,用0.22 μm的滤器过滤。将病毒液感染合适密度的LNCaP细胞或DU145细胞48 h后,使用嘌呤霉素(puromycin)筛选,获得稳定细胞株。在LNCaP细胞中,感染空载对照质粒包装的慢病毒以构建LNCaPNC稳定细胞株,感染sh-KHSRP-CDS质粒包装的慢病毒以构建LNCaPsh-KHSRP-CDS稳定细胞株,作为阳性对照确保KHSRP的有效沉默。在LNCaP和DU145细胞中,感染sh-KHSRP-UTR质粒包装的慢病毒,以构建沉默KHSRP的LNCaPsh-KHSRP 和DU145sh-KHSRP 稳定细胞株;并在sh-KHSRP-UTR的基础上回复过表达外源KHSRP构建LNCaPsh-KHSRP-HA-KHSRP 和DU145sh-KHSRP-HA-KHSRP 稳定细胞株。
1.5 细胞增殖实验
LNCaP细胞中,以LNCaPNC细胞为空白对照组,LNCaPsh-KHSRP 细胞为敲低内源KHSRP的对照组,LNCaPsh-KHSRP-HA-KHSRP 细胞为敲低内源KHSRP后回复表达外源KHSRP的实验组。DU145细胞中,以DU145sh-KHSRP 细胞为对照组,DU145sh-KHSRP-HA-KHSRP 细胞为实验组。将LNCaP和DU145稳定细胞株计数后以每孔3×103个细胞的密度接种至96孔板中,每种细胞设置5个复孔,以同样方式共接种4块96孔板;待细胞完全贴壁后,将第一块96孔板用25%三氯乙酸在4 ℃反应1 h进行固定,用清水洗净,之后每隔24 h固定1块96孔板;待细胞全部固定完成后,加入用1%冰乙酸溶解的磺胺霍丹明B(sulforhodamine B,SRB)染料,在避光条件下反应30 min,用1%冰乙酸洗净未结合的SRB染料,使用10 mmol/L Tris溶液(pH 10.5)溶解SRB染料;最后使用酶标仪在510 nm波长测量吸光度,根据吸光度数值绘制每日生长曲线以比较细胞的增殖能力。
1.6 平板克隆实验
以LNCaPNC细胞为空白对照组,LNCaPsh-KHSRP 细胞为敲低内源KHSRP的对照组,LNCaPsh-KHSRP-HA-KHSRP 细胞为敲低内源KHSRP后回复表达外源KHSRP的实验组进行LNCaP细胞的平板克隆实验。将LNCaP稳定细胞株计数后以每孔1×103个细胞的密度接种至6孔板中,培养2周,观察克隆长至肉眼可见程度后,将上层培养基吸除,加入无水甲醇固定15 min;弃去无水醇,加入2 mL 0.001%的结晶紫,于室温染色2~3 h;将结晶紫吸除,清水洗净后使用相机拍照并使用ImageJ软件对各孔全视野(直径35 mm)内的克隆进行计数。
1.7 小鼠成瘤实验
非肥胖糖尿病/重度联合免疫缺陷(non-obese diabetic/severe combined immunodeficient,NOD/SCID)小鼠和BALB/c裸鼠购自北京维通利华实验动物技术有限公司,动物生产许可证:SCXK(浙)2019-0001。将小鼠饲养于上海交通大学医学院附属第九人民医院浦东分院的无特定病原体(specific pathogen free,SPF)级动物实验室;动物使用许可证:SYXK(沪)2020-0025。将6只体质量20~24 g的NOD/SCID小鼠随机分为2组,每组3只;在每只NOD/SCID小鼠背部注射悬浮于100 μL PBS的1×106个LNCaP稳定细胞株。同样将6只体质量19~22 g的BALB/c裸鼠随机分为2组,每组3只;以相同方式注射1×105个DU145稳定细胞株。在第35日使所有小鼠颈椎脱臼以确保安乐死,解剖出所形成的瘤体,吸干表面液体后称重,并使用相机拍照记录瘤体大小。
1.8 转录组测序
使用TRIzol处理LNCaPsh-KHSRP 稳定细胞株和LNCaPsh-KHSRP-HA-KHSRP 稳定细胞株,各重复3份。将LNCaPsh-KHSRP 细胞作为对照组,LNCaPsh-KHSRP-HA-KHSRP 细胞作为实验组,将样品送至上海旭燃生物科技有限公司进行转录组测序(RNA sequencing,RNA-seq)。使用VAHTS Universal V6 RNA seq Library Prep Kit(NR604-02,南京诺唯赞生物科技股份有限公司)构建cDNA库,使用Illumina Nova seq6000平台进行RNA-seq。使用STAR程序,将RNA-seq结果与从Ensemble(版本98)检索并下载的人类转录组注释文件和从UCSC(University of California Santa Cruz)基因组浏览器检索并下载的人类基因组(版本hg38)进行比对。使用deseq2程序进行差异基因分析,并根据满足对照组LNCaPsh-KHSRP 细胞和实验组LNCaPsh-KHSRP-HA-KHSRP 细胞之间|log2倍数差异(fold change,FC)|≥0.2和P<0.05的差异表达范围,筛选2组之间的差异转录物。使用R软件包ClusterProfiler进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。将RNA原始数据存入NCBI数据库(GEO编号:GSE206486)以供访问。
1.9 RT-qPCR
使用TRIzol从LNCaP稳定细胞株中提取总RNA。按照说明书使用反转录试剂盒对1 μg总RNA进行反转录,获得10 μL cDNA。将cDNA稀释5倍后,配置包含10 μL SYBR Green,2 μL稀释后的cDNA,0.4 μL上、下游引物,7.6 μL无菌水的体系;充分混合后加至96孔板中,每孔20 μL,每组设置3个复孔。使用实时荧光定量PCR仪进行RT-qPCR,PCR反应条件为:95 ℃,30 s,共1个循环;95 ℃ 5 s,60 ℃ 30 s,共40个循环。使用GAPDH作为内参标定目的基因的表达量,采用公式2-ΔΔCT计算基因的相对表达水平。RT-qPCR所用引物序列见表2。
表 2 RT-qPCR 所用引物序列
Tab 2
| Primer | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| GAPDH | ATGAGGTCCACCACCCTGTT | CTCAAGGGCATCCTGGGCTA |
| ANK3 | GAAGATGCAATGACCGGGGA | AAAGCCCATGTAACCCTCTG |
| AR | GACGACCAGATGGCTGTCATT | GGGCGAAGTAGAGCATCCT |
1.10 蛋白质印迹法
使用SDS裂解液裂解DU145和LNCaP稳定细胞株,收集蛋白裂解液,使用SDS-PAGE电泳分离,转至PVDF膜上;5%脱脂奶粉室温封闭1 h后,按1∶1 000配置ANK3、KHSRP和AR的一抗,1∶5 000配置α-tubulin的一抗,4 ℃孵育过夜。次日TBST洗膜,按1∶5 000配置对应的二抗(KHSRP使用抗兔IgG二抗;α-tubulin、ANK3、AR使用抗小鼠IgG二抗)并室温孵育1 h,再次TBST洗膜后使用ECL发光液和超灵敏多功能成像仪显影。
1.11 公共数据来源及分析
从癌细胞系百科全书(Cancer Cell Line Encyclopedia,CCLE)数据库(
1.12 统计学分析
使用GraphPad Prism 8软件进行统计分析。定量资料以x±s表示,组间比较采用独立样本t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 KSHRP 对前列腺癌细胞增殖的体内外抑制
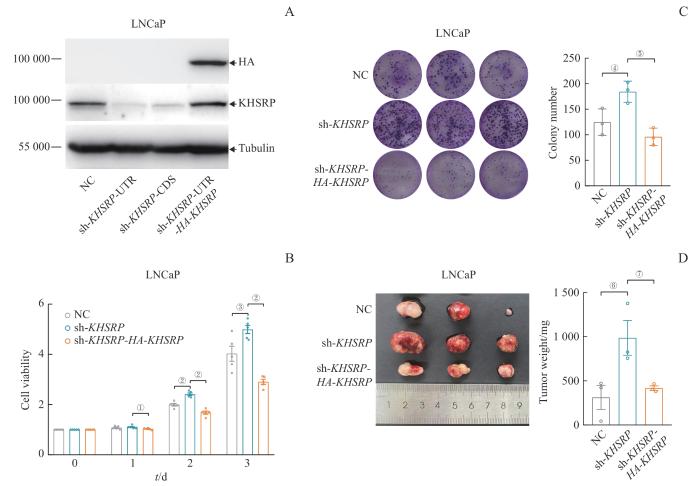
蛋白质印迹法(Western blotting)结果显示:LNCaPsh-KHSRP-UTR和LNCaPsh-KHSRP-CDS细胞中KSHRP蛋白表达量均降低;LNCaPsh-KHSRP-HA-KHSRP 细胞中KHSRP的表达有效回复(图1A)。选用LNCaPsh-KHSRP-UTR细胞作为敲低内源KHSRP表达的LNCaP细胞(LNCaPsh-KHSRP )进行后续实验。细胞增殖实验结果显示:KHSRP沉默后LNCaP细胞的相对细胞活力较LNCaPNC细胞升高;在LNCaPsh-KHSRP 基础上回复表达KHSRP后,细胞的相对活力降低(图1B)。平板克隆实验结果显示:与LNCaPNC细胞的克隆形成数相比,KHSRP功能缺失的LNCaP细胞的克隆形成数升高;重新获得KHSRP功能后,LNCaP细胞的克隆形成数相应减少(图1C)。小鼠成瘤实验结果显示,在NOD/SCD小鼠皮下注射LNCaPsh-KHSRP 细胞后成瘤质量高于LNCaPNC细胞和LNCaPsh-KHSRP-HA-KHSRP 细胞(图1D)。这些结果表明KHSRP可以在体内和体外抑制前列腺癌LNCaP细胞的增殖能力。
图1
图1
KHSRP 对LNCaP细胞增殖能力的影响
Note: A. Verification of KHSRP expression in stable LNCaP cell lines through Western blotting. B. Results of the cell proliferation assay in stable LNCaP cell lines.C. Results of the colony formation assay in stable LNCaP cell lines. D. Results of the mouse xenograft assay in stable LNCaP cell lines. ①P=0.044, ②P=0.000, ③P=0.022, ④P=0.036, ⑤P=0.004, ⑥P=0.047, ⑦P=0.045.
Fig 1
Impact of KHSRP on the proliferation of LNCaP cells
2.2 KHSRP 对前列腺癌对雄激素反应性的潜在影响
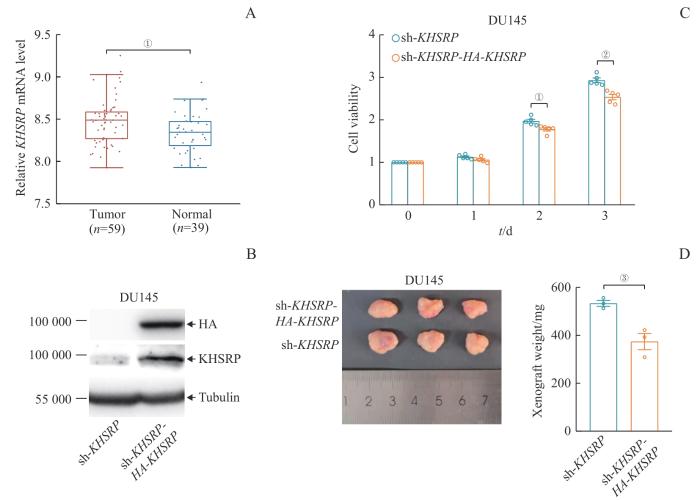
为了研究KHSRP在前列腺癌癌灶和癌旁组织中的表达情况,本研究通过GEO数据库(GSE32571)分析了59例前列腺癌和39例良性组织样本中KHSRP的表达水平。结果显示,KHSRP在前列腺癌组织中表达量高于正常组织(图2A),这提示KHSRP可能与前列腺癌的发生过程相关。为了排除内源性KHSRP的影响,后续研究选择LNCaPsh-KHSRP 细胞作为对照组,选择LNCaPsh-KHSRP-HA-KHSRP 细胞作为实验组,探索KHSRP过表达对前列腺癌增殖的调控作用。为了比较KHSRP对雄激素依赖型和非依赖型前列腺癌的影响是否存在差异,在DU145细胞中构建了DU145sh-KHSRP 和DU145sh-KHSRP-HA-KHSRP 稳定细胞株,Western blotting结果显示DU145sh-KHSRP-HA-KHSRP 细胞在DU145sh-KHSRP 细胞的基础上成功回复表达了KHSRP(图2B)。随后,通过对LNCaP及DU145稳定细胞株的细胞增殖实验的结果绘制柱状图比较分析,发现在DU145细胞中,过表达KHSRP同样可以抑制细胞的增殖能力(图2C);但相较于LNCaP细胞,这种抑制作用较弱(图1B)。小鼠成瘤实验结果也显示,过表达KHSRP使DU145细胞所形成的瘤体质量减轻(图2D),其减轻程度同样小于LNCaP细胞(图1D)。这些结果提示KHSRP可以抑制雄激素依赖型和非依赖型前列腺癌细胞的增殖能力。值得注意的是,KHSRP对LNCaP细胞的抑制作用强于DU145细胞,这种差异性可能与细胞系的特性有关。鉴于LNCaP细胞表达AR,而DU145细胞则缺少AR的表达,KHSRP对LNCaP细胞的调控作用可能与AR的参与相关。
图2
图2
KSHRP对DU145细胞增殖能力的影响
Note: A. Detection of KHSRP expression in 59 prostate cancers and 39 benign tissue samples. B. Verification of KHSRP expression in DU145 stable cell lines through Western blotting. C. Bar chart showing the results of the cell viability experiment in stable DU145 cell lines. D. Bar chart showing the tumor weight results of the mouse xenograft experiment in stable DU145 cell lines. ①P=0.012, ②P=0.001, ③P=0.011.
Fig 2
Effects of KHSRP on the proliferation of DU145 cells
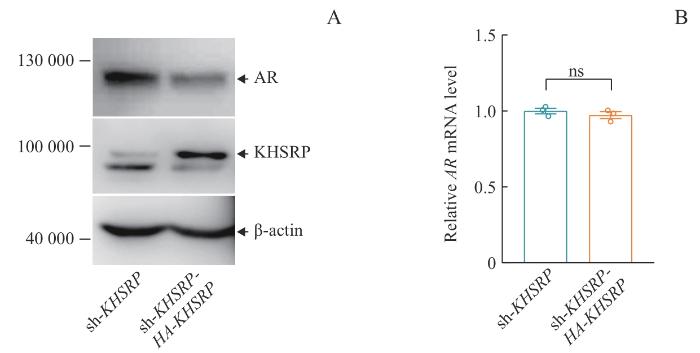
2.3 KHSRP 对前列腺癌细胞中AR表达量的影响
图3
图3
过表达 KHSRP 后LNCaP细胞中AR表达情况的检测
Note: A. Detection of AR protein expression in stable LNCaP cell lines through Western blotting. B. Detection of AR mRNA expression in stable LNCaP cell lines through RT-qPCR. ns—not significant.
Fig 3
Detection of AR expression in LNCaP cells with KHSRP overexpression
2.4 KHSRP 对前列腺癌细胞中 ANK3 表达量的影响
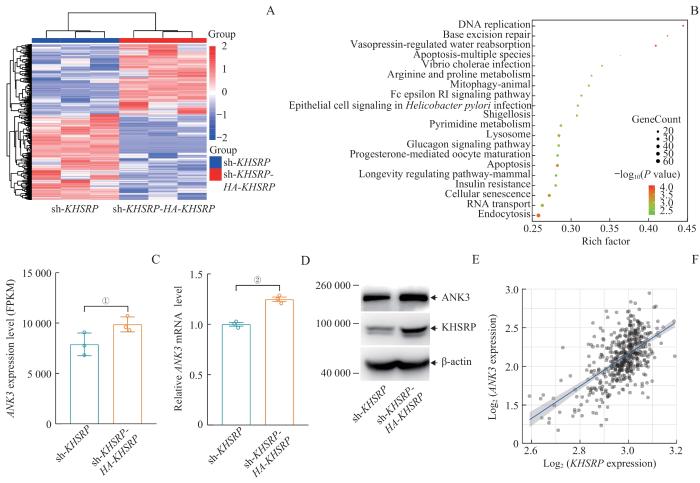
为深入了解KHSRP对AR的调控机制,通过RNA-seq检测LNCaPsh-KHSRP 细胞和LNCaPsh-KHSRP-HA-KHSRP 细胞间的差异基因,并进行KEGG富集分析。结果显示,LNCaP细胞中KHSRP功能重新获得后,存在20条富集差异基因的KEGG通路(图4A、B)。其中富集因子最高的2条通路为DNA复制和碱基切除修复(base excision repair,BER)通路。值得注意的是,RNA-seq结果中ANK3的mRNA表达量相应增加(图4C)。此前的研究已经指出在前列腺癌中ANK3可以影响AR的稳定性[6]。此外,AR可以通过调节转录影响DNA修复[7]。RT-qPCR检测结果同样显示KHSRP的回复表达提升了ANK3的mRNA水平(图4D)。Western blotting结果显示,LNCaPsh-KHSRP-HA-KHSRP 细胞中ANK3的表达量相较LNCaPsh-KHSRP 细胞明显增加(图4E)。对TCGA数据库中498例前列腺癌患者的RNA-seq数据分析结果显示,KHSRP与ANK3的mRNA表达量呈正相关(r=0.54,P=0.000;图4F)。这些结果提示KHSRP可能通过调节ANK3的表达量,间接调节AR的功能。
图4
图4
LNCaP细胞中 KHSRP 所调控基因的检测
Note: A. Heatmap of differentially expressed genes between LNCaPsh-KHSRPand LNCaPsh-KHSRP-HA-KHSRP stable cell lines based on RNA-seq. B. Bubble plot of KEGG enrichment analysis of differential genes between LNCaPsh-KHSRP and LNCaPsh-KHSRP-HA-KHSRP stable cell lines from RNA-seq. C. Bar chart showing the expression level of ANK3 in LNCaPsh-KHSRP and LNCaPsh-KHSRP-HA-KHSRP stable cell lines based on RNA-seq. FPKM—fragments per kilobase of transcript per million mapped reads. D. Detection of ANK3 mRNA expression in stable LNCaP cell lines through RT-qPCR. E. Detection of ANK3 protein expression in stable LNCaP cell lines through Western blotting. F. Analysis of the correlation between ANK3 and KHSRP expression levels in prostate cancer using the TCGA database.①P=0.010, ②P=0.001.
Fig 4
Detection of genes regulated by KHSRP in LNCaP cells
2.5 ANK3 与前列腺癌对雄激素的反应性及恶性程度的相关性
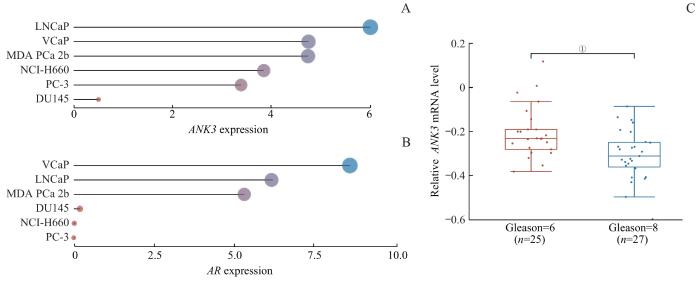
为了进一步验证ANK3与前列腺癌对雄激素反应性的关联,对CCLE数据库中6种前列腺癌细胞的基因表达数据进行分析。结果显示:在恶性程度较低且AR的mRNA水平较高的前列腺癌细胞株(如LNCaP、VCaP、MDA PCa 2b)中,ANK3的表达量相对较高;相反,在恶性程度较高且AR的mRNA水平较低的前列腺癌细胞株(如DU145、PC-3、NCI-H660)中,ANK3的表达量相对较低(图5A、B),进一步支持了ANK3可能通过对AR的调节影响前列腺癌的恶性程度。此外,使用GEO数据库(GSE15484)分析含有Gleason评分的52例前列腺癌患者的ANK3表达量,结果显示在恶性程度较高的前列腺癌(Gleason评分=8)组织样本中,ANK3的表达量低于恶性程度较低(Gleason评分=6)的前列腺癌组织样本(图5C)。这些结果提示ANK3可能与前列腺癌的恶性程度和对雄激素的反应性存在一定的内在关联。
图5
图5
ANK3 与前列腺癌组织和细胞的恶性程度的关联
Note:A. Relative expression levels of ANK3 mRNA in different prostate cancer cell lines. B. Relative expression levels of AR mRNA in different prostate cancer cell lines. C. Comparison of ANK3 mRNA levels in 25 low-grade (Gleason score=6) and 27 high-grade (Gleason score=8) prostate cancer tissues from the GEO database. ①P=0.004.
Fig 5
Correlation of ANK3 expression and malignancy of prostate cancer tissues and cells
3 讨论
KHSRP在转录后水平对基因的调节作用已被广泛报道。此前的研究[4]发现KHSRP可以通过调节miRNA成熟参与调控雄激素非依赖型前列腺癌的进展。同时,KHSRP还可以发挥调节mRNA降解的功能,如KHSRP可以通过与蛋白磷酸酶2催化亚基α(protein phosphatase 2 catalytic subunit α,PPP2CA)的mRNA的3′ UTR结合促进其降解,从而改变肾母细胞瘤的增殖能力[8]。此外,KHSRP也可以通过调节可变剪切参与基因表达的调控,影响单核细胞分化[9]。因此,在对恶性肿瘤的调控过程中,KHSRP可能通过不同的机制参与雄激素依赖型和非依赖型前列腺癌进展的调节。
本研究发现KHSRP可以抑制雄激素依赖型前列腺癌LNCaP细胞的增殖;TCGA数据库的分析结果显示KHSRP基因在前列腺癌组织中高表达。此前相关报道也指出抑癌基因可以在肿瘤组织中高表达,如抑癌基因同源框CUT样蛋白1(CUT-like homeobox 1,CUX1)在进展期癌症中表达升高[10]。在肿瘤发生过程中,癌基因和抑癌基因处在复杂的动态调控网络中。抑癌基因在癌灶中表达上调可能是细胞为了对抗癌变过程中的异常情况而采取的一种反应。在前列腺癌的发生过程中。累积的损伤因素可能导致了KHSRP的mRNA表达上调。此外,我们发现相较雄激素非依赖型前列腺癌DU145细胞,KHSRP对雄激素依赖型前列腺癌LNCaP细胞增殖的抑制作用更强。考虑到LNCaP细胞和DU145细胞间的主要差异是LNCaP细胞存在AR表达,而DU145细胞缺少AR的表达,我们推测KHSRP在前列腺癌中的功能可能与AR通路相关。
AR是前列腺癌发生发展过程中的关键调节因子;在疾病状态下,AR的表达升高,使得前列腺组织对雄激素刺激更为敏感,促进增殖相关的转录活动,从而驱动肿瘤进展[11]。多数前列腺癌患者在首次诊断时都可以采用雄激素剥夺治疗作为主要治疗手段[12]。然而,尽管大部分前列腺癌在治疗初期对去雄激素治疗有效,随着治疗时间的延长,前列腺癌最终仍难免发展为去势抵抗型。其机制复杂多样,其中最重要的机制之一为雄激素耗竭状态下AR的再激活;其可能原因包括去势抵抗型前列腺癌中AR的过表达,进而诱导低雄激素环境下AR信号通路的重新激活[13]。本研究发现KHSRP可以调控AR蛋白的表达量,这提示KHSRP可能在雄激素依赖型前列腺癌向非依赖型前列腺癌的转化过程中发挥重要作用。
然而,我们尚未发现KHSRP调节ANK3的mRNA表达量的具体机制。ANK3的3′ UTR缺少KHSRP介导其mRNA降解调控所需要的富含AU的元件,同时KHSRP也未对ANK3的mRNA降解速率产生影响,因此KHSRP可能通过影响ANK3的可变剪切等方式调节其表达。我们发现ANK3可以降低AR的稳定性,但在ANK3高表达的前列腺癌细胞中,AR的mRNA表达量升高,这似乎与我们的结论相悖。我们推测AR蛋白质表达量的降低通过负反馈调节减少了mRNA的表达量。这些缺陷和不足有待在后续的实验中进一步完善和补充。
综上所述,本研究首次发现KHSRP可以通过ANK3间接调节AR的表达,从而调节前列腺癌对雄激素的反应性。通过深入研究KHSRP-ANK3-AR调控轴,可能为延缓激素敏感型前列腺癌向去势抵抗型前列腺癌的转变提供新的思路。
作者贡献声明
徐明设计并指导整个课题研究;蔡人杰参与实验设计并完成所有实验;蔡人杰和徐明参与论文的写作与修改。两位作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed and supervised by XU Ming. CAI Renjie participated in the research design and performed all experiments. The manuscript was drafted and revised by XU Ming and CAI Renjie. Both authors have read the last version of the manuscript and consented to submission.
利益冲突声明
两位作者声明不存在利益冲突。
COMPETING INTERESTS
Both authors disclose no relevant conflict of interests.
参考文献