胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是消化系统中最为致命的恶性肿瘤之一,其临床表现通常隐匿,疾病进展迅速,导致患者预后极其不佳,5年生存率不足10%[1-3]。统计数据显示,胰腺癌患者术后平均无病生存期仅为7.8个月,超过80%的PDAC患者在手术期间未发现有远处转移的证据,但术后仍有可能在胰腺原位或远程脏器发生肿瘤复发或转移[4-7]。这一现象表明,尽管这些患者在术前已符合手术条件,他们体内的肿瘤细胞可能已经发生了远处转移并处于休眠状态,这些休眠的肿瘤细胞可能在术后一段时间内于特定条件下被激活,重新进入细胞周期,引起肿瘤的再次增长[8-10]。
尽管肿瘤休眠的概念受到众多关注,但目前由于缺乏广泛认可的实验模型,导致关于其机制的理解仍然停留在假设阶段。肿瘤团块休眠假说提出,由于新生血管不足、营养供给不足,或免疫系统的干预,肿瘤细胞的增殖与死亡达到一种动态平衡。另一方面,肿瘤细胞休眠假说认为,在肿瘤的早期进展中,有肿瘤细胞从原发肿瘤中脱落,进入血液循环并播散到远端器官,这些细胞被称为播散性肿瘤细胞(disseminated tumor cell,DTC)。大多数DTC在新环境的不利条件下被清除,而少数能够进入休眠状态的DTC(<20个细胞)以单个或小团簇形式存在[9,11]。这些休眠肿瘤细胞(dormant cancer cell,DCC)的细胞周期停留在G0期,其核酸代谢和细胞周期活动水平降低,因此对周期特异性化疗药物不敏感。此外,DCC通过下调肿瘤标志物的表达,以及减少自然杀伤细胞[12](natural killer cell,NK细胞)激活配体和主要组织相容性复合物Ⅰ类分子的表达,有效隐藏自身以规避NK细胞和T细胞的识别[13-16]。在特定条件下,DCC可能被激活,重启细胞周期[13-14,17],这一过程被认为是肿瘤治疗后复发和转移的主要原因[4-7]。
mVenus-p27K-细胞G0期指示系统包括2个融合表达的蛋白组分:mVenus荧光蛋白和p27K-突变体。p27蛋白通常在细胞G0期高度富集,通过抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)的活性来阻止细胞周期进展,并在G1期通过泛素化途径降解。与CDK结合的结构域突变的p27突变体p27K-能够与CDK结合但不能抑制其活性,可以在不影响细胞周期正常进程的前提下,提示G0到G1期的转换。利用mVenus-p27K-标记,可通过荧光在G0期细胞核内显现、G1期消失直观地监测肿瘤细胞是否处于休眠状态。这一系统为识别并研究DCC提供了一种有效的实验工具。DTR-HSV/TK系统可在特定条件下触发细胞的自杀程序[22-23]。转染HSV/TK系统的细胞内表达单纯疱疹病毒的胸苷激酶(thymidine kinase,TK),这种酶可以将无毒的更昔洛韦(ganciclovir,GCV)转化为致命的代谢产物,进而引起细胞死亡。同时,转染DTR系统的细胞会表达白喉毒素受体(diphtheria toxin receptor,DTR),该受体与白喉毒素(diphtheria toxin,DTX)结合后促使细胞凋亡。转染Luc2-tdTomato系统的细胞能够同时表达tdTomato红色荧光蛋白和萤火虫荧光素酶(firefly luciferase),这2种蛋白质使得细胞在体内外环境中均可被示踪,便于肿瘤细胞的追踪和研究。
本研究依托于目前学术界普遍认同的肿瘤休眠假说,通过一系列实验,构建一个特征为无明显转移灶而仅展现散在肿瘤休眠灶的C57BL/6小鼠模型。实验首先通过向小鼠侧腹部注射KPC1199-PDL细胞,诱导皮下肿瘤形成。随后,通过腹腔注射GCV和DTX,实现皮下肿瘤的靶向消融。经小动物活体成像技术筛选,将肿瘤完全消融的小鼠作为预免疫模型。在此模型基础上,通过脾脏注射KPC1199-PDL细胞,进一步构建肿瘤细胞在肝脏散在休眠的模型。借助于活体成像技术及肝脏组织的免疫荧光分析,评估肿瘤细胞在肝脏转移及休眠的情况。
该模型的建立为肿瘤休眠状态的机制研究提供了一个创新平台,有助于深入探讨DCC的生物学特性、肿瘤休眠与复苏的分子机制,以及DCC在体内扩散后与目标器官微环境间的相互作用。此外,对机制的了解使得针对DCC的靶向治疗策略开发成为可能,从而为肿瘤临床治疗提供科学依据和新的治疗方向。
1 材料与方法
1.1 主要试剂及仪器
mVenus-p27K-质粒(编号:176651;Addgene,美国),慢病毒包装辅助质粒psPAX2、包膜载体pMD2.G均为本实验室保存。
DMEM培养液、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗(Gibco,美国),嘌呤霉素(puromycin)、杀稻瘟菌素S(blasticidin S)、遗传霉素(geneticin)(上海碧云天生物技术有限公司),GCV(Sigma-Aldrich,德国),DTX(List Biologicals,美国),TRIzol试剂、PrimeScript™ RT Master Mix(TaKaRa,日本),2×Universal Blue SYBR Green qPCR Master Mix(武汉赛维尔生物科技有限公司),D-荧光素钠盐(D-luciferin)[翌圣生物科技(上海)股份有限公司],CCK-8(cell counting kit-8)试剂(上海圣尔生物科技有限公司),tdTomato抗体(Rockland,美国),mVenus抗体、Alexa Fluor 488标记二抗、Alexa Fluor 555标记二抗、Alexa Fluor 647标记二抗(Abcam,英国),细胞核染料DAPI、增殖标志物Ki67抗体(武汉赛维尔生物科技有限公司)。DTR-HSV/TK慢病毒液、Luc2-tdTomato慢病毒液由和元生物技术(上海)有限公司合成。实时荧光定量PCR(quantitative real-time PCR,qPCR)引物由北京擎科生物科技股份有限公司上海分公司合成。
qPCR核酸扩增仪(ABI,美国),CM3050S冰冻切片机(Leica,德国),THUNDER高分辨显微镜(Leica,德国),BD FACSAria Ⅲ流式细胞分选仪(BD Biosciences,美国),IVIS Lumina Series Ⅱ小动物活体光学成像系统(PerkinElmer,美国)。
1.2 细胞培养
小鼠PDAC细胞系KPC1199和人肾上皮细胞系293T细胞在上海市肿瘤研究所保存。细胞培养标准遵循美国模式菌种保藏中心(American Type Culture Collection,ATCC)要求,采用DMEM培养液,其中均添加10% FBS和1%青霉素-链霉素双抗,所有细胞均保存在37 ℃、5% CO2的恒温培养箱中。
1.3 实验动物
雄性野生型小鼠C57BL/6 30只,6~8周龄,购自杭州子源实验动物科技有限公司,实验动物生产许可证号为SCXK(浙)2019-0004。小鼠饲养于上海交通大学实验动物中心的SPF屏障设施中,温度(22±2)℃,12 h/12 h明暗交替,小鼠自由饮食;实验动物使用许可证号为SYXK(沪)2023-0042。实验结束后采用CO2吸入法处死小鼠。
1.4 慢病毒生产
将mVenus-p27K-质粒与psPAX2、pMD2.G共转染至293T细胞中。转染后48 h和72 h从上清液中收集慢病毒。
1.5 稳转株构建及筛选
1.5.1 KPC1199-(mVenus-p27K-)稳转株构建
将处于对数生长期的KPC1199细胞以每毫升2×105个的密度接种于6孔板中,随后在孔中添加mVenus-p27K-慢病毒液进行转染,慢病毒感染复数(multiplicity of infection,MOI)为10,转染72 h后在浓度为10 μg/mL的嘌呤霉素下筛选5 d,并在浓度为3 μg/mL的嘌呤霉素中维持,完成KPC1199-(mVenus-p27K-)稳转株的筛选。
1.5.2 KPC1199-(mVenus-p27K-)-(DTR-HSV/TK)稳转株构建
将处于对数生长期的KPC1199-(mVenus-p27K-)稳转株以每毫升2×105个的密度接种于6孔板中,随后在孔中添加DTR-HSV/TK慢病毒液进行转染,慢病毒MOI为10,转染72 h后在浓度为1 000 μg/mL的遗传霉素下筛选5 d,并在浓度为300 μg/mL的遗传霉素中维持,完成构建KPC1199-(mVenus-p27K-)-(DTR-HSV/TK)稳转株。
1.5.3 KPC1199-PDL稳转株构建
将处于对数生长期的KPC1199-(mVenus-p27K-)-(DTR-HSV/TK)稳转株以每毫升2×105个的密度接种于6孔板中,随后在孔中添加Luc2-tdTomato慢病毒液进行转染,慢病毒MOI为10,转染72 h后在浓度为15 μg/mL的杀稻瘟菌素S下筛选7 d,并在浓度为5 μg/mL的杀稻瘟菌素S中维持,完成构建KPC1199-PDL稳转株,并通过流式细胞荧光分选技术分选出红色荧光蛋白(tdTomato)高表达的稳转株。通过荧光素酶活性检测实验和活细胞荧光成像进一步验证稳转株蛋白表达功能正常。获得的细胞株用于后续体外、体内实验。
1.6 CCK-8细胞增殖实验
将KPC1199、KPC1199-(mVenus-p27K-)、KPC1199-(mVenus-p27K-)-(DTR-HSV/TK)和KPC1199-PDL细胞接种于96孔板中,密度为2×103个/孔,在37 ℃、5%CO2的恒温培养箱中培养。分别在接种的第0、24、48、72、96小时取部分细胞,将原先的培养液更换为含10% CCK-8试剂的新鲜培养液,继续在培养箱中反应1 h,随后在450 nm波长条件下用酶标仪测量吸光度值。
1.7 GCV和DTX药物敏感性实验
将KPC1199和KPC1199-PDL接种于96孔板中,密度为1×104个/孔,然后用0(阴性对照)、0.01、0.1、1、10、100 µg/mL GCV或0(阴性对照)、0.1、1、10、100、1 000 ng/mL DTX梯度处理,并在37 ℃、5%CO2的恒温培养箱中培养。处理72 h后,更换为含10% CCK-8试剂的新鲜培养液,继续在培养箱中反应1 h,随后在450 nm波长条件下用酶标仪测量吸光度值。
1.8 qPCR
使用TRIzol试剂从细胞中提取总RNA,使用PrimeScript™ RT Master Mix合成cDNA后进一步通过qPCR检测G0期相关基因的表达水平,包括表观遗传修饰相关基因赖氨酸脱甲基酶5B(lysine demethylase 5B,Kdm5b)、赖氨酸脱甲基酶6B(lysine demethylase 6B,Kdm6b)和赖氨酸脱甲基酶7A(lysine demethylase 7A,Kdm7a)[19],细胞代谢相关的基因异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,Idh1)、DNA损伤诱导转录物4(DNA damage inducible transcript 4,Ddit4)和核因子2(NFE2 like bZIP transcription factor 2,Nrf2),肿瘤抑制相关基因程序性细胞死亡4(programmed cell death 4,Pdcd4)和ERBB2的转导子1(transducer of Erbb2.1,Tob1),和细胞周期调控相关基因yippee样蛋白2(yippee like 2,Ypel2)。同时检测增殖标志物Ki-67(marker of proliferation Ki-67,Mki67)基因的表达情况。以β-肌动蛋白(β-actin)作为内参对照,mRNA水平采用
表1 qPCR引物序列
Tab 1
| Gene | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| Kdm7a | GATAAGTAATGGCAGCCTGAGC | AGCTCTGTCACACGAAGAAG |
| Kdm5b | AATACCTGGATAGTGGCTGG | TCCAGTGGTCTTCAATGTGC |
| Kdm6b | GTCCATTGTGCCCATGATTC | GTCGCATTCGTTGCAGTAGTAG |
| Pdcd4 | AAGCGGAAAGACAGTGTGTG | GGCTTCATATACAAGCTCGTGG |
| Tob1 | TCCTGAAGCAGAAAGCCATC | TTGGCATTGGGAGAAAGAGC |
| Idh1 | CATGTACCAGAAAGGGCAAGAG | TAATGCAAGCAGCCAAGTCC |
| Ddit4 | ACCTTTCAGTTGACCCTGGTG | TGTAACCAGGGACCAAGGAAG |
| Nrf2 | CGAGATATACGCAGGAGAGGTAAG | CAGTAGATGGAGGTTTCTGTCG |
| Ypel2 | CAGTAGTTAATGTGGGCTGTGG | TGGATGCTATCAGGTCAGTC |
| Mki67 | CCTTGGCTTAGGTTCACTGTCC | TGCAGAATCCAGATGATGGAGC |
| β-actin | GGCTGTATTCCCCTCCATCG | CCAGTTGGTAACAATGCCATGT |
1.9 预免疫小鼠的构建
首先,利用异氟醚进行全身麻醉,随后采用外科剪切法去除实验小鼠的右侧腹部体毛。通过皮下注射5×105个KPC1199-PDL细胞,诱导肿瘤在小鼠体内生长,观察期为5 d。为实现肿瘤目标的消融,第5日和第6日在皮下瘤原位注射GCV(剂量为5 µg/g),第7日和第8日注射DTX(剂量为25 ng/g)。随后,采用生物发光成像技术对皮下肿瘤的消融情况进行评估,选择肿瘤完全消融的小鼠作为预免疫模型进行后续实验。
1.10 流式细胞荧光分选
首先采用胰蛋白酶对细胞消化处理3 min,随后立即添加中止消化的缓冲液。接着以500×g离心5 min,弃去上清液,将细胞重悬于经过预冷的PBS中(含1%FBS),以保持细胞活性。之后,用孔径40 μm的细胞过滤器过滤细胞悬液2次,确保获得单细胞悬液,从而优化细胞分选的效率。流式细胞分选仪配备80 μm喷嘴。根据细胞的前向散射和侧向散射特性设定门控策略,进行初步筛选,利用脉冲宽度排除聚集的细胞或双细胞事件,确保分选的纯度和准确性。细胞分选基于tdTomato和mVenus荧光蛋白的表达模式,将细胞分为2个群体:增殖状态的细胞(表现为tdTomato阳性、mVenus阴性)和休眠状态的细胞(同时表达tdTomato和mVenus)。
1.11 小鼠肝脏组织样本收集及冰冻切片制备
用异氟烷麻醉小鼠,通过左心室灌流20 mL PBS,然后用4%多聚甲醛灌流20 mL,立即取出肝脏并置于4%多聚甲醛中过夜,于20%蔗糖溶液和30%蔗糖溶液中分别沉糖脱水24 h。沉糖脱水后的肝脏用OCT包埋剂包埋并快速液氮冷冻,使用冰冻切片机制作连续组织切片(厚度10 μm)后置于-80 ℃冰箱保存。
1.12 免疫荧光法
冰冻切片在室温下用PBS冲洗,并用含0.3% Triton X-100的PBS透化10 min,PBST洗涤3次,每次5 min;在含10%正常山羊血清、22.52 mg/mL甘氨酸的PBST中室温封闭1 h,然后分别加入一抗(mVenus抗体1∶2 000,tdTomato抗体1∶1 000,Ki67抗体1∶500)在湿盒中4 ℃过夜孵育。次日,用PBST洗涤3次,每次5 min,然后用对应的荧光二抗(Alexa Fluor 488标记二抗1∶1 000、Alexa Fluor 555标记二抗1∶500、Alexa Fluor 647标记二抗1∶500)避光孵育细胞1 h。用PBST避光洗涤3次,每次5 min;用2 μg/mL DAPI孵育5 min,用PBST避光洗涤3次,每次5 min,用抗荧光淬灭封片剂封片。切片在高分辨显微镜下观察。
1.13 经脾-门静脉-肝转移模型的构建
用异氟醚麻醉小鼠后,在左侧肋下区域做一条约1 cm长的切口,暴露脾脏。随后,将1×106个KPC1199-PDL细胞重悬于25 μL的PBS,并精确注射入脾脏实质内。注射完成后约10 min,进行脾脏切除手术,以防止细胞在脾脏外的其他位置生长,进而确保肿瘤细胞仅通过脾-门静脉系统转移到肝脏。手术完成后,用5-0号可吸收性手术缝合线缝合腹膜和皮肤切口。
1.14 生物发光成像
用异氟醚麻醉小鼠后,在腹腔内注射100 μL的D-luciferin(浓度为30 mg/mL)。注射14 min后,使用小动物光学成像系统对小鼠进行生物发光成像,以评估和记录肿瘤细胞的活性及其在体内的分布情况。
1.15 统计学分析
实验数据均通过GraphPad Prism 9.0和Microsoft Excel 2019(Version 16.0)软件进行统计处理和分析。定量资料以x±s表示。组间比较根据数据分布特性和比较需求采用t检验、单因素方差分析或双因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
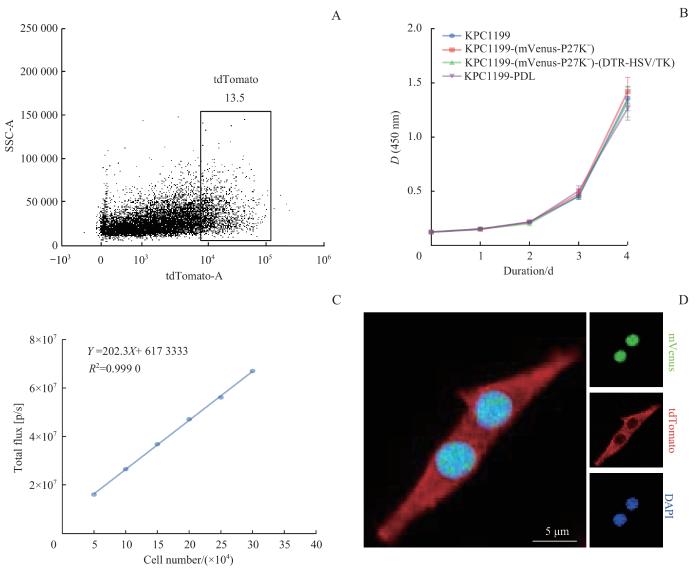
2.1 KPC1199-PDL稳转株构建
图1
图1
KPC1199-PDL稳转株的构建及验证
Note: A. KPC1199-PDL cells with high tdTomato expression sorted by flow cytometry. B. KPC1199 cells proliferation ability measured by CCK-8 assay after multiple viral transfections. C. In vitro validation of luciferase activity in KPC1199-PDL cells by bioluminescence. D. Live cell imaging of a KPC1199-PDL cell (×2 000).
Fig 1
Construction of KPC1199-PDL cell strain
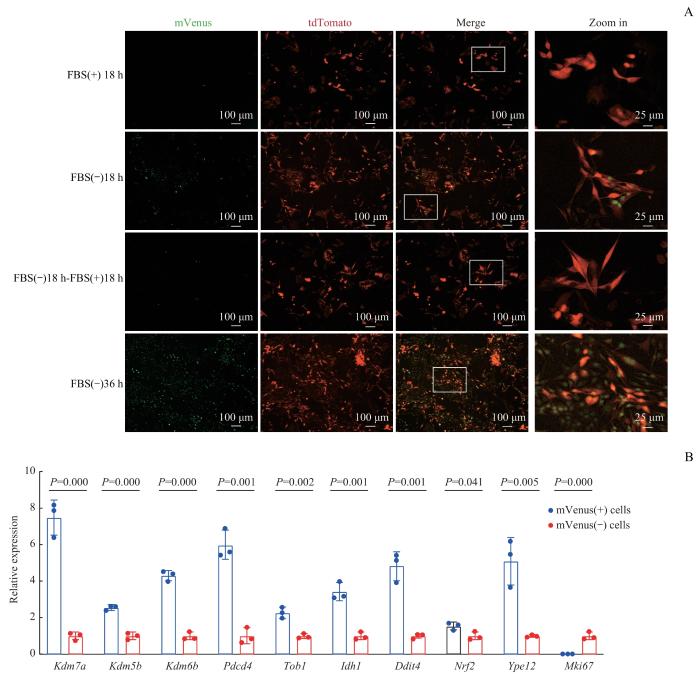
2.2 mVenus-p27K-细胞G0 期指示系统的体外功能验证
通过将细胞在血清饥饿(无血清)条件下培养18 h来模拟细胞进入G0期的环境,观察结果显示,血清饥饿处理的细胞群展现出较高水平的mVenus荧光信号,且信号主要定位于细胞核内;而在对照组(未进行血清饥饿处理)中,细胞核内mVenus荧光信号较弱。将血饥饿细胞重新在含10%血清的培养基中培养18 h后,观察到mVenus荧光信号显著减少,而在持续血清饥饿36 h的细胞中,mVenus荧光信号进一步增强(图3 A)。
图2
图2
mVenus-p27K-细胞G0 期指示系统体外功能验证
Note: A. Fluorescence images of KPC1199-PDL cells with or without serum starvation (left three lanes, ×100; right lane, ×400). B. Expression of G0 phase-related genes and Mki67 in mVenus (+) and mVenus (-) KPC1199-PDL cells measured by qPCR (n=3).
Fig 2
Functional validation of mVenus-p27K- G0 phase indicator system in vitro
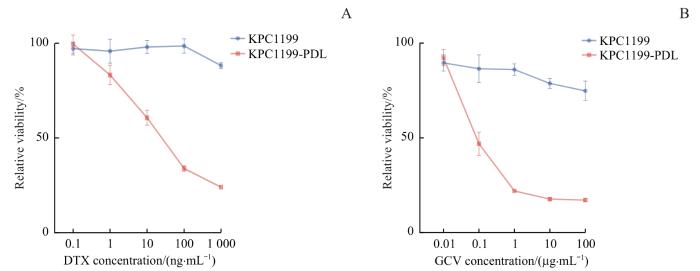
图3
图3
DTR-HSV/TK自杀基因系统体外功能验证
Note: Toxicity of DTX (A) and GCV (B) to KPC1199-PDL cells measured by CCK8 assay.
Fig 3
Functional validation of DTR-HSV/TK suicide gene system in vitro
通过流式细胞术分选出mVenus(+)和mVenus(-)的KPC1199-PDL细胞,随后通过qPCR分析了G0期相关基因的表达水平。结果显示,mVenus(+)细胞G0期相关基因显著高表达(均P<0.05),而增殖相关基因Mki67显著低表达(P<0.05)(图2B)。这些结果表明mVenus-p27K-在KPC1199-PDL细胞中的功能正常,能够准确指示肿瘤细胞是否处于G0期。
2.3 DTR-HSV/TK自杀基因系统体外功能验证
将KPC1199细胞野生型和KPC1199-PDL稳定表达株细胞分别暴露于不同浓度的GCV和DTX中,并持续培养72 h,CCK-8实验结果表明,与野生型细胞相比,KPC1199-PDL细胞对GCV和DTX展现出显著的敏感性,且此反应具有明显的剂量依赖性(图3)。
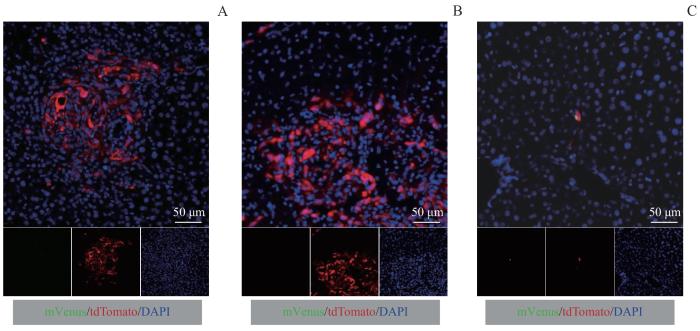
2.4 KPC1199-PDL细胞在体功能验证
在野生型C57BL/6小鼠中构建经脾-门静脉-肝转移模型,利用免疫荧光技术对肝脏切片进行分析,以验证KPC1199-PDL细胞在体内的功能。观察结果表明,KPC1199-PDL细胞在小鼠肝脏中形成了大小不一的转移灶(图4A、B),这些转移灶可以通过tdTomato蛋白进行有效示踪,且无显著mVenus蛋白表达。进一步分析发现,在肝脏切片中可以观察到共表达tdTomato和mVenus蛋白,即处于G0期的DCC(图4C)。这些结果证明,在动物模型中,KPC1199-PDL细胞的tdTomato蛋白能够用于追踪肿瘤细胞的转移和定位,mVenus蛋白的表达可以作为标记细胞处于G0期休眠状态的可靠指标。
图4
图4
KPC1199-PDL细胞在动物实验中的功能验证
Note: Immunofluorescence images of hepatic sections in the murine model of spleen-portal vein-liver metastasis (×200). A/B. Metastasis niches comprises several proliferating cancer cells. C. A single DCC.
Fig 4
Functional validation of KPC1199-PDL cells in vivo
2.5 构建休眠肿瘤小鼠模型
在C57BL/6小鼠的侧腹部皮下注射KPC1199-PDL细胞,消融组小鼠在第5和第6日肿瘤原位注射GCV,在第7和第8日注射DTX,以诱导肿瘤的消融,未消融组小鼠肿瘤原位注射等体积PBS。分别在细胞注射后的第2、第4和第10日,通过生物发光成像技术监测肿瘤细胞的生长和分布情况。相比未消融组,消融组皮下肿瘤明显缩小,皮下肿瘤彻底消融的小鼠即为预免疫小鼠(图5A、B)。
图5
图5
在预免疫小鼠中构建休眠肿瘤小鼠模型
Note: A. Bioluminescence imaging results of subcutaneous KPC1199-PDL tumors in the untreated group and the treated group (GCV+DTX) at different time points. B. Quantitative analysis of bioluminescence imaging intensity at different time points in the untreated group and the treated group. (The dashed gray line represents the background luminescence in tumor-free mice). C. Bioluminescence imaging results of the control group and the PIM group at different time points. D. Quantitative analysis of bioluminescence imaging intensity at different time points in the control group and the PIM group. (The dashed gray line represents the background luminescence in tumor-free mice). E/F. Images of a single DCC (E) and a small cluster of DCCs (F) (×100).
Fig 5
Establishment of dormant cancer model in preimmunized mice
这些结果表明,通过预免疫策略结合mVenus-p27K-细胞G0期指示系统、DTR-HSV/TK自杀基因系统和Luc2-tdTomato示踪系统,成功构建了一个无明显肝脏转移灶,只含少量散在休眠肿瘤细胞的可识别、可示踪的小鼠肝转移模型。
3 讨论
本研究将KPC1199-PDL注射于C57BL/6小鼠皮下,可激活小鼠的免疫系统,使小鼠的免疫系统识别KPC1199-PDL、获得对KPC1199-PDL的杀伤能力,而后使用DTX和GCV诱导小鼠体内的KPC1199-PDL细胞自杀,即得到预免疫小鼠。利用预免疫小鼠构建经脾-门静脉-肝转移模型,在切除脾脏后小鼠体内仅存少量的肿瘤细胞,利用mVenus-p27K-系统指示细胞周期,确认小鼠体内的肿瘤细胞进入了G0期,符合肿瘤细胞休眠学说。因此,本课题所构建的模型是用于研究肿瘤休眠的理想模型。
肿瘤休眠学说提出,DCC将在一段时间内保持数量的稳定;而预免疫小鼠的经脾-门静脉-肝转移模型中,小鼠体内存留的肿瘤细胞非常稀少。因此,本课题所构建的KPC1199-PDL中还装载了Luc2-tdTomato系统,有利于肿瘤细胞的示踪,开展后续的研究工作。
在小鼠肿瘤原位模型和肝转移模型中,也能观察到少量散在的DCC;但这2种小鼠模型的生存周期短,肿瘤灶中以增殖期细胞为主,肿瘤进展迅速,并且在终末期会对小鼠产生系统性的影响。因此均无法模拟无疾病生存期患者体内的DCC状态,不是用于研究肿瘤休眠机制的理想模型。
本课题所构建的小鼠模型有利于展开对DCC的相关机制研究,具有重要临床意义。在综合治疗时,抑制肿瘤细胞进入休眠状态,可提高综合治疗杀伤肿瘤细胞的效率;DCC在无疾病生存期内发展出了对原先综合治疗手段的抵抗能力,探究其中的分子机制可以帮助开发新的药物或优化现有治疗方案;在综合治疗后,规避DCC苏醒的诱因,将肿瘤细胞维持在休眠状态,可延长患者的无疾病生存时间,提高患者的生存质量。
作者贡献声明
木司塔巴·木台力甫、张志刚、李冬雪参与实验设计,木司塔巴·木台力甫、王俊杰、钱云臻完成实验操作,木司塔巴·木台力甫、王俊杰、钱云臻、邵达、陈溯源、张志刚、李冬雪参与论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by Musitaba MUTAILIFU, ZHANG Zhigang and LI Dongxue.The experimental operation was completed by Musitaba MUTAILIFU, WANG Junjie and QIAN Yunzhen. The manuscript was drafted and revised by Musitaba MUTAILIFU, WANG Junjie, QIAN Yunzhen, SHAO Da, CHEN Suyuan, ZHANG Zhigang and LI Dongxue. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献