白介素-1β(interleukin-1β,IL-1β)是IL-1家族中的强效促炎细胞因子,主要由髓系细胞及部分非髓系细胞(如上皮细胞)分泌[5]。在经典炎性小体中,caspase-1作为主要效应性半胱天冬酶,切割pro-IL-1β,去除前肽后形成成熟IL-1β[6]。在脓毒症中,IL-1β的升高与病程严重性密切相关。脓毒症死亡患者的血浆IL-1β水平显著高于幸存者[7],且脓毒症休克患者的血清NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor family pyrin domain-containing 3,NLRP3)水平高于非休克组。NLRP3激活介导的IL-1β释放促进脓毒症心肌病的发病[8]。NLRP3炎性小体是由受体蛋白NLRP3、衔接蛋白凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和效应蛋白caspase-1组成的胞内复合物,广泛参与脓毒症及其他炎症反应的调节[9]。然而,IL-1β及炎性小体在OMSI中的作用尚不明确。
本研究分析IL-1β对OMSI严重程度的预测作用,并利用单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)技术对患者免疫细胞转录的改变进行挖掘,探讨OMSI感染加重过程中患者免疫细胞功能的差异,以期为严重OMSI的预防及治疗提供参考。
1 对象和方法
1.1 研究对象
选取自2023年1—11月就诊于上海交通大学医学院附属第九人民医院口腔外科的OMSI初诊患者。纳入标准:临床症状及CT增强确诊为OMSI的患者。排除标准:①外院抗炎治疗或手术史。②继发于肿瘤的感染。③处于妊娠期。④病历资料不完整。另外,招募愿意接受qPCR和Western blotting检测的健康志愿者作为对照。纳入标准:过去1个月内无感染性疾病史,且无用药史。对于进行scRNA-seq的患者,要求既往体健,无系统性疾病(自身免疫系统疾病、糖尿病、肝炎等)。
1.2 患者分级及实验室检查
患者分级标准依照课题组先前的研究:①中度感染:单一间隙感染,脓腔直径在3~6 cm间,脓肿未跨越中线。②重度感染:涉及2个或多个间隙,脓腔高于舌骨水平。③极重度感染:跨越中线的多间隙感染,深颈部感染,并发下行性坏死性纵隔炎,颈部坏死性筋膜炎[10]。患者入院取血2 h内进行实验室检查,指标为白细胞(white blood cell,WBC)计数,中性粒细胞绝对值(absolute neutrophil count,ANC),C反应蛋白(C-reactive protein,CRP),降钙素原(procalcitonin,PCT),血清血糖和IL-1β。
1.3 主要试剂和仪器
人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离液(Solarbio,北京),RNA提取试剂盒(湖南艾科瑞生物工程有限公司),反转录试剂盒(Takara,日本),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)试剂(Takara,日本),RIPA裂解液、5×SDS上样缓冲液(上海碧云天生物技术股份有限公司),一抗NLRP3、caspase-1、β-actin(Cell Signaling Technology,美国),一抗ASC(Abcam,英国),一抗IL-1β(武汉三鹰生物技术有限公司),LightCycler® 96仪(Roche,瑞士),高速离心机(Eppendorf,德国)和化学发光成像仪(Bio-RAD,美国)。
1.4 实验方法
1.4.1 人PBMC分离
分别抽取健康志愿者,中度、重度和极重度感染患者全血,于2 h内使用分离液对其进行PBMCs分离。根据试剂说明操作,离心所得的白膜层为PBMCs。
1.4.2 RNA的提取、反转录和qPCR
按照试剂说明提取健康志愿者,中度、重度和极重度感染患者(各6名)的PBMCs的RNA,保存于-80 ℃。按照反转录试剂盒的体系,每10 μL反转录反应中使用400 ng RNA,合成的cDNA与PCR试剂及引物混合,按照说明进行PCR反应。mRNA的相对表达量通过
表1 qPCR引物序列
Tab 1
| Gene | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| NLRP3 | CGTGAGTCCCATTAAGATGGAGT | CCCGACAGTGGATATAGAACAGA |
| NLRP1 | GGCAGCACAGATCAACATGGA | CAGGTTTCTGGTGACCTTGAGGA |
| AIM2 | TCAAGCTGAAATGAGTCCTGC | CTTGGGTCTCAAACGTGAAGG |
| CASP1 | CCTTAATATGCAAGACTCTCAAGGA | TAAGCTGGGTTGTCCTGCACT |
| ASC | TGGATGCTCTGTACGGGAAG | CCAGGCTGGTGTGAAACTGAA |
| GAPDH | GGAGCGAGATCCCTCCAAAAT | GGCTGTTGTCATACTTCTCATGG |
1.4.3 Western blotting检测
每1×106个PBMCs中加入200 μL RIPA裂解液,冰上裂解15 min后提取蛋白质,BCA法测蛋白浓度。5×SDS上样缓冲液制备蛋白样品,金属浴100 ℃、5 min。每孔蛋白上样量20 ng。使用10% SDS-PAGE凝胶分离蛋白、PVDF膜转膜、5%脱脂奶粉封闭1 h,一抗(NLRP3、caspase-1、ASC、IL-1β和β-actin)按照1∶1 000稀释,4 ℃孵育过夜,兔二抗1∶10 000稀释,室温孵育1.5 h后显影成像。
1.4.4 单细胞样本处理与cDNA文库构建
2名健康对照的PBMC测序数据(GSE224198)从基因表达综合数据库(Gene Expression Omnibus,GEO;
1.4.5 单细胞数据分析
使用Cell Ranger软件(10×Genomics)获取表达矩阵,随后使用R语言(版本4.4.2)和Seurat(版本5.1.0)进行下游分析。质控标准:①除去含有超过6 000个或少于200个表达基因的细胞。②除去线粒体基因比例超过10%的细胞。③除去血红蛋白超过5%的细胞。基因表达数据使用NormalizeData函数进行标准化并进行对数转换,随后使用ScaleData进行数据缩放,进行主成分分析(principal component analysis,PCA)以减少维度。为了解决8个样本之间的批次效应,使用harmony包(版本1.2.0)对主成分进行修正。最后,使用FindNeighbors和FindClusters(分辨率=0.4)进行细胞聚类。通过细胞的经典标志物注释细胞亚群,并通过统一流形近似和投影(uniform manifold approximation and projection,UMAP)在二维空间中可视化。使用clusterProfiler R包(版本4.6.2)进行基因本体论(Gene Ontology,GO)富集分析,比较组间的差异表达基因(differentially expressed gene,DEG)。使用CellChat包(版本1.6.1)定量推断细胞间通信分析。
1.5 统计学方法
数据分析采用SPSS 26.0软件,图表绘制采用GraphPad Prism 9.0软件。符合正态分布的定量数据以x±s表示,使用单因素方差分析进行组间比较;不符合正态分布的定量资料以M(Q1,Q3)表示,采用Kruskal-Wallis检验进行组间比较。成对比较采用Bonferroni校正进行多重检验。Logistic回归分析用于计算组合的预测概率。绘制受试者操作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC)。调整后的P<0.05为差异有统计学意义。
2 结果
2.1 OMSI患者实验室检查指标比较
共纳入62例患者;其中,中度感染20例,重度感染21例,极重度感染21例。随着感染加重,患者的CRP、PCT、血清血糖和IL-1β水平均上升,其中PCT(P<0.001)和IL-1β(P<0.001)的升高具有统计学意义。根据Bonferroni多重比较结果,PCT和IL-1β的升高在极重度患者与中度感染之间以及在极重度感染和重度感染之间均存在统计学意义(P<0.05),但在重度感染与中度感染之间无统计学差异 (表2)。
表2 OMSI患者实验室检查指标比较
Tab 2
| Item | Moderate (n=20) | Severe (n=21) | Extremely severe (n=21) | P value |
|---|---|---|---|---|
| WBC/(×109·L-1) | 14.67±3.82 | 14.57±3.41 | 16.77±8.45 | 0.378 |
| ANC/(×109·L-1) | 12.25±3.86 | 11.45±3.42 | 14.36±8.59 | 0.251 |
| CRP/(mg·L-1) | 57.30 (26.63, 130.99) | 65.61 (27.37, 97.35) | 100.29 (33.82, 166.23) | 0.386 |
| PCT/(ng·L-1) | 0.10 (0.10, 0.25) | 0.10 (0.10, 0.46) | 4.10 (1.70, 6.85) | <0.001 |
| Serum glucose/(mmol·L-1) | 7.79±2.77 | 8.39±4.87 | 9.71±5.61 | 0.394 |
| IL-1β/(pg·mL-1) | 3.94±1.92 | 5.42±2.73 | 17.04±14.68 | <0.001 |
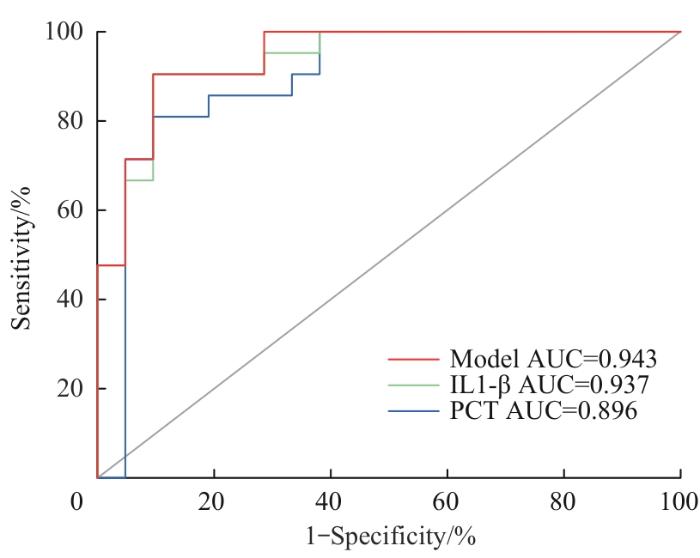
2.2 实验室检查指标对于极重度OMSI的预测价值
表3 极重度感染的影响因素的Logistic回归分析
Tab 3
| Variable | β | SE | OR (95% CI) | Wald test | P value |
|---|---|---|---|---|---|
| IL-1β | 0.596 | 0.188 | 1.814 (1.256‒2.621) | 10.068 | 0.002 |
| PCT | 0.085 | 0.099 | 1.089 (0.897‒1.322) | 0.744 | 0.388 |
图1
图1
联合IL-1β和PCT预测极重度感染的ROC曲线
Fig 1
ROC curves for predicting extremely severe infection using combined IL-1β and PCT
2.3 OMSI患者单细胞图谱及差异基因富集分析
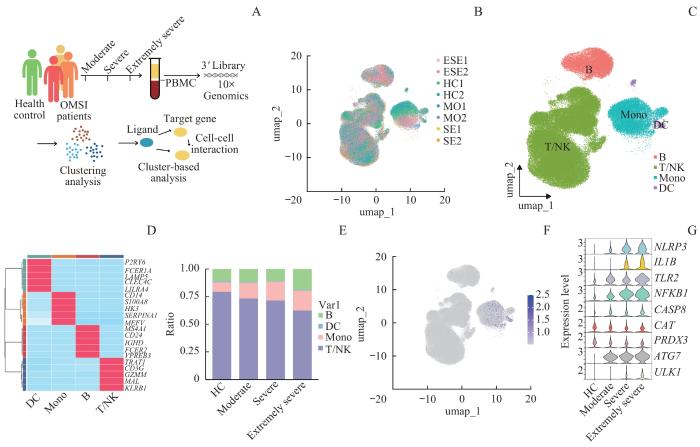
为确定引起IL-1β分泌的具体细胞类型,使用scRNA-seq比较OMSI患者与健康对照转录图谱。scRNA-seq流程如图2A所示。经过严格的质控后,8个样本细胞经过批次效应校正后整合。最终,共有89 794个细胞进行分析(健康对照:23 760个细胞;中度感染:23 024个细胞;重度感染:25 844个细胞;极重度感染:17 166个细胞)。样本的批次效应得到良好矫正(图2B)。这些细胞被聚类为4个细胞簇,并通过UMAP进行了降维处理(图2C)。根据典型的细胞标志基因,注释为T/自然杀伤(natural killer,NK)细胞、单核细胞、B细胞和树突状细胞(图2D),细胞的各自占比见图2E,结果显示单核细胞的比例随感染加重逐渐增加。
图2
图2
OMSI患者与健康对照者的PBMCs的单细胞转录组图谱
Note: A. An overview of the study design and workflow. B. UMAP plot showing integrated analysis of 8 samples. C. UMAP plot showing clustering of 4 immune cell subtypes in 8 samples. D. Heatmap showing the expression of the top 5 genes in each cluster. E. Bar plot showing the ratio of each cell subtype in 4 groups. B—B cell; Mono—monocyte; DC—dendritic cell. F. Feature plot showing the expression of IL1B in each cell subtype. G. Expression of NLRP3, IL1B, TLR2, NFKB1, CASP8, CAT, PRDX3, ATG7 and ULK1 among 4 groups in violin plot.
Fig 2
Single-cell transcriptomic atlas of PBMCs from OMSI patients and healthy controls
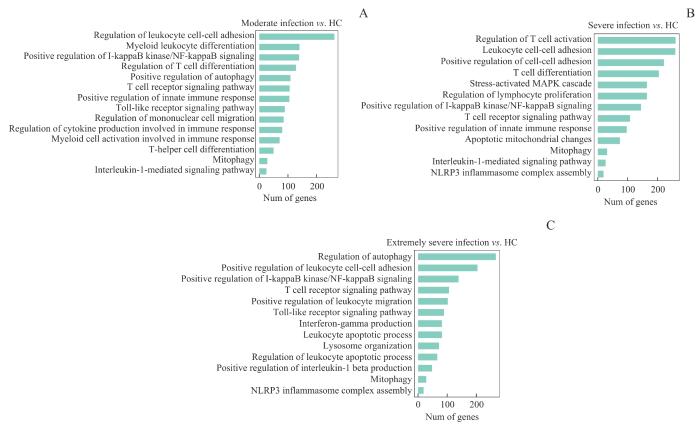
为进一步解析OMSI进展中的动态分子机制,对各个病程阶段和健康对照组之间上调的差异表达基因进行了GO富集分析。与健康对照组相比,3个感染阶段差异基因均显著富集于炎症相关信号(如IL-1)、细胞黏附与迁移、T细胞的活化、自噬及代谢调控等生物学过程(biological process,BP)。重度和极重度组显示NLRP3炎性小体装配的富集(图3)。这些结果提示,在OMSI加重过程中,单核细胞是关键促炎细胞亚群,感染加重伴随炎症信号增强;T细胞在炎症进展中可能具有重要作用。
图3
图3
GO生物学过程富集分析结果
Note: GO enrichment analysis of BP terms for moderate (A), severe (B), and extremely severe (C) infections, compared to healthy controls.
Fig 3
GO-BP enrichment analysis results
2.4 OMSI患者细胞间通信结果
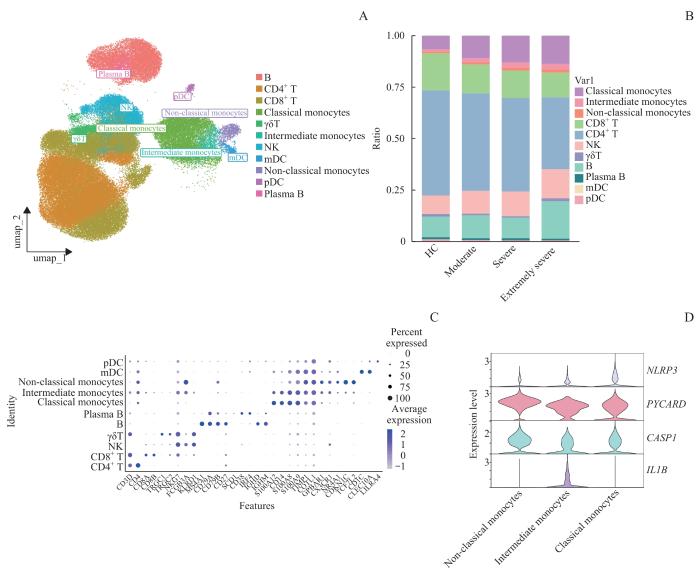
图4
图4
OMSI患者与健康对照者PBMCs单细胞转录组二级聚类
Note: A. UMAP plot showing clustering into 11 immune cell subtypes. B. Bar plot showing the ratio of each cell subtype in 4 groups. C. Dotplot showing cluster-defining gene expression across the 11 immune cell subtypes. D. Expression of NLRP3, CASP1, PYCARD and IL1B in monocyte subtypes. B—B cell; mDC—myeloid dendritic cell; pDC—plasmacytoid dendritic cell.
Fig 4
Secondary clustering of single-cell transcriptomic profiles of PBMCs from OMSI patients and healthy controls
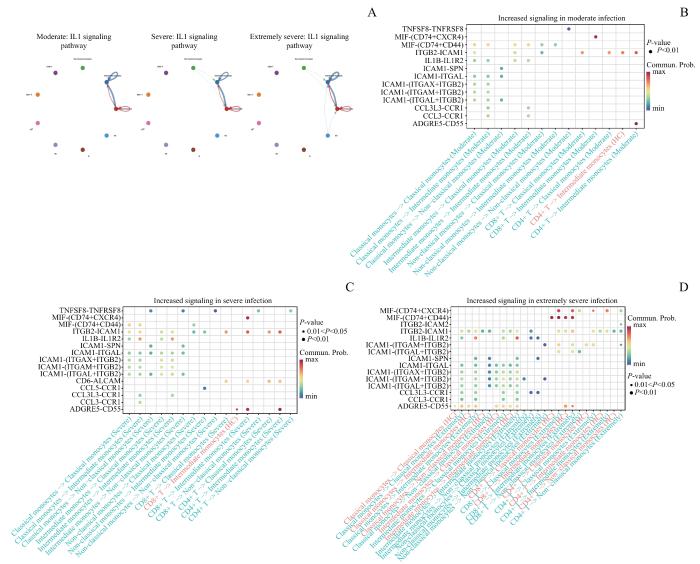
随后,使用CellChat包对细胞间通信进行了分析。IL-1信号的交互网络显示单核细胞间的交互逐级加强(图5A)。在3组OMSI患者与健康组的比较中,配体-受体对分析揭示,T细胞通过细胞黏附[细胞间黏附分子(intercellular adhesion molecule,ICAM)通路ITGB2-ICAM1、ICAM2-(ITGAM+ITGB2)、ICAM2-(ITGAL+ITGB2)]以及炎症信号传导[巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)通路MIF-(CD74+CXCR4)、MIF-(CD74+CD44)],与单核细胞存在显著通信的可能性;单核细胞通过炎症信号[MIF-(CD74+CD44)、IL-1B-IL-1R2]、趋化[趋化因子配体(CC chemokine ligand,CCL)通路CCL3L3-CCR1、CCL3-CCR1]以及细胞黏附与迁移[ITGB2-ICAM1、ICAM1-SPN、ICAM1-ITGAL、ICAM1-(ITGAX+ITGB2)、ICAM1-(ITGAM+ITGB2)、ICAM1-(ITGAL+ITGB2)]彼此存在显著通信的可能(图5B~D)。
图5
图5
细胞通信结果
Note: A. Communication network diagram of the IL1 signaling pathway. B‒D. Comparison of significant ligand-receptor pairs between moderate (B), severe (C) and extremely severe (D) infection groups and healthy controls.
Fig 5
Cellular communication results
感染患者中间型单核细胞相比健康对照的DEG火山图如图6所示。中度感染患者炎性小体(NLRP3、CASP1)、细胞黏附与迁移(ICAM1、ITGAM、CCR1、CD55)、炎症信号(TLR2、NFKB1)和MIF配体(CD44、CD74)基因表达显著上升;重度感染炎性小体(NLRP3、CASP1、PYCARD、IL1B)、细胞黏附与迁移(ICAM1、CCL3、CCL3L3、CD55)、炎症信号(TLR2、NFKB1)和MIF配体(CD74、CD44、CXCR4)表达显著上升;极重度感染炎性小体(NLRP3、CASP1、PYCARD、IL1B)、细胞黏附与迁移(ICAM1、CCL3、CCL3L3、CD55)、炎症信号(TLR2、NFKB1)和MIF配体(CD74、CD44、CXCR4)表达显著上升。
图6
图6
中间型单核细胞的差异表达基因
Note: DEGs in moderate (A), severe (B) and extremely severe (C) infections, compared to healthy controls.
Fig 6
DEGs in intermediate monocytes
以上结果显示,随着感染加重,单核细胞之间的IL-1β信号通信增强、中间型单核细胞高表达NLRP3炎性小体基因。在单核细胞发挥免疫反应的过程中,单核细胞与T细胞在促炎反应、细胞趋化和黏附方面发挥了重要作用。
2.5 OMSI患者PBMCs中炎性小体基因转录水平
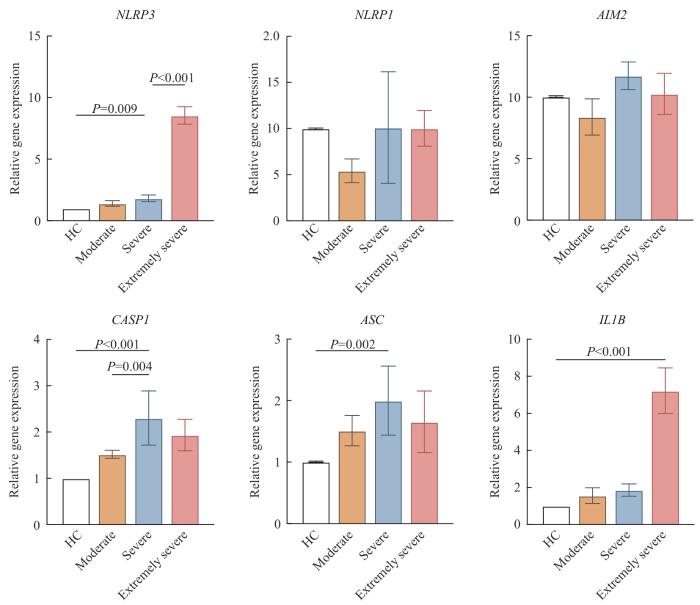
为验证OMSI患者PBMCs中炎性小体相关基因的转录水平,检测了NLRP3、NLRP1、AIM2、CASP1、ASC和IL1B的表达情况。结果显示,随着感染程度加重,NLRP3和IL1B的转录水平显著上升(P<0.05),而CASP1和ASC在重度感染中显著上升(P<0.05),在极重度患者中相较于重度患者有所下降,但两者无统计学差异。此外,未观察到NLRP1和AIM2炎性小体基因的表达上升(图7)。
图7
图7
炎性小体基因在OMSI患者外周血PBMCs中的表达
Fig 7
Expression of inflammasome genes in peripheral blood PBMCs of OMSI patients
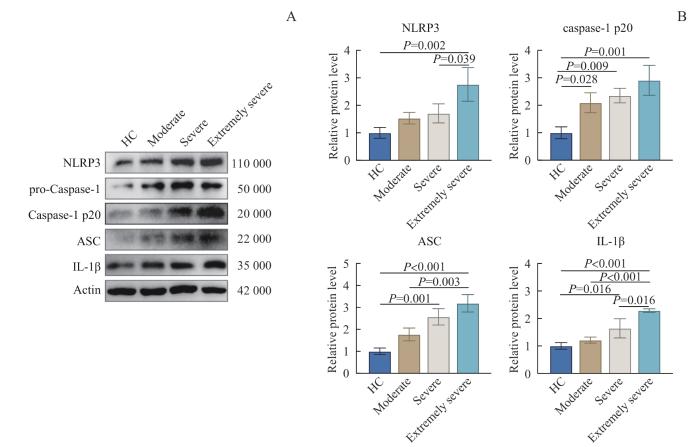
2.6 OMSI患者PBMC中炎性小体蛋白表达水平
图8
图8
炎性小体蛋白在OMSI患者PBMCs中的表达
Fig 8
Expression of inflammasome proteins in PBMCs of OMSI patients
3 讨论
IL-1β是炎症级联的上游因子。IL-1β是IL-6的主要激活因子之一[13],还可驱动促炎因子IL-17产生[14];作为炎症反应的上游,IL-1β在炎症放大过程中更为关键。IL-1β的释放被作为是炎性小体激活的标志,其中NLRP3炎性小体能够识别微生物或无菌炎症刺激,如细胞外ATP、孔道形成毒素、RNA病毒和颗粒物质[15-16]。在脓毒症中,外周血NLRP3炎性小体的激活已在单核细胞、中性粒细胞和树突状细胞亚群中得到证实[17-18]。本研究通过scRNA-seq发现,中间型单核细胞是主导促炎亚群,中间型单核细胞在重度和极重度感染患者中均高表达NLRP3、CASP1、PYCARD和IL1B。之前研究报道中间型单核细胞有较强的产生IL-1β的能力[19],在LPS刺激下,其分泌炎症因子明显高于经典型和非经典型亚群[20]。WONG等[21]指出中间型单核细胞的增加可促进细菌感染。随着OMSI感染的加重,3种单核细胞亚群的比例均有所上调,显示出持续加重的免疫功能紊乱。
为了进一步研究OMSI进展中外周血免疫细胞的相互作用,使用CellChat分析细胞间的交互网络。经典单核细胞和中间型单核细胞在IL-1信号通路有较强的交互作用。经典单核细胞表达促炎性的S-100蛋白,例如S100A12和S100A8/9,这赋予它们促进炎症的能力[22]。中间型单核细胞促进T细胞的增殖和激活,具有较强的活性氧生成能力和促进血管生成的作用[23]。MIF通过上调巨噬细胞的模式识别受体表达,并抑制p53依赖性细胞凋亡,维持促炎反应[24]。MIF/CD74复合物的表达与CD68阳性巨噬细胞的浸润和激活密切相关。MIF在感染过程中通过正向调节巨噬细胞反应,促进促炎因子及炎症介质(如IFN-γ、IL-2、IL-6、IL-8、NO、COX2)的释放[25]。高水平的MIF还与患者的脓毒症严重程度相关[26]。T细胞是MIF的主要来源之一[27]。在T细胞中观察到其对应单核细胞MIF通路通信的加强,感染组中间型单核细胞MIF配体(CD74、CD44和CXCR4)表达升高,提示T细胞可能具有促进单核细胞炎症的作用。单核细胞间CCL和ICAM信号通信增强,提示感染加重过程中单核细胞向感染部位集结,并激活了炎症反应。
值得注意的是,随着感染的加重,患者外周血CASP1和ASC的mRNA水平呈现先升高后稍下降的趋势。而caspase-1 和ASC蛋白则持续上升。ASC是NLRP3炎性小体复合物中的衔接蛋白,可能在炎症反应过程中未经明显消耗,所以基因水平未呈现持续上调的情况下,未影响蛋白水平的持续累积。蒋文等[28]报道称,使用PCT干预LPS处理的人脐静脉内皮细胞,PCT浓度的增加会降低CASP1基因的转录和caspase-1蛋白的表达。本研究中极重度OMSI患者PCT水平显著升高,CASP1基因转录水平在极重度患者中稍有下降和患者PCT水平的升高是否有直接关系有待进一步验证;且极重度患者中CASP1基因转录下降也未影响蛋白表达水平,具体机制仍需进一步探讨。总体来说,在健康对照及中度、重度和极重度患者中,NLRP3、caspase-1 p20、ASC、IL-1β蛋白随感染加重持续升高,说明NLRP3炎性小体的激活和炎症反应的进一步扩大。
本研究仍存在一定局限性。首先,回顾性研究中纳入62例患者,样本量较小,未来需要纳入更多样本来验证联合IL-1β和PCT预测极重度OMSI的可靠性。其次,本研究的scRNA-seq中选择中度、重度和极重度患者各2例进行测序分析,样本量的限制可能影响对OMSI患者细胞异质性的全面解析。未来研究需扩大样本规模,并结合多组学方法以更全面地揭示OMSI的细胞组成及其在疾病进展中的作用。最后,尚未阐明OMSI中间型单核细胞NLRP3炎性小体激活的具体机制,细胞间相互作用分析所揭示的细胞内网络调控机制仍需进一步的实验验证。
综上所述,本研究探讨了IL-1β在OMSI中预测极重度感染的作用,结果表明联合IL-1β(最佳截断值为8.8 ng/mL)和PCT(最佳截断值为1.2 ng/mL)可为临床医师预测极重度感染患者提供理论依据。此外,研究揭示OMSI患者PBMCs中NLRP3炎性小体激活,中间型单核细胞是促炎关键细胞亚群、T细胞和单核细胞共同促进了炎症反应,这为未来OMSI的治疗策略提供了新的方向。
伦理批准和知情同意
本研究通过上海交通大学医学院附属第九人民医院医学伦理委员会的审核批准(伦理号:SH9H-2021-T400-2)。受试对象或其亲属签署了知情同意书。
Ethics Approval and Patient Consent
This study was approved by the Ethics Committee of Shanghai Ninth People's Hospital, Shanghai Jiao Tong University School of Medicine (Approval Letter No. SH9H-2021-T400-2). Consent letters have been signed by the research participants or their relatives.
作者贡献声明
朱晗懿参与生物信息学分析、实验设计及论文撰写,石欢参与论文设计、数据分析及论文修改,俞创奇参与论文修改,郑凌艳参与论文设计与论文修改。所有作者均阅读并同意最终稿件的提交。
AUTHOR's CONTRIBUTIONS
ZHU Hanyi participated in bioinformatics analysis, experimental design and manuscript writing. SHI Huan contributed to manuscript design, data analysis and manuscript revision. YU Chuangqi contributed to manuscript revision. ZHENG Lingyan was involved in manuscript design and revision. All authors have read the last version of paper and consented to submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献