感染性并发症是接受血液透析的终末期肾病(end-stage renal disease,ESRD)患者死亡的第二大原因[1],多项指南推荐了透析患者的抗生素剂量。然而,由于透析参数的多样性,不同指南给出的不同透析模式下的抗生素剂量不尽相同。抗生素被透析清除的程度取决于其理化性质,包括分子量、蛋白结合率、分布容积和水溶性等[2]。血浆蛋白结合率(binding rate of plasma protein,BRPP)影响药物在体内的分布、代谢和清除,被认为是影响血液透析药物清除的重要因素。一项关于血液透析中尿毒症蛋白结合毒素的研究[3]表明,蛋白结合率是影响尿毒症毒素清除率的主要因素。然而,目前关于抗生素蛋白结合率与透析清除率之间关系的报道较少。
美罗培南、万古霉素和头孢曲松常被用于感染的血透患者,三者的蛋白结合率分别为2%、55%和85%[4]。美罗培南是一种广谱碳青霉烯类抗生素,其分子量小(为383 Da)、蛋白结合率低(2%),通过尿液排泄,其大约50%通过间歇性血液透析(intermittent hemodialysis,IHD)被清除[5-6]。万古霉素是一种大分子糖肽类抗生素,分子量为1 446 Da,广泛用于治疗严重的革兰阳性菌感染,在肾功能正常的个体中,其与蛋白的结合率为50%~55%,但在ESRD患者中可能由于白蛋白较低降至22%[7-8]。头孢曲松作为一种第三代头孢菌素,通过肾脏(约40%)以及胆道排泄。它的分子量低(为556 Da),但蛋白结合度高(为80%~90%)[9-10];在肾功能不全的患者中,其蛋白结合率降至约43%[11]。
美罗培南和头孢曲松是时间依赖性抗生素,其疗效考察指标为血药浓度高于最低抑菌浓度占给药间隔的比率(fraction of time that the free drug concentration is above the minimal inhibitory concentration,%fT>MIC)。尽管这2种抗生素的治疗窗较宽,但有报告指出高剂量的碳青霉烯类和头孢菌素类抗生素可在危重患者或肾功能不全患者中引起神经毒性[12]。至于万古霉素,2020年修订的万古霉素共识指南中仍推荐在IHD患者中使用15~20 mg/L的透析前浓度范围[13]。抗生素剂量可能因血液透析而剂量不足。KEOUGH等[14]报告称,接受持续低效血液透析(sustained low efficiency dialysis,SLED)的患者中有63%接受了不充分剂量的抗生素,其中65%接受了美罗培南。
本研究拟从蛋白结合率出发,评估在接受低通量IHD的患者中这3种抗生素的清除率以及药代动力学/药效动力学(pharmacokinetics/pharmacodynamics,PK/PD),从而探索在IHD中抗生素清除的一般规律,并评价当前方案的疗效。
1 对象与方法
1.1 试验设计
本前瞻性药代动力学研究于上海交通大学医学院附属第九人民医院肾脏内科进行,并在复旦大学附属华山医院抗生素研究所分析生物样本。纳入标准:①接受IHD治疗并接受美罗培南(0.5 g/d)、万古霉素(0.5 g/2 d)或头孢曲松(2.0 g/d)治疗已达到稳态。②年龄18~85岁。③体质量50~85 kg。④肝功能正常。排除标准:①妊娠或哺乳期。②对头孢菌素、青霉素、糖肽或美罗培南有过敏史。③严重低蛋白血症(血清总蛋白<45 g/L)、严重低白蛋白血症(血清白蛋白<20 g/L)。④代谢性碱中毒或严重感染。
1.2 资料、样本收集与分析方法
收集患者的人口统计学及临床特征等资料。使用费森尤斯医疗4008S或Nikkiso DBB-27进行4 h的IHD,配备Polyflux 14L透析器(表面积1.4 m2,Gambro Dialysatoren GmbH公司,德国)。血流量(Qb)设为200~250 mL/min,透析液流速为500 mL/min。超滤率(ultrafiltration rate,UFR)根据患者的干体质量确定。
动脉端血样本在透析开始前,IHD期间的第1、2、3小时以及透析后0、1 h在滤器前收集。静脉端血样本在透析期间的第1、3小时在滤器后采集。透析液样本在透析期间的第1、2、3小时以及IHD结束时收集。血液样本在采集后6 h内,以1 500×g 的速度离心10min后取上清。血清和透析液样本均储存在-70 ℃直到分析。使用经过验证的液相色谱-串联质谱(liquid chromatography with tandem mass spectrometry,LC-MS/MS)方法在复旦大学附属华山医院抗生素研究所检测美罗培南、头孢曲松及万古霉素的总药物浓度(未公布数据)。
1.3 药代动力学
本研究运用3个常用的清除率公式来评估抗生素经透析清除的速率[15]。
血液侧瞬时清除率定义为:
透析液侧瞬时清除率定义为:
其中,Qb为血流量,Qd为透析液流量,Quf为超滤率,Anh为透析第n小时动脉端血药浓度,Vnh为透析第n小时静脉端血药浓度,Dnh为透析第n小时透析液流出端药物浓度,HCT(hematocrit)为血细胞压积。
计算抗生素经4 h血液透析的总清除率:
其中,Mtotal为透析液流出液中回收的药物总量,AUC为通过药动学模型计算的透析过程中药时曲线下面积,Daverage为连续部分收集的透析液中平均药物浓度,Tdial为透析实际时长。透析后1 h反弹率(Rebound1h%)计算公式如下:
其中,Apost1h为透析结束后1 h血药浓度,Apost为透析结束时动脉端血药浓度。当患者尿量远大于100 mL/24 h时,需计算残余肾功能:
其中UUN为尿尿素氮,BUNblood为血尿素氮,BUNpre为透析前血尿素氮,BUNpost为透析后血尿素氮,Vurine为透析间期尿体积量,
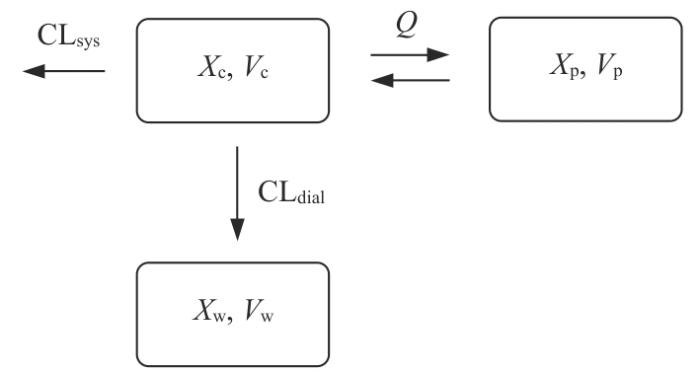
采用MATLAB R2018a软件建立含有透析液废液室的二室药动学模型(图1),其微分方程如下。
图 1
图 1
含透析液废液室的二室药动学模型示意
Fig 1
Schematic diagram of a two-compartment pharmacokinetic model with a dialysate waste chamber
体内:
透析液废液室:
其中,
其中,Xc为动脉端药物量(mg),t为时间(h),Xw为透析液流出液端药物量(mg),Vw为透析液流出液体积(L),Xp、Vp分别为外周室药量(mg)和分布容积(L)。Vc为中央室分布容积(L)。Vc0为中央室初始分布容积(L)。CLsys为机体清除率(L/h),CLdial为透析清除率(L/h)。R表示透析开关,RO表示输注速率(mg/h)。Q为中央室和外周室之间的速率常数,α为透析间期体液的增长速率。通过残差分数值(fval%)评估模型拟合度。
1.4 统计学方法
使用SPSS 23.0软件对数据进行统计学分析,符合正态分布的定量数据用x±s表示,偏态的定量数据用M(Q1,Q3)表示,定性数据用n(%)表示。采用独立样本 t 检验和多个独立样本Kruskal-Wallis H检验比较组间连续性变量的差异性,采用Pearson相关性分析评价抗生素蛋白结合率与透析清除率的相关性。P<0.05表示差异具有统计学意义。
2 结果
2.1 基线特征
本研究入组接受抗生素抗感染治疗的血液透析患者共19例,其中美罗培南组7例、万古霉素组5例、头孢曲松组7例。受试者人口统计学及临床特征见表1。数据显示所有受试者肝功能均在正常范围内;除2例头孢曲松组受试者存在54.85、110.53 mL/min残余肾功能外,其余17例受试者临床上均为无尿。受试者的年龄、干体质量、体质量指数(body mass index,BMI)、血浆蛋白、血浆白蛋白、HCT的组间差异无统计学意义。比较组间肾小球滤过率(estimated glomerular filtration rate,eGFR)、丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST),结果显示各组间肾功能和肝功能差异无统计学意义。
表1 受试者人口统计学及临床特征
Tab 1
| Indicator | Meropenem (n=7) | Vancomycin (n=5) | Ceftriaxone (n=7) | P value |
|---|---|---|---|---|
| Age/year | 69 (60, 77) | 71 (58, 80) | 64 (58, 71) | 0.198 |
| Male/n(%) | 6 (85.7) | 5 (100.0) | 7 (100.0) | 0.059 |
| DWa/kg | 66.0 (48.0, 73.5) | 58.1 (48.0, 65.0) | 63.0 (55.7, 75.0) | 0.167 |
| BMI/(kg | 24.1 (18.8, 27.5) | 21.8 (19.2, 25.2) | 22.4 (20.5, 25.4) | 0.274 |
| eGFRb/[mL·(min·1.73 m2)-1] | 10.1 (4.0, 28.0) | 7.4 (4.0, 12.0) | 9.1 (5.0, 13.0) | 0.545 |
| ALT/(U | 13.6 (6.0, 34.0) | 22.8 (7.0, 37.0) | 15.4 (3.0, 30.0) | 0.492 |
| AST/(U | 15.6 (8.0, 32.0) | 21.8 (12.0, 36.0) | 20.7 (6.0, 28.0) | 0.273 |
| TP/(g | 61.9 (49.0, 72.0) | 67.4 (62.0, 77.0) | 61.6 (49.0, 79.0) | 0.325 |
| Alb /(g | 31.6 (20.0, 38.0) | 34.6 (29.0, 40.0) | 35.0 (23.0, 42.0) | 0.539 |
| HCT | 0.278 (0.191, 0.383) | 0.288 (0.214, 0.355) | 0.276 (0.198, 0.332) | 0.866 |
| Qb/(mL | 212.9 (200.0, 240.0) | 218.0 (200.0, 230.0) | 217.1 (200.0, 250.0) | 0.893 |
| UF/L | 2.6 (2.0‒3.5) | 2.2 (1.6‒3.3) | 2.6 (1.3‒3.3) | 0.485 |
2.2 清除率
美罗培南、万古霉素、头孢曲松在4 h常规血液透析过程中的清除率数据见表2。比较3种计算公式所得清除率,发现无明显统计学差异,美罗培南组和头孢曲松组中CLp>CLdial>CLtotal,而万古霉素组中CLp>CLtotal>CLdial。比较同一公式下组间抗生素的血透清除率,结果显示3种抗生素在IHD中的清除率均具有显著性差异(CLp:P<0.001;CLdial:P=0.001;CLtotal:P=0.001)。无论采用何种清除率计算公式,美罗培南(5.14~5.97 L/h)经血液透析清除药物最多,万古霉素(2.87~3.77 L/h)的血透清除率中等,头孢曲松(1.21~1.90 L/h)则最低。
表2 抗生素在血液透析中的清除率
Tab 2
| Indicator | CLp/(L | CLdial/(L | CLtotal/(L |
|---|---|---|---|
| Meropenem | 5.97±0.57 | 5.26±1.05 | 5.14±1.09 |
| Vancomycin | 3.77±0.45 | 2.87±1.14 | 3.10±1.28 |
| Ceftriaxone | 1.90±0.61 | 1.34±0.29 | 1.21±0.27 |
2.3 药代动力学
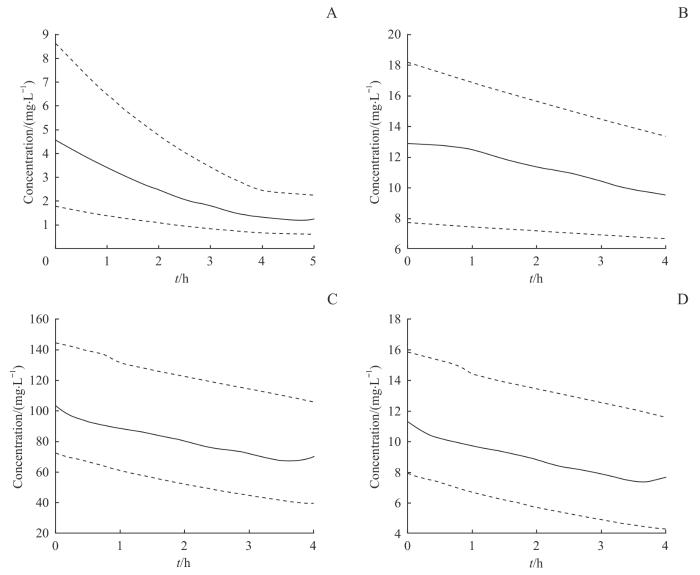
图2
图2
二室模型模拟的抗生素平均药时曲线图
Note: A.Plasma concentration-time profile of meropenem (n=7) during IHD and 1 hour post-dialysis. B. Serum concentration-time profile of vancomycin (n=5) during IHD. C. Total plasma concentration-time profile of ceftriaxone (n=7) during IHD. D. Free plasma concentration-time profile of ceftriaxone (n=7) during IHD. Drug concentrations in plasma/serum are presented as mean values (solid line) and ranges (dashed line).
Fig 2
Simulated mean concentration-time curves of antibiotics based on the two-compartment model
表3 低通量IHD时患者体内抗生素的药代动力学参数
Tab 3
| Indicator | Meropenem | Vancomycin | Ceftriaxone |
|---|---|---|---|
| CLdial/(L | 4.71±1.10 | 3.25±1.21 | 1.16±0.45 |
| CLsys/(L | 1.78±0.63 | 0.20±0.13 | 0.27±0.07 |
| Vc0/L | 17.60±4.78 | 18.73±1.88 | 10.84±4.79 |
| Vp/L | 41.51±12.38 | 32.43±10.53 | 22.42±18.09 |
| Q/(L | 0.19±0.20 | 0.24±0.25 | 0.25±0.14 |
| T1/2on/h | 1.99±0.86 | 11.82±5.10 | 8.16±3.08 |
| T1/2off/h | 6.44±3.02 | 50.87±23.62 | 15.46±6.58 |
| AUC/(h | 278.18±151.80 | 833.19±299.46 | 4262.60±1183.66 |
| Vd/L | 18.56±8.97 | 42.19±32.77 | 13.82±7.09 |
3 讨论
本研究首次从蛋白结合水平的角度描述了IHD期间抗生素的清除率和药代动力学。研究分析了临床上常用的抗生素美罗培南、万古霉素及头孢曲松,它们分别代表了低、中、高蛋白结合率水平。
在Qb为(215±17)mL/min,透析液流量(Qd)为500 mL/min,以及超滤量(ultrafiltration,UF)为(2.6±1.1)L的情况下,通过清除率方程计算得到的美罗培南、万古霉素及头孢曲松的CLp分别为(5.97±0.57)、(3.77±0.45)、(1.90±0.61)L/h。美罗培南的清除率高于先前研究中的结果[(4.9±1.3)L/h][5],可能因为早期研究中主要使用的透析膜是醋酸纤维素膜,渗透性低,生物相容性较差。而本研究使用的为混合、合成型透析膜,具有更高的清除毒素和药物的能力,目前在临床上被广泛使用。因此,本研究中关于美罗培南清除率的结果对于当前的血液透析模式具有更高的参考价值。万古霉素和头孢曲松的平均CLp数据与已报道的研究结果相似(分别为2.68 L/h和1.63 L/h)。
3种公式计算的透析清除率的结果略有不同,但未发现显著差异。由于血浆与红细胞间抗生素浓度不均,瞬时CLp被认为可能被低估,而CLdial和血液透析的总清除率(CLtotal)则需要更高灵敏度的检测方法。因为在4 h血液透析后,在至少120 L的废弃透析液中,抗生素显著被稀释。然而,考虑到透析过程中包括低血压、透析膜及非肾脏清除等因素影响,回收透析液是可行的方法[2]。本研究中,CLp略高于CLdial,这是由于血液透析过程中HCT的增加,而计算中使用的HCT是在透析开始时收集的。额外的变异来源与流速读数的误差有关。透析液流速已经根据实际流出流速进行了调整。我们进行了3次1 min的透析液流出物收集。当Qb为200 mL/min、Qd为700 mL/min且无超滤时,平均实际流出流速为612.5 mL/min。
研究结果表明,在采用相同透析参数的情况下,蛋白质结合率较高的抗生素在血液透析中的清除率较低。研究排除了年龄、干体质量、BMI、总血浆蛋白、血浆白蛋白、HCT、肝肾功能及透析参数等因素的影响。ELOOT等[16]通过二室药代动力学模型研究了不同蛋白结合尿毒症毒素的透析器清除率,并发现尿素、对甲酚葡糖苷酸、马尿酸、吲哚-3-乙酸、吲哚硫酸盐及对甲酚硫酸盐的清除率与这些物质的蛋白结合水平呈负相关。MAHESHWARI等[3]也证实了蛋白结合率与血液透析期间尿毒症毒素的清除率密切相关,并建立了一个考虑蛋白结合率的动力学模型。抗生素和其他药物通常在游离状态下是小分子或中等大小分子。美罗培南(383 Da)是小分子,而万古霉素(1 446 Da)和头孢曲松(556 Da)具有中等分子量。游离抗生素可以像肌酐和尿素通过血液透析被清除。当与白蛋白(67 kDa)结合时,结合部分难以通过透析膜被血液透析清除。本研究的结果为进一步建立一个考虑蛋白质、抗生素及其蛋白-抗生素复合物之间平衡的最优药代动力学模型奠定了基础。
某些药物在血液透析后从外周室重新分布到中央室,因此会出现血浆浓度反弹现象。较大的分布容积(volume of distribution,Vd)会导致更高的浓度反弹。既往研究显示,万古霉素在血液透析后3~6 h内反跳可达16%~36%[17-18],而美罗培南和头孢曲松在IHD后的反弹较少。KIELSTEIN等[19]报告称,美罗培南在8 h血液透析后几乎没有反弹。在本研究中,美罗培南在透析后通常显示出14%~51%的反弹,这可以通过更高的血液和透析液流速导致透析后更大的再分布来解释。然而,尽管万古霉素和头孢曲松的反弹分别为16%和8%,但存在较大的个体差异。一些受试者在透析后没有显示出明显的浓度反弹,因此需要纳入更大的人群进行进一步研究。
本研究中建立的药代动力学模型基于患者体内的二室模型以及含有透析液的废液室模型。模型还考虑了透析间期的体液增加,以及患者的残肾清除率和非肾脏清除率。根据模型,3种抗生素的CLdial分别为4.71、3.25、1.16 L/h。与公式计算方法相比,通过药代动力学模型获得的透析清除率更为准确。
在IHD期间,万古霉素的半衰期与文献[20]报道的相似。由于膜的差异,美罗培南和头孢曲松的透析期半衰期(half-life intradialysis,T1/2on)值比以往研究中的要短[21]。研究发现,在低通量血液透析期间,万古霉素的T1/2on值与正常肾功能人群相似,提示血液透析对万古霉素的清除作用相当于健康肾脏。万古霉素和美罗培南的透析间期半衰期(half-life interdialysis,T1/2off)比T1/2on长,但远低于未接受血液透析的ESRD患者的T1/2off。由于头孢曲松通过胆汁和肾脏双途径排泄,T1/2off和T1/2on之间没有显著差异。此外,这3种抗生素的Vd与之前报道的相似[5,22-23],在健康人群和血透患者之间也没有发现Vd的显著差异。
在本研究中,我们测量了接受IHD治疗的患者中3种抗生素的%fT>MIC值,以评价治疗效果。根据临床和实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)[24]标准以及受试者的感染部位和细菌培养结果,选择了2、8、16 μg/mL作为美罗培南的MIC值,以及0.25、4、16 μg/mL作为头孢曲松(游离)的MIC值。如果%fT>MIC值不低于40%、45%,则认为美罗培南和头孢曲松的给药方案是成功的。根据模型模拟的浓度数据估算,美罗培南的%fT>MIC值分别为95.2%、60.8%和32.4%,头孢曲松的%fT>MIC值分别为100%、96%和54%。结果表明,对于大多数在低通量IHD期间的患者,每日0.5 g的美罗培南给药方案基本上可以达到疗效,但对于对细菌敏感性较低的情况,治疗可能会失败。在每日2g的头孢曲松给药方案下,几乎所有患者都能达到治疗效果。至于万古霉素,我们测量了平均谷浓度[(11.09±4.19)μg/mL]以及达到推荐谷浓度范围的比例。万古霉素仅14%达到了15~20 mg/L的谷浓度范围。万古霉素的给药方案,即给予1 g的负荷剂量和每次透析后0.5 g的维持剂量,存在治疗失败的风险。因此建议根据及时的治疗药物监测(therapeutic drug monitoring,TDM)在临床上调整剂量。
综上,抗生素的蛋白结合水平与透析清除率呈负相关。低通量血液透析中美罗培南、万古霉素、头孢曲松在二室模型中均拟合良好。美罗培南与头孢曲松给药方案可基本达到疗效,万古霉素存在给药剂量不足的风险。未来可以建立透析清除率与蛋白结合水平之间的精确关系,以便准确预测血透清除的抗生素。
伦理批准和知情同意
本研究涉及的所有试验均已通过上海交通大学医学院附属第九人民医院伦理委员会的审核批准(审批号2018-83-T74)。受试对象或其亲属已经签署知情同意书。
Ethics Approval and Patient Consent
All experimental protocols in this study were reviewed and approved by the Ethics Committee of Shanghai Ninth People's Hospital, Shanghai Jiao Tong University School of Medicine (Approval Letter No. 2018-83-T74). Informed consent letters have been signed by the research participants or their relatives.
作者贡献声明
丁峰、张菁参与了实验设计,王雨参与了质谱分析,陈渊成参与了药代动力学/药效动力学分析,沈玥、徐静仪参与了数据采集和论文写作。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by DING Feng and ZHANG Jing. The LC-MS/MS experiments were conducted by WANG Yu. PK/PD analysis was conducted by CHEN Yuancheng. Data collection and manuscript drafting was completed by SHEN Yue and XU Jingyi. All authors have read the last version of paper and consented to submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献