E3泛素连接酶在人类恶性肿瘤的发生和发展中起关键作用。在SCF(SKP1-cullin 1-F-box)蛋白E3泛素连接酶复合物中,F-box蛋白充当底物识别亚基主要通过泛素化途径识别并降解靶蛋白[1]。F-box蛋白38(F-box only protein 38,FBXO38)属于SCF蛋白家族,最初被发现是作为Krüpple样因子7(Krüpple-like transcription factor 7,KLF7)的相互作用蛋白,共同调节神经发生和细胞周期进程[2-3]。MENG等[4]报道FBXO38可介导T细胞中程序性死亡受体1(programmed death 1,PD-1)的Lys48位点泛素化和蛋白酶体降解。该研究[4]表明,FBXO38参与PD-1表达的调控,揭示了FBXO38对维持T细胞的抗肿瘤活性至关重要。探究FBXO38在肿瘤增殖中的作用,可为其作为肿瘤新的治疗靶点提供进一步的理论依据。然而,FBXO38对于肿瘤的增殖调控作用尚不清楚。
眼部黑色素瘤是一种眼部恶性肿瘤,主要发生在眼睑、结膜以及葡萄膜等部位。眼部黑色素瘤主要包括葡萄膜黑色素瘤(uveal melanoma,UM)和结膜黑色素瘤(conjunctival melanoma,CM)。UM为常见的眼部黑色素瘤[5],也是成人常见的眼内恶性肿瘤。UM对抗PD-1治疗反应较差[6]。且转移后的UM对化学治疗或靶向治疗反应不佳,患者通常在症状出现1年后死亡[7]。而在CM中,缺少关于PD-1治疗的效果评估和机制研究[8]。FBXO38对于眼部黑色素瘤抗PD-1治疗抗性的缓解提供了新的可能性[9]。本研究拟探究FBXO38在眼部黑色素瘤中对于肿瘤增殖的影响,以期为改善眼部黑色素瘤的治疗提供新的研究方向。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器
CO2培养箱(Thermo Fisher Scientific,美国),离心机(Eppendorf,德国),酶标仪、蛋白及DNA电泳装置(Bio-Tek,美国),Odyssey红外成像系统(LI-COR,美国),Realtime-qPCR仪、PCR扩增仪(Applied Biosystems,美国)、Pannoramic MIDI 病理扫描仪(丹吉尔电子有限公司)。
1.1.2 主要试剂
DMEM高糖培养基、RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)、双抗(青霉素/链霉素)溶液、0.25%胰蛋白酶(Gibco,美国),支原体抑制剂(深圳欣博盛生物科技有限公司),蛋白酶抑制剂、磷酸酶抑制剂(Sigma,美国),5% BSA封闭液[生工生物工程(上海)股份有限公司],0.22 μm PVDF膜(Merck millipore,德国),RNA抽提试剂盒(EZBioscience,美国),限制性内切酶EcoRⅠ、AgeⅠ(NEB,美国),qPCR反转录试剂盒、Applied Biosystems™ SYBR™ Green预混液、T4连接酶、重组酶(南京诺唯赞生物科技股份有限公司),DH5a感受态细胞(北京擎科生物科技股份有限公司),质粒小提中量试剂盒(天根生化科技有限公司),Polyjet、聚凝胺(polybrene)、嘌呤霉素(puromycin)(SignaGen,德国),anti-FBXO38抗体(A302-378A,BETHYL,美国),anti-p-PI3K抗体(AP0854)、anti-p-Akt抗体(AP0637)、anti-p-mTOR抗体(AP0115)、anti-PTEN抗体(A19104)、anti-MDM2抗体(A23388)、anti-P53抗体(A0263)、anti-P21抗体(A1483)(爱博泰克生物),StarBright Blue 520鼠源IgG二抗(Bio-Rad,美国),Alexa Fluor Plus 800兔源IgG二抗、Alexa Fluor 594 Plus兔源IgG二抗(Invitrogen,美国),anti-BrdU的单克隆大鼠一抗(Abcam,美国),DAPI(上海碧云天生物技术有限公司),2-吗啉代-8-苯基色酮(LY294002)、依维莫司(Everolimus)(MedChemExpress,美国)。
1.1.3 细胞和质粒
人UM细胞OMM2.3由荷兰莱顿大学医学中心John F. Marshall教授惠赠,人皮肤黑色素瘤(skin cutaneous melanoma,SKCM)细胞A375和人胚肾细胞293FT细胞从中国科学院细胞库购买。所有细胞系的支原体污染检测均为阴性。A375和293FT细胞采用含有10% FBS的DMEM培养基培养,OMM2.3细胞采用含有10% FBS的RPMI 1640培养基培养。培养基中均常规加入100 μg/mL青霉素和100 μg/mL链霉素。细胞均在37°C的5% CO2培养箱中培养。载体质粒PLKO.1和PLVX以及病毒包装质粒PMD2.D、PSPAX2均为上海市眼眶病眼肿瘤重点实验室库存。
1.2 实验方法
1.2.1 稳转细胞系构建
(1)shFBXO38质粒构建。靶向人FBXO38的外显子序列分别设计并合成2条shRNA编码序列(GACTTCCTTTGTATCAGCTTA和GCAAGACTCC ACTTCGAAAGA)。对退火后的引物和载体质粒PLKO.1,使用限制性内切酶AgeⅠ和EcoRⅠ进行酶切,使用T4连接酶进行重组,经测序正确后使用。FBXO38-shRNA质粒用于后续FBXO38敲低稳转细胞系构建,空载质粒用于对照稳转细胞系构建。
(2)过表达质粒构建。参照NCBI官网信息,获取FBXO38的编码序列(coding sequence,CDS)后合成CDS。使用重组酶连接目的序列和PLVX质粒,经质粒全长测序正确后使用。使用未经人工干预或基因改造的野生型细胞作为对照细胞系。
(3)慢病毒包装。按照如下比例将质粒加入到500 μL不含血清的DMEM培养基中:5 μg含有目的序列的质粒+10 μg PSPAX2+5 μg PMD2.D。另外准备一管500 μL不含血清的DMEM培养基,加入60 μL polyjet。2管同时室温静置10 min之后,将含有polyjet的培养基滴至含质粒的培养基中,再次静置10 min。待293FT细胞密度达到90%时,将质粒盒脂质体混合物滴入含有293FT细胞的培养皿中,再次置于37 ℃、5% CO2、95%湿度的细胞培养箱中继续培养48 h。收集慢病毒液,经0.22 μm滤头过滤后用于细胞感染。
(4)质粒转染。取处于对数生长期且细胞状态良好的A375和OMM2.3细胞,待其生长密度达到20%~30%时,弃培养基,将慢病毒液与新鲜培养基按照1∶1的体积比例缓慢加入细胞培养皿中,并以1∶1 000的比例加入polybrene,轻柔混匀。培养24 h之后换液,并使用2 μg/mL puromycin进行筛选。筛选1周后使用Western blotting或实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)验证FBXO38的敲低和过表达效率。
1.2.2 qRT-PCR
将消化后的细胞离心取沉淀,用PBS冲洗3次,使用RNA抽提试剂盒提取RNA。将得到的产物使用反转录试剂盒进行反转录,得到cDNA原液。将cDNA原液使用去离子水稀释20倍,并按照说明书,使用Applied Biosystems™ SYBR™ Green预混液配制10 μL PCR反应体系。用Realtime-qPCR仪进行qRT-PCR,并使用配套软件进行CT值计算。以β-actin作为对照计算RNA的相对表达量。用于qRT-PCR检测的相关基因引物序列见表1。
表1 用于qRT-PCR检测的引物序列
Tab 1
| Primer | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| FBXO38 | AACGGTACTCGGCGTTACTC | TGTTTTGGCTACTTCTGACAATTC |
| ACTIN | CTCCATCCTGGCCTCGCTGT | GCTGTCACCTTCACCGTTCC |
| MDM2 | AGGAGATTTGTTTGGCGTGC | TGAGTCCGATGATTCCTGCTG |
| TP53 | AAGTCTAGAGCCACCGTCCA | CAGTCTGGCTGCCAATCCA |
1.2.3 Western blotting
将细胞沉淀和肿瘤样品用蛋白裂解液RIPA于冰上裂解,并在4 ℃下10 000 ×g离心收集蛋白质上清液。样品定量后取60 μg总蛋白上样,进行聚丙烯酰胺凝胶电泳(SDS-PAGE),80 V电泳2 h。待蛋白条带分离充分,将蛋白质转膜至PVDF膜上。在室温下用5% BSA封闭1 h后,将膜与相应浓度的一抗在4 ℃下孵育过夜。使用的一抗包括:anti-FBXO38抗体、anti-p-PI3K抗体、anti-p-Akt抗体、anti-PTEN抗体、anti-MDM2抗体、anti-P53抗体、anti-P21抗体和anti-ACTIN抗体,稀释比例均为1∶1 000。待一抗孵育结束后,使用1×TBST溶液室温摇床清洗膜3次,每次5 min。将膜与荧光二抗于室温下共同孵育1 h。使用的二抗包括StarBright Blue 520鼠源IgG二抗和Alexa Fluor Plus 800兔源IgG二抗,稀释比例均为1∶10 000。再次使用1×TBST溶液重复清洗膜3次。将膜置于Odyssey红外成像系统中进行显像。
1.2.4 克隆形成实验
取对数生长期的各组细胞,用胰蛋白酶消化并吹打成单个细胞悬液后计数。将FBXO38敲低组、FBXO38过表达组以及对照组同时以等量个数的细胞,接种于含2 mL 37 ℃预热培养液的六孔板中,置于细胞培养箱中培养。培养至14 d,当六孔板中细胞群落有所粘连时,终止培养。每孔中加入4%多聚甲醛1 mL,低速摇床上固定细胞5 min。弃固定液,加入10%结晶紫溶液1 mL染色30 min。轻柔地洗净平板,置于室温下自然干燥。使用扫描仪获取细胞克隆照片,ImageJ软件进行计数并统计每个孔板中细胞群落的个数。
1.2.5 BrdU免疫荧光染色
将细胞提前接种至爬片上,使用10 μg/mL 5-溴-2'-脱氧尿苷(5‑bromo‑ 2‑deoxyuridine,BrdU;1∶1 000)染色1 h。PBS清洗爬片2次后,使用甲醇固定30 min。用1 mol/L HCl处理细胞,并用10%胎牛血清封闭1 h,然后使用anti-BrdU的单克隆大鼠一抗(1∶200)以及Alexa Fluor 594 Plus兔源IgG二抗(1∶1 000)分别孵育1 h。最后加入DAPI用于核染色。荧光图像由Pannoramic MIDI病理扫描仪获得,使用ImageJ软件计算BrdU阳性细胞率。
1.2.6 CCK8检测细胞增殖和药物抑制率
在96孔板中接种细胞悬液,并在培养箱中预培养24 h。待细胞贴壁之后,弃上清液,加入不同浓度的待测药物,再次培养24 h。每孔中加入10 μL CCK8溶液,共培养4 h。用酶标仪测定在450 nm处的吸光度。利用对照孔、实验孔和空白孔的吸光度计算药物抑制率。
1.2.7 数据库分析
下载肿瘤基因组图谱计划数据库(The Cancer Genome Atlas,TCGA)中TCGA_SKCM(n=470)和TCGA_UM(n=80)数据集。依据中分位数将样本分为FBXO38高表达组和FBXO38低表达组,用DESeq2 R软件包(1.16.1)进行差异表达基因分析。筛选条件为:|log2[差异倍数(fold change)]|≤2,错误发现率(false discovery rate,FDR)<0.05。通过clusterProfiler R包进行差异表达基因的京都基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.3 统计学分析
用GraphPad Prism 7.0软件进行统计学分析。定量资料采用x±s表示。使用非配对t检验比较2组之间的差异。P<0.05表示差异具有统计学意义。
2 结果
2.1 FBXO38 敲低和过表达细胞系的建立及验证
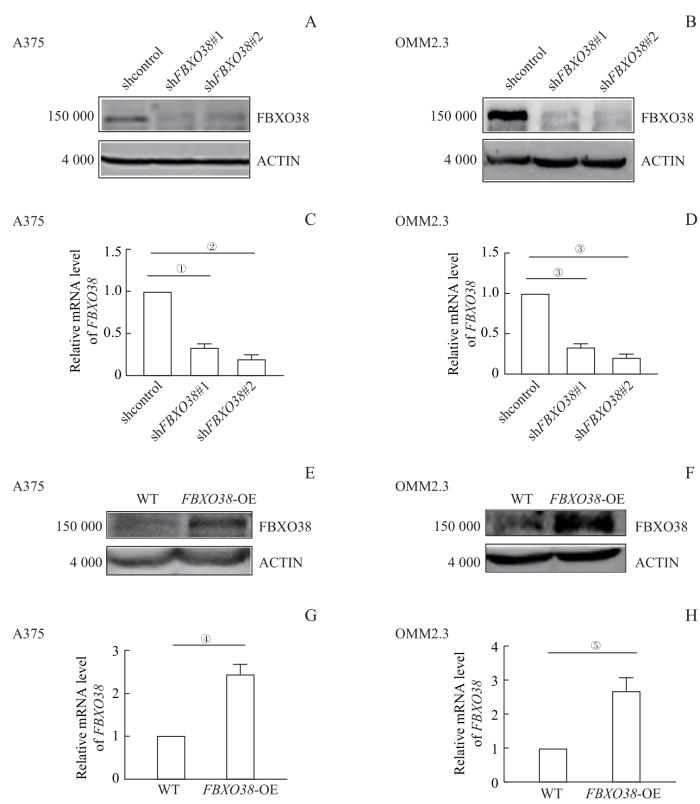
结合FBXO38在黑色素瘤细胞系中的实际表达量,选取人SKCM细胞系A375和人UM细胞系OMM2.3作为研究对象,并基于这些细胞构建FBXO38敲低稳转细胞系以及对照细胞系。Western blotting验证FBXO38蛋白在2个细胞系中的表达均得到了有效的抑制(图1A、B)。qRT-PCR检测结果也显示shFBXO38组中FBXO38的转录水平相较于对照组显著降低(图1C、D,均P<0.05)。随后构建FBXO38过表达细胞系,Western blotting(图1E、F)和qRT-PCR(图1G、H,均P<0.05)结果均显示过表达FBXO38组中FBXO38的蛋白表达水平和转录水平相较于野生型细胞显著提高。
图1
图1
FBXO38 敲低和过表达细胞系构建
Note: A/B. Expression of FBXO38 in control and FBXO38-knockdown A375 cell line (A) and OMM2.3 cell line (B) detected by Western blotting. C/D. Transcription level of FBXO38 in FBXO38-knockdown groups compared with control A375 cell line (C) and OMM2.3 cell line (D) detected by qRT-PCR.E/F. Expression of FBXO38 in wild type and FBXO38 overexpression A375 cell line (E) and OMM2.3 cell line (F) detected by Western blotting. G/H. Transcription level of FBXO38 in FBXO38 overexpression compared with wild type A375 cell line (G) and OMM2.3 cell line (H) detected by qRT-PCR. ①P=0.013, ②P=0.012, ③P=0.001, ④P =0.008, ⑤P =0.016.
Fig 1
Construction of FBXO38 knockdown and overexpression cell lines
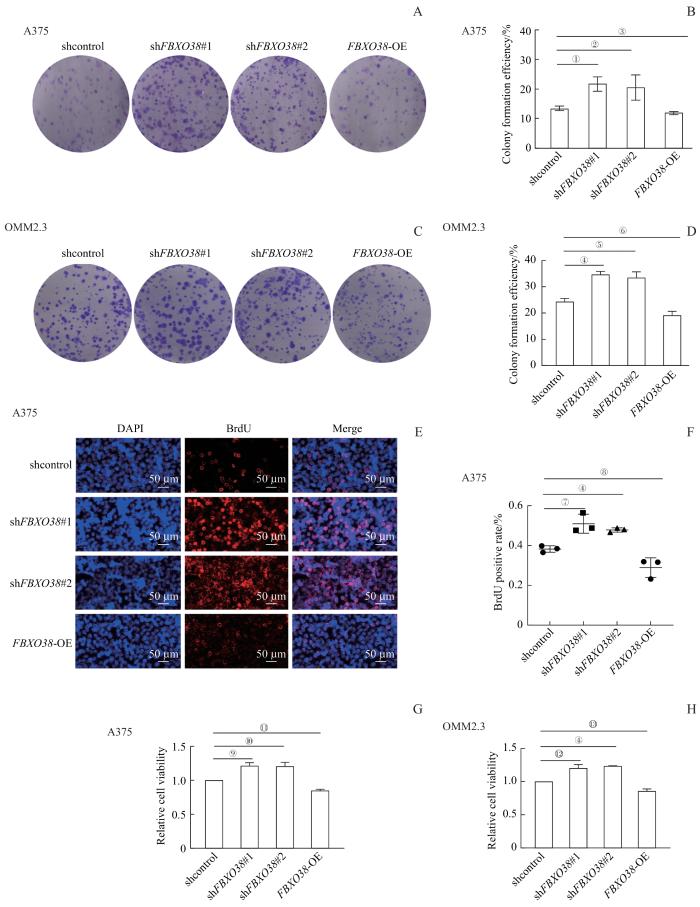
2.2 FBXO38 的表达对黑色素瘤细胞增殖的影响
图2
图2
FBXO38 敲低或者过表达对黑色素瘤细胞增殖的影响
Note: A. Representative images of colony formation in FBXO38 knockdown and overexpression A375 cells. B. Colony formation efficiency of A375 cell lines after 7-d incubation. C. Representative images of colony formation on FBXO38 knockdown and overexpression OMM2.3 cells. D. Colony formation efficiency of OMM2.3 cell lines after 7-d incubation. E. Immunofluorescence staining of BrdU in FBXO38 knockdown and overexpression A375 cells. Scale bars, 50 μm. F. The percentage of BrdU positive A375 cells. G/H. Cell viability of FBXO38 knockdown and overexpression A375 cells (G) and OMM2.3 cells (H) detected by CCK8 assay. ①P=0.046, ②P=0.048, ③P=0.039, ④P=0.001, ⑤P=0.003, ⑥P=0.010, ⑦P=0.012, ⑧P=0.036, ⑨P=0.024, ⑩P=0.033, ⑪P=0.005, ⑫P=0.016, ⑬P=0.017.
Fig 2
Effect of FBXO38 knockdown or overexpression on the proliferation of melanoma cells
为进一步证实FBXO38表达对眼部黑色素瘤细胞增殖的影响,使用BrdU染料对细胞系进行免疫荧光染色,并统计BrdU阳性细胞比例(图2E、F)。结果显示,在A375细胞系中,相较于对照组,FBXO38敲低细胞系中BrdU阳性细胞率显著上升(均P<0.05);同时,过表达FBXO38细胞系中BrdU阳性细胞率相比对照组显著下降(均P<0.05)。
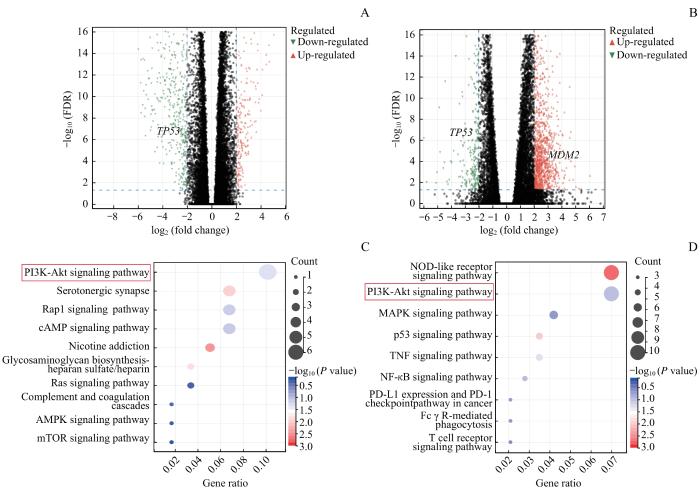
2.3 FBXO38表达有关的基因的信号通路富集分析
图3
图3
与 FBXO38 相关的差异表达基因富集分析
Note:A/B. Volcano plot of differentially expressed genes between different FBXO38 expression groups in TCGA SKCM (A) and UM (B). C/D. KEGG analysis of differentially expressed genes between different FBXO38 expression groups in SKCM (C) and UM (D) in TCGA datasets.
Fig 3
Enrichment analysis of
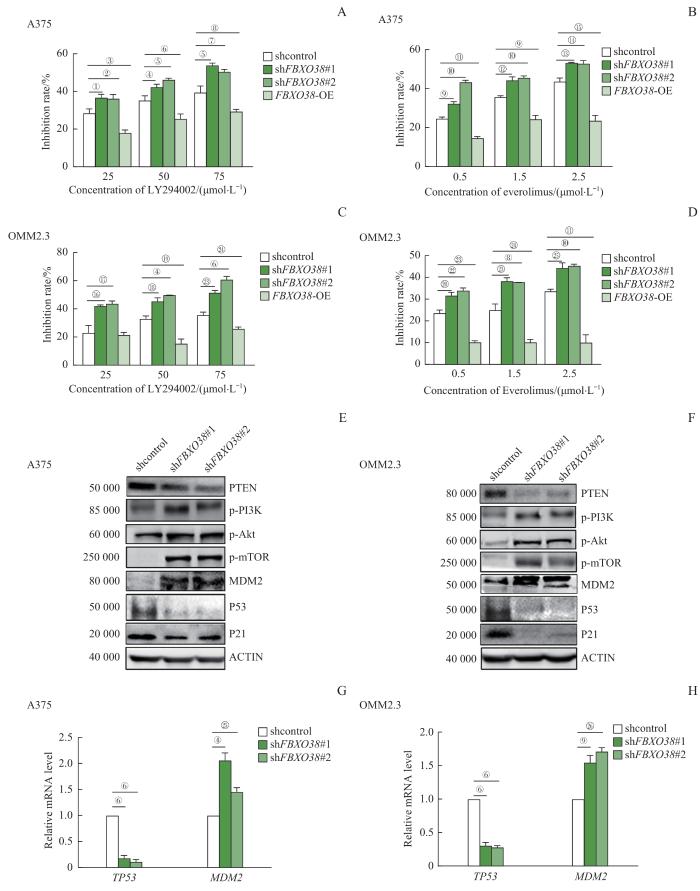
2.4 FBXO38 与PI3K-Akt信号通路相关性的体外实验验证
为探究FBXO38表达与PI3K-Akt信号通路的相关性,使用PI3K抑制剂LY294002和mTOR1抑制剂Everolimus对构建的FBXO38敲低或者过表达细胞系进行处理;在共培养24 h后,使用CCK8试剂盒检测细胞增殖水平并计算药物抑制率。与对照组相比,2种药物对FBXO38敲低组的抑制率显著提高(图4A~D,均P<0.05),对过表达FBXO38组的抑制率显著降低(均P<0.05)。
图4
图4
FBXO38 对PI3K-Akt信号通路和下游分子的调节
Note: A/B. Detection of inhibition rate of different concentration of LY294002 (A) or Everolimus (B) on A375 cells after 24 h of treatment by using CCK8 assay. C/D. Detection of inhibition rate of different concentration of LY294002 (C) or Everolimus (D) on OMM2.3 cells after 24 h of treatment by using CCK8 assay. E/F. Expression of p-PI3K, p-Akt, p-mTOR, PTEN, MDM2, P53 and P21 in FBXO38 knockdown and control A375 cells (E) and OMM2.3 cells (F) detected by Western blotting. G/H. Transcription level of TP53 and MDM2 in FBXO38 knockdown and control A375 cells (G) and OMM2.3 cells (H) detected by qRT-PCR. ①P=0.003, ②P=0.030, ③P=0.044, ④P=0.006, ⑤P=0.013, ⑥P=0.001, ⑦P=0.041, ⑧P=0.017, ⑨P=0.012, ⑩P=0.004, ⑪P=0.011, ⑫P=0.027, ⑬P=0.015, ⑭P=0.006, ⑮P=0.014, ⑯P=0.033, 17P=0.040, 18P=0.048, 19P=0.005, 20P=0.020, 21P=0.042, 22P=0.024, 23P=0.008, 24P=0.023, 25P=0.010, 26P=0.002.
Fig 4
Regulation of FBXO38 on the PI3K-Akt signaling pathway and downstream molecular
PI3K-Akt信号通路的活化方式主要依赖于磷酸化PI3K、AKT和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)。使用Western blotting检测FBXO38敲低A375和OMM2.3细胞系中相关磷酸化蛋白的水平,结果显示,PI3K、AKT和mTOR蛋白的磷酸化水平上升(图4E、F)。说明敲低FBXO38可激活PI3K-Akt信号通路。
为了探究FBXO38表达对肿瘤细胞增殖的影响是否与PI3K-Akt信号通路的启动和下游分子MDM2、P53以及P21的表达相关,使用Western blotting检测FBXO38敲低A375和OMM2.3细胞系中相关蛋白水平。对比对照组,在FBXO38敲低的肿瘤细胞中,PTEN、P53和P21蛋白水平显著下降,同时MDM2蛋白水平显著上升(图4E、F)。同时,使用qRT-PCR检测FBXO38敲低A375(图4G)和OMM2.3(图4H)细胞系中P53和MDM2的转录水平。结果显示,对比对照组,在FBXO38敲低细胞中TP53的转录水平显著下降(均P<0.05),而MDM2的转录水平显著上升(均P<0.05)。这说明FBXO38缺陷可激活PI3K-Akt信号通路,进而通过影响MDM2以及细胞周期蛋白P53和P21的转录和蛋白水平,促进黑色素瘤细胞的增殖。
3 讨论
作为SCF蛋白E3泛素连接酶复合物的成员,FBXO38可以通过泛素化和蛋白酶体降解参与多个细胞过程[10]。针对FBXO38的研究较少,既往的文献主要集中于FBXO38对于细胞动力学、染色体稳定性以及细胞周期中的作用。GEORGES等[11]的研究表明FBXO38可以独立于SCF复合物来稳定驱动蛋白家族成员20B(kinesin family member 20B,KIF20B),FBXO38的缺失可以表现为人胃癌AGS细胞的动力学缺陷。DIBUS等[12]发现FBXO38可以通过泛素化和蛋白酶体依赖性降解控制X连锁锌指蛋白复制B(zinc finger X-linked duplicated B,ZXDB)蛋白的稳定性,进而调节丝粒染色体的稳定性。此外,据报道[13],低表达Fbxo38的C57BL/6N小鼠表现出较弱的全反式维甲酸染色,精原细胞数目明显减少,并伴随着精子产量的显著下降和生育能力的降低,提示FBXO38在生殖系统中维持生殖细胞稳定性的作用。AKÇIMEN等[14]则报道FBXO38突变可导致早发性远端遗传性运动神经元病的发生。但是,FBXO38在眼部黑色素瘤中的作用未有报道,且FBXO38对于肿瘤细胞增殖相关通路的影响尚不清楚。
本研究选取人SKCM细胞系A375和UM细胞系OMM2.3作为研究对象。由于缺乏成熟的CM细胞系,且既往文献在对CM进行RNA-seq测序后,认为TCGA数据库SKCM的基因组分类可很好地适用于CM[15],故本研究使用SKCM细胞系A375代替CM细胞系探索FBXO38在CM中的功能。通过构建FBXO38敲低肿瘤细胞系,并进行克隆形成、BrdU荧光染色和CCK8细胞增殖实验,发现在2种黑色素瘤细胞中,FBXO38缺陷均能促进肿瘤细胞增殖和克隆形成能力。文献[12]证实,使用空载质粒为基础的慢病毒载体构建对照细胞(shCtrl),与野生型细胞的表型没有差异。本实验使用的慢病毒载体体系,可降低启动子插入并激活其余致癌基因的风险,有较高的生物安全性[16]。本研究中,验证FBXO38过表达细胞的增殖能力时采用shCtrl作为对照,发现对比对照组,过表达FBXO38能抑制细胞增殖能力。
为进一步揭示FBXO38敲减促进黑色素瘤细胞增殖的原因,使用TCGA数据库挖掘与FBXO38相关的差异基因和通路,发现在SKCM和UM中,FBXO38的不同表达量可影响PI3K-Akt信号通路的激活与否。经典的PI3K-Akt途径与多种生理活动的调节有关,包括细胞增殖、分化、凋亡、血管生成和蛋白质合成[17-18]。既往文献[19]报道,上游分子PTEN的表达下调,可以诱导PI3K-Akt途径的过度和持续激活,导致黑色素瘤细胞增殖。同时,PI3K/Akt/mTOR信号通路的激活被证实与UM细胞的增殖密切相关[20]。本研究中,使用PI3K抑制剂LY294002和mTOR1抑制剂Everolimus分别与细胞在体外共培养检测药物抑制率,对比对照组发现在FBXO38敲低组药物的抑制率显著上升,反之在过表达组药物抑制率显著下降。说明FBXO38的表达可影响2种PI3K/Akt/mTOR信号通路抑制剂的肿瘤抑制效果。
文献[21]报道,PTEN是一种肿瘤抑制因子,可将质膜内源蛋白3(plasma membrane intrinsic protein 3,PIP3)转化为质膜内源蛋白2(plasma membrane intrinsic protein 2,PIP2),并负调控PI3K-Akt信号通路。当PTEN突变或转化为失活形式时,PI3K可磷酸化膜结合蛋白PIP2,从而生成PIP3,进而磷酸化下游的Akt蛋白,启动PI3K-Akt信号通路[21]。激活的PI3K-Akt信号通路可激活下游启动子MDM2,抑制肿瘤抑制因子P53蛋白[22]和细胞周期蛋白P21[23],进而推动细胞周期进行。MDM2是诱导肿瘤发生的癌基因,其转录水平受到P53蛋白水平和DNA损伤调控[24];同时,在激活的PI3K-Akt信号通路的影响下,核易位后的MDM2可与P53结合,从而抑制P53的转录[25-26]。此外,在蛋白水平,MDM2可与P53结合,并通过蛋白酶体促进其降解[27-28]。在本研究中,我们检测了下游细胞周期蛋白P53和启动子基因MDM2的转录和蛋白水平,发现在FBXO38敲低的黑色素瘤细胞中,P53的表达显著下降,MDM2的表达显著上升,符合FBXO38敲低后可促进肿瘤增殖的结论,说明FBXO38可通过PI3K-Akt信号通路调控肿瘤细胞增殖。
综上所述,FBXO38参与眼部黑色素瘤的增殖调控,并且这种作用与PI3K-Akt信号通路密切相关。该研究为眼部黑色素瘤的靶向治疗提供了潜在的靶点,但相关作用机制仍需进行更深入的探索。
作者贡献声明
吴以加、房燕、沈菲洋负责生物学实验操作,黄蕊负责生物信息学分析;吴以加、沈键锋负责实验设计;吴以加、沈键锋、范先群负责论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The biological experiment was completed by WU Yijia, FANG Yan, and SHEN Feiyang. Bioinformatics analysis was performed by HUANG Rui. The study was designed by WU Yijia and SHEN Jianfeng. The manuscript was drafted and revised by WU Yijia, SHEN Jianfeng and FAN Xianqun. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献