新型冠状病毒感染(coronavirus disease-2019,COVID-19)由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus-2,SARS-CoV-2)引起。SARS-CoV-2通过呼吸道传播,除了感染呼吸系统,还会造成其他组织的损伤,进而导致多种并发症的发生[1]。急性肾损伤(acute kidney injury,AKI)是COVID-19常见的并发症之一,往往伴随着更高的感染死亡率[2]。一项大型观察性研究报告发现新冠感染住院患者中COVID-19相关AKI的发生率为28%~34%,重症监护治疗的COVID-19患者中AKI发生率高达46%~77%[3]。COVID-19引起的AKI通常伴随有塌陷性局灶节段性肾小球硬化、血栓性微血管病和急性肾小管坏死等,进而造成COVID-19患者死亡率的增高[4]。因此,在COVID-19患者发病早期探寻COVID-19合并AKI的生物标志物,对于预防疾病进展具有重要的临床意义。
肾脏组织是高表达SARS-CoV-2病毒受体的器官之一。已有的研究显示SARS-CoV-2可以通过血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE 2)受体感染肾脏足细胞和近曲小管细胞引发感染后,引起细胞因子的大量产生,从而导致肾脏组织损伤[5-6]。肾脏驻留巨噬细胞(kidney resident macrophage,KRM)与肾脏局部的炎症密切有关[7],病毒蛋白可诱导巨噬细胞快速应答并产生大量的炎症因子和趋化因子[8]。SARS-CoV-2感染时,活化的巨噬细胞能否通过与肾小管上皮细胞相互作用,引起上皮细胞损伤,是COVID-19合并KI的主要机制,值得进一步研究。
本研究拟通过分析COVID-19患者发病早期外周炎症因子和趋化因子水平,以获得COVID-19合并KI的生物标志物,并采用人巨噬细胞系THP-1和人近曲小管细胞系HK-2建立体外培养模型,进一步探讨SARS-CoV-2病毒蛋白通过影响巨噬细胞和肾脏细胞之间的相互作用引起肾脏损伤的免疫机制。
1 对象与方法
1.1 研究对象
1.1.1 研究对象和样本收集
回顾性分析2022年12月—2023年2月期间于上海交通大学医学院附属第九人民医院招募的接受住院治疗的39名COVID-19患者的临床症状、实验室检测和肺部影像学结果,将COVID-19病灶面积小于50%的定义为轻度(moderate),面积大于或等于50%定义为重症(severe)。采用促凝管收集患者外周血样本,分离血清,用于检测炎症标志物(如细胞因子和趋化因子等)的水平。
1.1.2 细胞系
人巨噬细胞系THP-1和人肾皮质近曲小管上皮细胞系HK-2均为实验室保存细胞系。
1.1.3 试剂
RPMI-1640培养基、青霉素-链霉素(penicillin-streptomycin,P/S)、庆大霉素/两性霉素(gentamicin-amphotericin,G/A)均购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS)购自美国bioexploer公司;佛波醇12-肉豆蔻酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)购自美国Sigma公司;杜氏改良eagle培养基(Dulbecco′s modified Eagle medium/nutrient mixture F-12,DMEM/F-12)购自上海源培生物科技股份有限公司;SARS-CoV-2刺突蛋白S1亚基重组蛋白购自瑞博奥(广州)生物科技股份有限公司,该蛋白为SARS-CoV-2刺突蛋白S蛋白Val 16-Gln 690片段,相对分子量为75 000,来自于大肠埃希菌(Escherichia coli)表达,并经过去内毒素处理;抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)单克隆抗体(英夫利昔单抗,infliximab)购自美国MCE公司;TaKaRa PrimeScriptTM RT试剂盒和TaKaRa TB Green Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒均购自宝生物工程(大连)有限公司,人TNF-α未包板酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国Invitrogen公司,人白细胞介素-1β(interleukin-1β,IL-1β)Mini ABTS ELISA试剂盒与人C-X-C基序趋化因子配体10(chemokine C-X-C motif ligand 10,CXCL10)标准TMB ELISA试剂盒均购自美国Peprotech公司。
1.1.4 设备
全自动化学分析仪(BECKMAN COULTER,AU5800),全自动五分类血液分析仪[XE-5000,希森美康医用电子(上海)有限公司],流式细胞仪(BD FACSCanto II,美国BD公司),免疫分析仪(IMMULITE® 1000系统,德国西门子公司),NanoDrop One分光光度仪(美国赛默飞公司),ViiA ™ 7实时PCR系统(美国赛默飞公司)。
1.2 研究方法
1.2.1 COVID-19患者外周免疫细胞亚群检测
使用全自动五分类血液分析仪进行外周血细胞(白细胞、淋巴细胞、单核细胞、中性粒细胞和血小板)计数。使用流式细胞仪对淋巴细胞亚群(CD3+、CD4+和CD8+ T淋巴细胞,B细胞和自然杀伤细胞)进行分析。
1.2.2 COVID-19患者外周炎症因子水平检测
使用免疫分析仪测量临床样本中炎症因子如TNF-α、IL-1β、IL-6、IL-8、IL-10和IL-2R的水平。
1.2.3 COVID-19患者外周肌酐水平检测
使用全自动化学分析仪检测肌酐水平,其中男性和女性的肌酐参考值分别为64~104 µmol/L和49~90 µmol/L。肌酐水平高于正常上限的患者均被认为发生KI。
1.2.4 SARS-CoV-2刺突蛋白S1片段处理THP-1细胞
将THP-1细胞接种在10 cm培养皿上,置于含有FBS(φ=10%)和P/S(φ=1%)的RPMI-1640完全培养基中于37 ℃、5% CO2条件下培养。加入PMA(100 ng/mL)处理24 h后,收集细胞,在无PMA的RPMI-1640培养基中继续培养24 h,后加入S1蛋白至终浓度为500 ng/mL,继续培养4 h或8 h,分别收集细胞和上清。
1.2.5 HK-2细胞培养
HK-2细胞以2.5×105个/孔的浓度接种在6孔板中,置于含FBS(φ=10%)和G/A(φ=1%)溶液的DMEM/F-12培养液(HK-2完全培养基)中,于37 ℃、5% CO2条件下培养8 h。后用预热的PBS清洗细胞。将经S1蛋白处理的THP-1细胞培养上清(4 h和8 h)与HK-2完全培养基以1∶1体积比混合,重悬HK-2细胞后,继续培养。
1.2.6 抗体阻断实验
收集经S1蛋白处理的THP-1巨噬细胞培养上清(8 h),将上清与HK-2细胞完全培养基以1∶1体积比混合,并加入抗TNF-α抗体(英夫利昔单抗,Infliximab)至终浓度为10和30 µg/mL,加入HK-2细胞中,继续培养24 h。
1.2.7 ELISA
根据商用ELISA试剂盒使用说明,检测细胞培养上清中炎症因子TNF-α、IL-1β和CXCL10的含量。
1.2.8 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)
使用TRIzol处理收集的细胞,采用TRIzol提取总RNA,使用NanoDrop One分光光度仪测量RNA浓度。取500 ng RNA,使用TaKaRa PrimeScriptTM RT试剂盒进行反转录。使用TaKaRa TB Green Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒按照制造商的说明进行操作,在ViiA ™ 7实时PCR系统进行检测。检测的靶基因为炎症因子(TNF-α和IL1-β)和趋化因子(CXCL10),选取ACTB或GAPDH作为内参,通过
表1 RT-PCR引物列表
Tab 1
| Target gene | Primer sequence (5′→3′) | |
|---|---|---|
| IL1-β | Forward | ATGATGGCTTATTACAGTGGCAA |
| Reverse | GTCGGAGATTCGTAGCTGGA | |
| TNF-α | Forward | CTCTTCTGCCTGCTGCACTTTG |
| Reverse | ATGGGCTACAGGCTTGTCACTC | |
| CXCL10 | Forward | GTGGCATTCAAGGAGTACCTC |
| Reverse | TGATGGCCTTCGATTCTGGATT | |
| ACTB | Forward | CACCATTGGCAATGAGCGGTTC |
| Reverse | AGGTCTTTGCGGATGTCCACGT | |
| GAPDH | Forward | GGAGCGAGATCCCTCCAAAAT |
| Reverse | GGCTGTTGTCATACTTCTCATGG | |
1.3 统计学分析
使用GraphPad Prism 9.5软件分析数据并生成图表。数据经检验均符合正态分布,采用x±s表示。使用非配对t检验进行组间比较,使用单因素方差分析(one-way ANOVA)进行多组间比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 研究队列特征
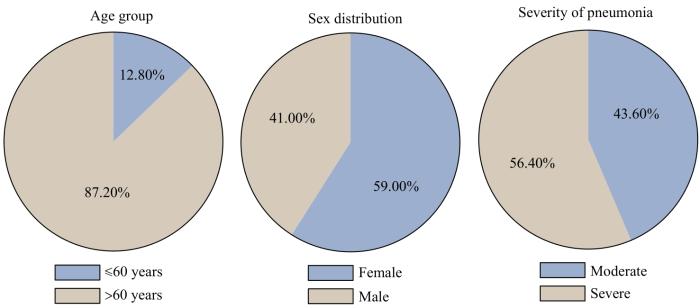
纳入本研究的39例患者中,60岁以上的患者人数为34人,占比为87.20%,男性比例为59.00%(n=23)。根据临床信息,在所有患者中,56.40%患者(n=22)为重症(图1)。
图1
2.2 COVID-19患者外周免疫特征
将纳入本研究的患者按照性别、年龄和疾病严重程度进行分组后,对其外周白细胞(white blood cell,WBC)、中性粒细胞(neutrophil)、淋巴细胞(lymphocyte)、单核细胞(monocyte)、血小板(platelet)、CD3+ T细胞、CD4+T细胞、CD8+T细胞、B细胞和自然杀伤(nature killer,NK)细胞等免疫细胞进行比较分析,结果显示按照性别(男/女)和年龄(≤60岁和>60岁)分组后,各类免疫细胞的比例在2组见无显著性差异(P>0.05)。按照疾病严重程度进行分组后,与轻症组患者[(641.50±398.40)个/μL]相比,重症组患者[(440.23±277.30)个/μL]的CD3+ T细胞计数更低,但差异不具统计学意义(P=0.050)(表2)。
表2 COVID-19患者外周免疫细胞计数比较
Tab 2
| Item | Sex | Age group | Severity of pneumonia | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Male | Female | P value | ≤60 years | >60 years | P value | Moderate | Severe | P value | |
| WBC/(109‧L-1) | 8.82±4.40 | 6.00±3.50 | 0.065 | 5.67±2.40 | 7.92±4.40 | 0.355 | 8.05±4.90 | 7.39±3.80 | 0.910 |
| Neutrophil/% | 77.06±14.70 | 77.92±10.90 | 0.808 | 77.57±6.40 | 77.39±13.80 | 0.437 | 72.86±16.10 | 80.88±9.30 | 0.100 |
| Lymphocyte/% | 15.21±13.50 | 15.32±9.50 | 0.830 | 15.57±4.80 | 15.22±12.60 | 0.355 | 19.96±15.50 | 11.67±6.80 | 0.060 |
| Monocyte/% | 6.74±3.60 | 5.82±2.30 | 0.368 | 6.40±4.20 | 6.36±3.10 | 0.721 | 6.19±2.80 | 6.50±3.50 | 0.734 |
| Platelet/(109‧L-1) | 211.95±100.80 | 199.66±90.50 | 0.775 | 282.75±139.40 | 197.78±87.50 | 0.585 | 202.25±54.00 | 210.57±119.30 | 1.000 |
| CD3+ T cell/µL-1 | 519.81±359.10 | 538.20±335.50 | 0.914 | 719.00±190.50 | 504.03±354.10 | 0.078 | 641.50±398.40 | 440.23±277.30 | 0.050 |
| CD4+ T cell/µL-1 | 255.63±143.80 | 318.60±237.90 | 0.722 | 386.75±127.70 | 268.36±190.60 | 0.156 | 309.62±152.40 | 259.47±211.10 | 0.137 |
| CD8+ T cell/µL-1 | 242.59±278.90 | 198.73±148.20 | 0.643 | 323.75±223.00 | 212.81±234.80 | 0.261 | 298.18±321.20 | 168.90±113.60 | 0.104 |
| B cell/µL-1 | 491.95±1 832.50 | 133.66±124.40 | 0.734 | 159.50±119.20 | 369.39±1 496.60 | 0.463 | 673.25±2 140.70 | 97.90±82.10 | 0.122 |
| NK cell/µL-1 | 154.63±118.50 | 145.60±224.80 | 0.205 | 123.00±113.40 | 154.36±173.30 | 0.642 | 155.93±124.90 | 147.19±196.00 | 0.263 |
2.3 COVID-19患者中KI的发病率
表3 COVID-19患者外周肌酐水平和KI情况
Tab 3
| Group | Creatinine level in COVID-19 cohort/(µmol‧L-1) | Status of KI | ||||
|---|---|---|---|---|---|---|
| Mean | Min. value | Max. value | KI/n (%) | Non-KI/n (%) | P value | |
| Total | 113.30±166.20 | 36.00 | 1 041.00 | 8 (20.50) | 31 (79.50) | |
| Gender | 0.575 | |||||
| Male | 140.73±211.40 | 36.00 | 1 041.00 | 5 (21.70) | 18 (78.30) | |
| Female | 73.87±40.30 | 38.00 | 175.00 | 3 (18.70) | 13 (81.30) | |
| Age/year | 0.171 | |||||
| ≤60 | 249.20±442.80 | 38.00 | 1 041.00 | 1 (20.00) | 4 (80.00) | |
| 61‒70 | 80.62±65.50 | 36.00 | 236.00 | 1 (12.50) | 7 (87.50) | |
| 71‒80 | 87.28±73.90 | 40.00 | 336.00 | 1 (7.10) | 13 (92.90) | |
| >80 | 108.83±70.00 | 56.00 | 294.00 | 5 (41.70) | 7 (58.30) | |
2.4 COVID-19合并KI患者外周炎症因子的水平
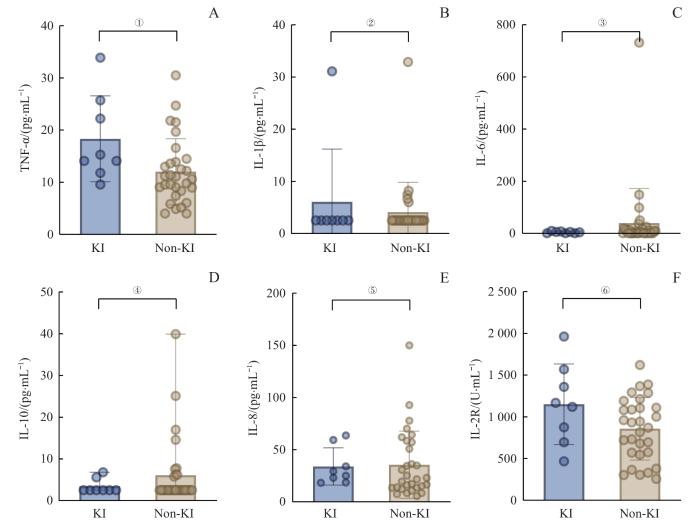
将39名COVID-19患者根据是否合并KI分为2组后,比较2组患者外周炎症因子(TNF-α、IL-1β、IL-6、IL-10)、趋化因子(IL-8)和可溶性IL-2受体(IL-2R)的水平,结果显示COVID-19合并KI组患者外周TNF-α水平[(18.33±8.20)pg/mL]显著高于非KI(non-KI)组[(11.88±6.50)pg/mL](P=0.015),其他炎症分子的含量在2组中没有统计学差异(图2)。
图2
图2
COVID-19和COVID-19合并KI患者外周炎症因子水平
Note: A. TNF-α level. B. IL-1β level. C. IL-6 level. D. IL-10 level. E. IL-8 level. F. IL-2R level. ①P=0.015, ②P=0.931, ③P=0.428, ④P=0.598, ⑤P=0.470, ⑥P=0.130.
Fig 2
Levels of peripheral inflammatory factors in non-KI (n=30) and KI (n=8) group
2.5 SARS-CoV-2 S1蛋白对巨噬细胞炎症因子分泌的影响
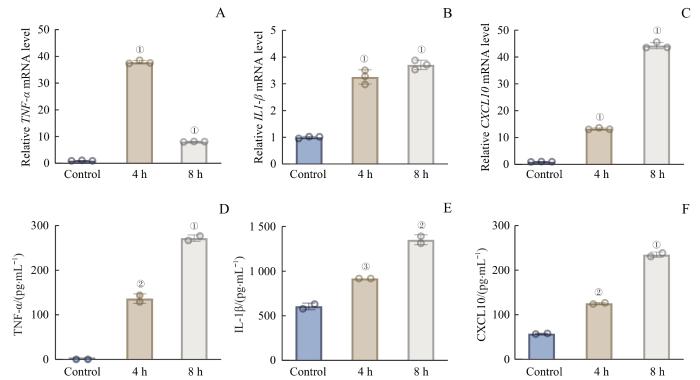
为了进一步探究新冠病毒感染对巨噬细胞的影响,我们首先将THP-1通过PMA处理诱导为巨噬细胞,然后加入SARS-CoV-2 S1亚基重组蛋白(纯度>80%)进行处理,并在处理4 h和8 h后收集细胞和培养上清。采用qRT-PCR方法检测经S1亚基蛋白刺激后THP-1细胞的炎症因子的基因表达水平。结果显示,与对照组相比,S1亚基处理细胞4 h和8 h后,巨噬细胞的炎症因子基因TNF-α、IL1-β和CXCL10(均P<0.001)的表达量显著上调(图3A‒C)。其中巨噬细胞经重组蛋白刺激4 h后,TNF-α的转录水平明显升高,但是在处理8 h后TNF-α水平下降,同时巨噬细胞IL1-β和CXCL10的转录水平在重组蛋白处理4 h和8 h持续升高。采用ELISA方法检测培养上清中炎症因子的水平,结果显示细胞培养上清中TNF-α、IL-1β和CXCL10的水平随着重组蛋白刺激时间的延长而发生明显升高(图3D‒F;TNF-α:4 h vs control,P=0.001,8 h vs control,P<0.001;IL-1β:4 h vs control,P=0.008,8 h vs control,P=0.001;CXCL10:4 h vs control,P=0.001,8h vs control,P<0.001)。上述结果显示,刺突蛋白S1亚基处理巨噬细胞后可以诱导炎症因子的表达,从而介导巨噬细胞的炎性特征。
图3
图3
SARS-CoV-2 S1重组蛋白体外刺激THP-1巨噬细胞产生炎症因子的水平
Note: A‒C. Fold changes in TNF-α (A), IL1-β (B) and CXCL10 (C) mRNA levels in THP-1 cells upon stimulation with S1 spike protein at a concentration of 500 ng/mL for 4 h and 8 h. D‒F. Levels of TNF-α (D), IL-1β (E) and CXCL10 (F) in the supernatants of THP-1 cells stimulated with S1 spike protein (500 ng/mL) for 4 h and 8 h. ①P<0.001, ②P=0.001, ③P=0.008, compared with the control.
Fig 3
Levels of inflammatory factors induced by SARS-CoV-2 S1 recombinant protein in THP-1 macrophages in vitro
2.6 S1蛋白处理的THP-1细胞培养上清可诱导HK-2细胞的炎性特征
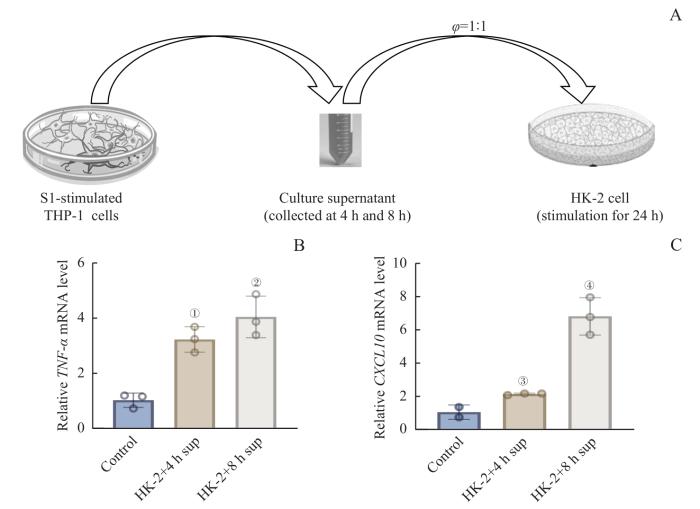
为了研究活化巨噬细胞炎性特征对肾脏细胞的影响,我们收集上述经S1亚基重组蛋白处理的THP-1巨噬细胞的培养上清,以1∶1的体积比例与HK-2细胞完全培养基进行混合制备条件培养基后,用于HK-2细胞的培养。24 h后收集HK-2细胞,采用qRT-PCR法检测细胞中炎症因子的基因表达水平(图4A)。结果显示,条件培养基处理后,HK-2细胞的炎症因子的基因表达水平明显增加,其中4 h上清处理组(HK-2+4 h sup)中HK-2细胞的TNF-α基因表达水平已显著增加(P=0.005),而8 h上清处理组(HK-2+8 h sup)中TNF-α基因表达水平与4 h上清处理组维持在相当的水平(P=0.225)(图4B);CXCL10基因表达水平的变化与TNF-α基因略有不同,4 h上清处理组中CXCL10仅发生轻微上升(P=0.324),而在8 h上清处理组CXCL10发生显著升高(P=0.001)(图4C)。上述结果表明,来自于巨噬细胞被S1蛋白处理后的培养上清可以直接诱导HK-2细胞的炎性特征。
图4
图4
经S1蛋白处理的THP-1细胞培养上清可诱导HK-2细胞的炎性特征
Note: A. Diagram of the culture of HK-2 cells in conditioned medium for 24 h. Conditioned medium was obtained by stimulating THP-1 cells with S1 spike protein (500 ng/mL) for 4 h and 8 h. B. Fold changes in TNF-α mRNA levels in HK-2 cells cultured in conditioned medium compared to control HK-2 cells. C. Fold changes in CXCL10 mRNA levels in HK-2 cells cultured in conditioned medium compared to control HK-2 cells. ①P=0.005, compared with the control; ②P=0.225, compared with the HK-2+4 h sup; ③P=0.324, compared with the control; ④P=0.001, compared with the HK-2+4 h sup.
Fig 4
Inflammatory properties of HK-2 cells induced by the supernatants from S1 protein-treated THP-1 cells
2.7 TNF-α是介导HK-2肾细胞炎性特征的因素
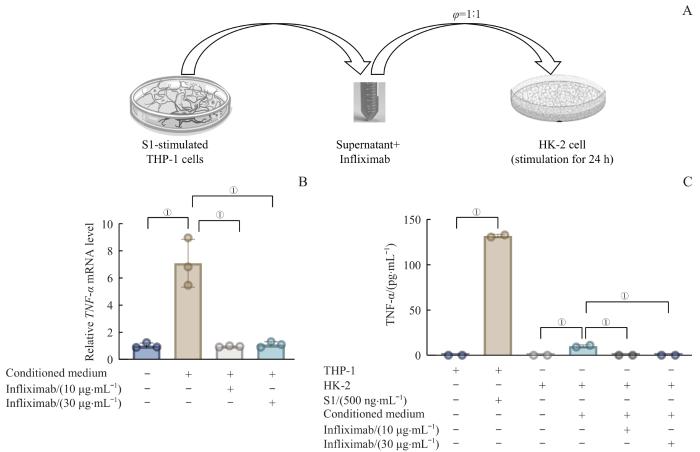
COVID-19合并KI患者临床数据和体外实验结果都提示TNF-α可能是介导肾脏细胞炎症发生的重要因素。为了验证这一点,我们使用不同浓度的抗TNF-α单克隆抗体(英夫利昔单抗,infliximab)中和经S1蛋白处理的THP-1巨噬细胞培养上清中的TNF-α,并用中和后的上清与HK-2细胞进行共培养(图5A)。结果显示,经infliximab处理的培养上清明显抑制HK-2细胞TNF-α基因转录水平的上调(P<0.001)(图5B)。同时,单抗预处理组HK-2细胞培养上清中的TNF-α水平也显著降低(P<0.001)(图5C)。上述结果表明,S1蛋白诱导的巨噬细胞产生TNF-α是介导HK-2细胞炎性特征的主要因素。
图5
图5
HK-2细胞的炎症反应依赖于S1蛋白处理THP-1细胞产生的TNF-α
Note: A. Diagram of the culture of HK-2 cells in conditioned medium with the addition of Infliximab for 24 h. Conditioned medium was obtained by stimulating THP-1 cells with S1 protein (500 ng/mL) for 8h. B. Fold changes in TNF-α mRNA levels in HK-2 cells cultured in conditioned medium with the addition of Infliximab. C. TNF-α levels in THP-1 cells stimulated with S1 spike protein and in HK-2 cells cultured in conditioned medium with or without the addition of Infliximab. ①P<0.001.
Fig 5
Dependent of Inflammatory response in HK-2 cells on TNF-α produced by S1 protein-treated THP-1 cells
3 讨论
COVID-19合并KI的发生率与流行株、患者的年龄、疫苗接种覆盖率、免疫状态和感染前的基础疾病状况等密切相关。本次研究中的COVID-19患者人群来自于2022年12月—2023年2月期间,COVID-19感染病毒株为SARS-CoV-2 Omicron BA.5/BF.7[11]。此时上海90%以上的人群已接种疫苗,因此大大降低了重症率的发生[12]。但是,在本研究队列中COVID-19患者KI发生率仍然达到20.50%。这个比例和来自美国、欧洲和巴西的大型观察性研究报告中报道的住院患者中COVID-19相关AKI的发生率(28%~34%)相近[3,13]。在中国,有报道显示AKI在所有COVID-19患者中的发生率为6.5%,但是在重症监护室患者人群中的发病率可达32.5%[14-15]。由于本研究中入组的患者均为住院患者,并伴随有多种基础性疾病(包括高血压,糖尿病等),所以KI发病率到20.50%也是具有一定的合理性。此外,本研究中大多数COVID-19患者(87.20%)属于老年人群,其中男性略多于女性。老年人群免疫力水平下降,更容易受到感染。一份报告还显示,上海老年人的疫苗接种覆盖率较低,这可能是老年人群体中COVID-19病例数较高的一个因素[12]。此外,患者临床数据显示外周血免疫细胞计数在不同年龄和性别分组的患者之间没有显著性差异,但是重症COVID-19患者的CD3+T细胞计数显著下降,而和普通COVID-19患者之间的其他细胞计数保持可比性。多项研究表明,不仅在重症COVID-19患者中,在新冠病毒感染早期都存在CD3+ T细胞亚群显著减少[16-17],可能与病毒感染后造成的CD3+T细胞过度活化后的细胞死亡(activation induced cell death,AICD)有关。COVID-19患者免疫系统在感染早期发生异常,是否会导致KI发生值得进一步深入研究。
我们的研究发现TNF-α是COVID-19合并KI组相较于非KI组常见炎症因子中显著升高的唯一分子。TNF-α作为组织损伤和炎症反应最早响应的炎症因子之一,可以影响IL-1β和IL-6的表达,诱导上皮细胞表达黏附分子和趋化因子,进而招募外周炎症细胞到达组织损伤部位,放大局部的炎症反应而导致疾病的重症化,因此阻断TNF-α也成为治疗多种炎症性自身免疫病的重要方案,如类风湿性关节炎等[18]。在COVID-19中,虽然IL-6被认为是介导细胞因子风暴和重症化的重要因素,并成为干预细胞因子风暴的重要靶点[19],但TNF-α水平同样在COVID-19患者中有所升高。本研究进一步显示TNF-α水平在COVID-19合并KI患者中显著升高。事实上,已有研究[20]报道患者血清TNF-α和IL-6水平不仅与肌酐水平相关,还与COVID-19患者的AKI有关。MEDEIROS等[21]的研究也报道了AKI患者的TNF-α水平显著升高。因此,TNF-α在COVID-19合并KI患者中的显著升高,强烈提示了该细胞因子与COVID-19合并KI的关联性。
为了分析COVID-19合并KI患者中TNF-α升高的原因,本研究首先探讨了COVID-19对巨噬细胞分泌炎症因子的影响。选择巨噬细胞为目标细胞,主要是因为巨噬细胞作为固有免疫应答的快速响应细胞,是病原感染早期产生炎症因子和趋化因子,以此抵御外来病原体的主要免疫细胞。在体外实验中,新冠病毒来源的S1亚基重组蛋白可激活人巨噬细胞THP-1,使其产生多种促炎细胞因子(IL-1β和TNF-α)和趋化因子(CXCL10)。多项研究[22-24]也证实,在受到S1刺突蛋白刺激后,THP-1细胞促炎反应显著增加。其中S1蛋白很可能是通过激活THP-1细胞膜上Toll样受体(toll-like receptor,TLR),启动下游MyD88依赖的TLR信号通路,从而引起炎症反应[8,22-23]。由于本研究使用新冠病毒来源的S1蛋白片段直接刺激肾上皮细胞系HK-2时,并不能诱导HK-2细胞产生TNF-α(未展示数据),由此认为COVID-19合并KI的炎症反应很可能是从活化巨噬细胞开始。在许多肾脏疾病中,肾脏TNFA基因的表达随着白细胞浸润而增加,如急性氨基核苷诱导的肾病模型中肾脏TNF-α的主要来源是浸润性巨噬细胞[25];在肾毒血清肾炎(一种免疫复合物介导的增生性肾小球肾炎模型)早期检测到的肾脏TNF-α,主要归因于浸润性肾小球巨噬细胞[26]。因此,本研究在患者外周检测到的COVID-19合并KI患者TNF-α的升高很大程度上与巨噬细胞的炎症反应密切相关。
事实上,巨噬细胞的浸润和活化可以进一步引起上皮细胞的特征改变[27]。在本研究中,采用被S1蛋白片段活化的THP-1巨噬细胞培养上清培养,可以显著促进HK-2细胞炎性特征的增加,HK-2细胞TNFA基因转录水平和培养上清中的TNF-α蛋白水平显著增加。肾细胞表达的TNF-α在介导肾脏炎症中的作用更直接,包括系膜细胞、足细胞和肾小管上皮细胞都可以诱导产生TNF-α[28],而活化的巨噬细胞产生的TNF-α则是诱导肾组织细胞产生TNF-α的重要启动因素之一[29]。英夫利昔单抗中和活化的巨噬细胞培养上清中的TNF-α后,肾上皮细胞系HK-2的TNFA基因转录水平显著降低,也部分证实了巨噬细胞可以通过旁分泌TNF-α的方式促进肾脏细胞炎症的加重,从而参与COVID-19合并KI的发生[8]。
综上所述,本研究结果报道了COVID-19合并KI患者外周TNF-α显著升高的临床免疫症状,其中原因可能是病毒感染后导致巨噬细胞活化,所产生的炎症因子TNF-α则可以进一步促进肾上皮细胞炎症水平的增加,进而导致肾损伤的发生。因此,靶向TNF-α有望成为减轻COVID-19患者肾脏损伤发生率的新策略。
作者贡献声明
王颖和许洁负责研究设计;王颖、许洁、陈颖盈、PANDIT Roshan、何立珩负责论文的写作和修改;PANDIT Roshan负责实验操作;许洁、卢君瑶、何立珩、包玉洁、陈颖盈负责临床样本收集;卢君瑶、包玉洁负责临床样本信息收集整理;季萍提供技术支持。所有作者均阅读了论文并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by WANG Ying and XU Jie. The manuscript was drafted and revised by WANG Ying, XU Jie, CHEN Yingying, PANDIT Roshan and HE Liheng. PANDIT Roshan performed the experiments. XU Jie, LU Junyao, HE Liheng, BAO Yujie and CHEN Yingying collected the clinical samples. LU Junyao and BAO Yujie collected clinical information of the enrolled samples. JI Ping provided technical support. All the authors have read the final version of manuscript and consented to the submission.
利益冲突声明
所有作者均披露没有相关利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献