胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是胰腺癌的主要类型,其患者的5年生存率低于10%[1]。肥胖、吸烟和2型糖尿病等危险因素与PDAC的发生、发展过程密切相关。在PDAC细胞中,最常发生突变的有癌基因如Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rats arcomaviral oncogene homolog,KRAS)和抑癌基因如细胞周期蛋白依赖性激酶抑制剂2A(cyclin dependent kinase inhibitor 2A,CDKN2A)、肿瘤抑制基因p53(tumor suppressor gene p53,TP53)、SMAD家族成员4(SMAD family member 4,SMAD4/DPC4)等[2]。研究[3]显示,PDAC组织较为致密,其细胞被丰富的成纤维间质包围,该成纤维间质可产生机械屏障,阻止血管形成并导致免疫细胞浸润不良,从而使PDAC对传统的化学治疗(化疗)和放射治疗(放疗)产生很强的抵抗。目前,有关PDAC发生、发展中关键的分子机制尚未被阐明,使得探索该疾病进程中的关键因子、寻找治疗的新靶点十分必要。
巨胞饮(macropinocytosis)是一种内体大于0.2 μm、非网格蛋白依赖的胞饮方式,可以非选择性地吞噬细胞外基质(extracellular matrix,ECM)成分[6]。早期,有关巨胞饮的研究主要集中在巨噬细胞和原核生物中[7]。2013年有研究[8]发现,具有RAS突变的胰腺癌细胞能够以巨胞饮的方式摄取细胞外蛋白进入胞内,降解为氨基酸后参与三羧酸(tricarboxylic acid cycle,TCA)循环。由于胰腺癌具有基质致密、营养缺乏的特性[9],PDAC细胞以巨胞饮的方式摄取ECM成分作为营养来支持自身生长,是一种极其重要的细胞生命活动方式[10]。同时,巨胞饮也可作为一种高效的药物递送方式,如将纳米白蛋白结合的紫杉醇(化疗药物)送至PDAC细胞内,实现药物更为高效的利用[11]。基于此,本研究结合生物信息学分析,检测SNX1在PDAC及癌旁组织中的表达,通过体外功能实验验证SNX1对PDAC细胞的增殖能力、迁移能力、巨胞饮水平、细胞凋亡的影响并探讨其分子机制,从而为SNX1作为PDAC的治疗靶标提供理论依据。
1 资料与方法
1.1 数据收集和分析
从UCSC Xena数据平台(
1.2 标本收集
选择2021年9—12月上海交通大学医学院附属仁济医院的5例PDAC手术患者,从其癌组织、癌旁组织中获取标本,并保存于4%多聚甲醛中。
1.3 实验动物、细胞、主要试剂及仪器
7周龄SPF级雄性BALB/c裸鼠10只购买于上海杰思捷实验动物有限公司,动物生产许可证为SCXK(沪)2018-0004,体质量为20~25 g。上述裸鼠饲养于华东师范大学实验动物中心的标准笼中,使用许可证SYXK(沪)2018-0028。于25 ℃、湿度50%~60%、12 h明暗交替、噪声<60 dB条件下,小鼠自由进食、饮水。
PDAC细胞系AsPC-1、Capan-1、PANC-1、MIA PaCa-2及胰腺导管上皮细胞hTERT-HPNE均购自美国模式菌种保藏中心(American Type Culture Collection,ATCC),HEK293T细胞为本实验室保存。
DMEM培养液、RPMI 1640培养液、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素双抗(Gibco,美国),四甲基罗丹明-葡聚糖(TMR-dextran)、细胞核染料DAPI(Sigma,德国),辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠/兔IgG(二抗)、Alexa Fluor 488/594标记的山羊抗小鼠/兔IgG(H+L)(上海圣尔生物科技有限公司),SNX1抗体、β-actin抗体、溶酶体相关膜蛋白1(lysosome-associated membrane protein 1,LAMP1)抗体、转化生长因子-β受体2(transforming growth factor-β receptor 2,TGFBR2)抗体(Proteintech,美国),SMAD2抗体、磷酸化SMAD2(phospho-SMAD2,p-SMAD2)抗体、SMAD3抗体、p-SMAD3抗体(Cell Signaling Technology,美国),氧化苦参碱(Oxymatrine,Oxy)(MedChemExpress,美国)。实时荧光定量PCR仪(ABI,美国),激光共聚焦显微镜、Aperio数字病理学切片扫描仪(Leica,德国),流式细胞仪(BD,美国),化学发光成像仪(Bio-Rad,美国)。
1.4 细胞培养及siRNA转染
遵循ATCC的细胞培养标准,于37 ℃、5%CO2恒温培养箱中,采用含10%FBS、1%青霉素-链霉素双抗的DMEM培养液培养hTERT-HPNE、Capan-1、PANC-1、MIA PaCa-2、HEK293T细胞,采用含10%FBS、1%青霉素-链霉素双抗的RPMI 1604培养液培养AsPC-1细胞。每隔2~3 d传代1次,取对数生长期的细胞进行后续实验。
分别将AsPC-1、Capan-1细胞均匀接种在6孔板中,待细胞生长到60%~70%融合度时,使用 jetPRIME®转染试剂按照其说明书步骤进行瞬时转染,即分别将NC-siRNA、SNX1-siRNA1、SNX1-siRNA2转染至上述2种细胞中,于37 ℃、5%CO2的培养箱中培养12 h后更换培养液继续培养,经蛋白质印迹法(Western blotting)验证后用于后续研究。其中,用于转染的siRNA由上海吉玛制药技术有限公司合成,序列信息见表1。
表1 siRNA序列
Tab 1
| siRNA | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| NC-siRNA | UUCUCCGAACGUGUCACGUTT | ACGUGACACGUUCGGAGAATT |
| SNX1-siRNA1 | GAGGAUCAAUUUGAUUUGATT | TTCUCCUAGUUAAACUAAACU |
| SNX1-siRNA2 | CAGGCCAACAAUGACUUCUTT | TTGUCCGGUUGUUACUGAAGA |
1.5 细胞中SNX1表达量检测
分别提取野生型hTERT-HPNE、AsPC-1、Capan-1、PANC-1、MIA PaCa-2细胞的总RNA,反转录成cDNA后行实时荧光定量PCR(quantitative real-time PCR,qPCR)检测,具体反应条件参照说明书。采用
表2 qPCR引物序列
Tab 2
| Primer | Forward (5′→3′) | Reverse (5′→3′) |
|---|---|---|
| 18s | TGCGAGTACTCAACACCAACA | GCATATCTTCGGCCCACA |
| SNX1 | AAGCACTCTCAGAATGGCTTC | CGGCCCTCCGTTTTTCAAG |
采用Western blotting检测上述5种细胞中SNX1的表达。分别制备细胞的蛋白悬液,按照说明书进行电泳、转膜、封闭、一抗和二抗孵育,最后用化学发光成像仪进行成像。其中,一抗为β-actin、SNX1抗体(稀释比例均为1∶1 000),HRP标记的二抗稀释比例为1∶5 000。
1.6 慢病毒包装
使用jetPRIME®转染试剂将SNX1敲除质粒(NC-shRNA、SNX1-shRNA)、SNX1过表达质粒(SNX1-Vector、SNX1-OE)分别与辅助包装质粒(psPAX2,pMD2.G)共转染HEK293T细胞,10~12 h后更换新鲜培养液继续培养48 h。收集富含慢病毒颗粒的细胞上清液,经过滤、浓缩后获得慢病毒原液。靶向SNX1的shRNA(short hairpin RNA,短发卡RNA)及阴性对照序列见表3。
表3 shRNA序列
Tab 3
| shRNA | Sequence (5′→3′) |
|---|---|
| NC-shRNA | CCTAAGGTTAAGTCGCCCTCGCTCGAGCGAGGGCGACTTAACCTTAGG |
| SNX1-shRNA | CCGGTAGGTGGTGGAATTATGGGATCTCGAGATCCCATAATTCCACCACCTATTTTT |
1.7 慢病毒感染、稳转株构建及效率分析
分别将处于对数生长期的AsPC-1、Capan-1细胞以106个/mL接种于6孔板,按照慢病毒感染复数(multiplicity of infection,MOI)为20,向Capan-1细胞分别添加NC-shRNA、SNX1-shRNA、SNX1-Vector、SNX1-OE慢病毒液(“1.6”部分获得)进行感染,同时向AsPC-1细胞分别添加SNX1-Vector、SNX1-OE慢病毒液(“1.6”部分获得)进行感染,48 h后使用2 μg/mL嘌呤霉素进行筛选培养,以获取稳定敲除和过表达SNX1的Capan-1细胞株、稳定过表达SNX1的AsPC-1细胞株。分别提取该6株细胞的总蛋白,采用Western blotting检测SNX1蛋白的下调和过表达效率;使用的一抗为β-actin、SNX1抗体(稀释比例均为1∶1 000),HRP标记的二抗稀释比例为1∶5 000。
1.8 癌组织及癌旁组织中SNX1表达检测
取出已固定完成的PDAC患者的癌组织及癌旁组织,包埋后制作成石蜡切片。根据免疫组织化学染色(immunohistochemistry staining,IHC)说明书,对癌组织及癌旁组织的石蜡切片进行染色,SNX1抗体的稀释比例为1∶200。经脱水、封片后于莱卡扫片机下扫描,观察细胞的染色情况,其中棕黄色染色较深的细胞中SNX1的表达较高。
1.9 细胞增殖能力检测
采用CCK8法、平板克隆形成实验检测PDAC细胞的增殖能力,具体如下:① 分别将“1.4”部分获得的已转染siRNA的6种细胞以5×103/孔接种于96孔板中,于37 ℃、5%CO2条件下培养。分别于接种后的第0、1、2、3日弃去培养液,添加CCK8试剂并于37 ℃反应1 h,而后用酶标仪测量细胞的D(450 nm),使用GraphPad软件绘制生长曲线。② 分别将上述6种细胞以5×103/孔均匀接种在6孔板内,每隔4 d更换1次培养液,当培养皿中出现肉眼可见的克隆时终止培养。弃去上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)小心浸洗2次。经4%多聚甲醛固定、结晶紫染液染色、清水润洗并晾干后进行拍照,使用ImageJ软件对克隆的数量和大小进行统计分析。
1.10 细胞迁移能力检测
采用细胞划痕实验检测PDAC细胞的迁移能力,即分别将上述6种细胞(密度达70%~80%)均匀接种在6孔板中,保证过夜后刚好能在孔中形成长满的单层细胞。次日,制造细胞划痕后,更换无血清培养基继续培养24 h,于倒置显微镜下拍照并使用ImageJ软件对划痕愈合面积进行分析。
1.11 细胞凋亡水平检测
采用流式细胞术(flow cytometry,FCM)检测PDAC细胞的凋亡水平,即分别将上述6种细胞消化、重悬,用碘化丙啶(propidium iodide,PI)和Annexin V-FITC对细胞进行染色(具体步骤参考细胞凋亡检测试剂盒说明书),同时将野生型AsPC-1、Capan-1细胞作为空白对照,于流式细胞仪上检测各种细胞的凋亡水平。
1.12 细胞内SNX1的分布和巨胞饮水平检测
采用免疫荧光染色(immunofluorescence,IF)研究SNX1在PDAC细胞内的分布。分别将AsPC-1、Capan-1细胞以5×103/孔均匀接种在8孔小室(Ibidi,德国)中,待细胞贴附在小室底部后,弃去培养液,按照IF说明书进行后续固定、通透、封闭及抗体孵育。PBS洗涤后加入1 μg/mL DAPI避光染色10 min,PBS洗涤3次后于激光共聚焦显微镜下采集图像,观察SNX1的分布及其与LAMP1的共定位情况。实验中使用的一抗为LAMP1、SNX1抗体(稀释比例均为1∶200),荧光标记的二抗稀释比例为1∶500。
分别将上述6种细胞以5×103/孔均匀接种在8孔小室中,待细胞生长密度达60%~70%时弃去培养液,PBS洗涤3次后用无血清培养基培养细胞12~18 h,再次弃去培养液,用无血清培养基配制的1 mg/mL TMR-dextran培养细胞40 min,弃去葡聚糖溶液后用预冷的PBS洗涤3次,经4%多聚甲醛固定、1 μg/mL DAPI避光染色后,在激光共聚焦显微镜下采集图像,观察不同细胞的巨胞饮水平。
1.13 细胞在裸鼠体内的增殖能力检测
于37 ℃、5%CO2条件下,将“1.7”部分获得的稳定敲除SNX1的Capan-1细胞(即分别经NC-shRNA质粒、SNX1-shRNA质粒转染)接种至10 cm培养皿中进行培养,分别扩增至一定数量(约5×107个细胞)后用胰酶消化并收集细胞,经PBS洗涤后制作细胞悬液。分别向裸鼠皮下注射50 μL(含1×107个细胞)上述细胞悬液以构建裸鼠皮下瘤模型,3周后取出肿瘤,拍照并称重。
1.14 SNX1 相关信号通路的筛选及通路中关键蛋白的表达分析
针对“1.1”部分中源自TCGA数据库的转录组测序数据,根据SNX1 mRNA表达水平中位数将其分为SNX1高表达组和SNX1低表达组。使用基因集富集分析(Gene Set Enrichment Analysis,GSEA)软件对2组数据进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genome,KEGG)通路分析,设置标准化富集分数(normalized enrichment score,NES)>1、假发现率(false discovery rate,FDR)<0.05为入选标准。而后,采用Western blotting对筛选得到的通路中由下调SNX1引起的关键蛋白表达量的变化进行分析。
1.15 Oxy处理对过表达 SNX1 细胞、通路中关键蛋白表达变化的影响
使用5 mg/mL的转化生长因子-β(transforming growth factor-β,TGF-β)信号通路抑制剂Oxy分别处理稳定过表达SNX1的AsPC-1、Capan-1细胞(“1.7”部分获得),并对该6种细胞(包括SNX1-Vector、SNX1-OE、SNX1-OE+Oxy)的增殖能力、迁移能力、凋亡水平和巨胞饮水平进行检测,方法同前。而后,采用Western blotting对过表达SNX1引起的TGF-β信号通路中关键蛋白的表达变化进行分析。
1.16 统计学方法
采用GraphPad Prism 9.0软件对实验数据进行统计分析,采用R语言对下载的数据库数据进行统计分析。所有数据均采用x±s表示,2组内比较采用Student′s t检验,多组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 SNX1在PDAC组织和细胞中的表达及其与患者临床病理信息的相关性分析
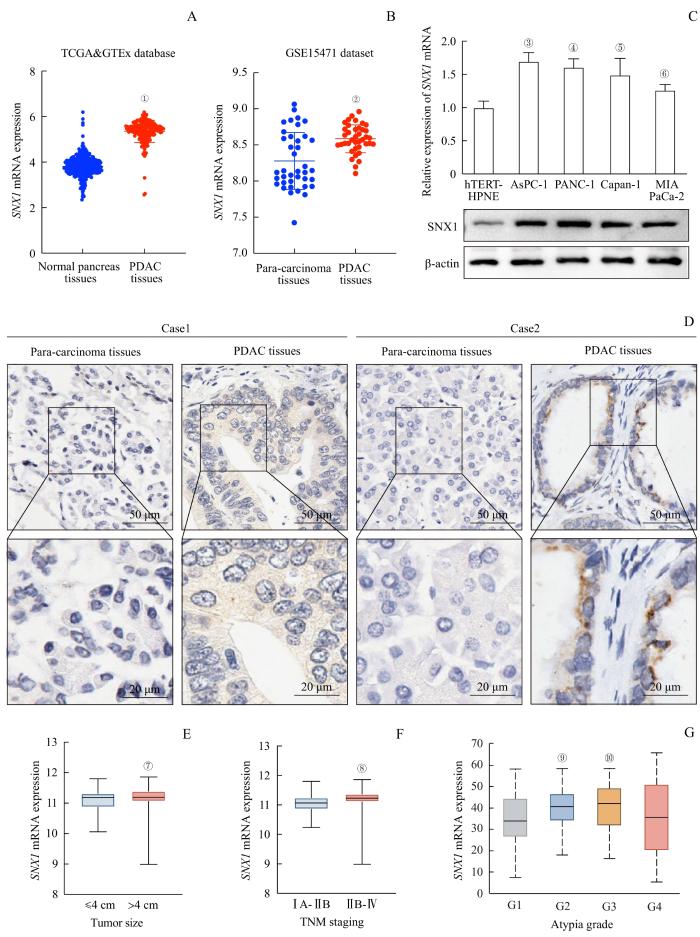
对源自TCGA、GTEx数据库的PDAC组织和正常胰腺组织的转录组测序数据进行拟合、标准化后,分析SNX1 mRNA在不同组织中的表达差异,结果显示SNX1 mRNA在PDAC组织中的表达水平高于正常胰腺组织(P=0.000,图1A);且对GSE15471数据集的转录组数据的分析也得到了相同的结果(图1B)。分别采用qPCR和Western blotting检测4种PDAC细胞和hTERT-HPNE细胞中SNX1的mRNA和蛋白表达水平,结果(图1C)显示PDAC细胞中SNX1的mRNA和蛋白水平均高于hTERT-HPNE细胞(均P<0.05)。5例患者的癌组织及癌旁组织标本的IHC结果(图1D)显示,相较于癌旁组织,PDAC组织中的棕黄色更深,即SNX1的表达水平较高。
图1
图1
SNX1在PDAC细胞和组织中的表达及其与患者临床病理信息的相关性分析
Note: A. Expression of SNX1 mRNA in PDAC tissues and normal pancreas tissues in TCGA>Ex database. ①P=0.000, compared with normal pancreas tissues. B. Expression of SNX1 mRNA in PDAC tissues and para-carcinoma tissues in GSE15471 dataset. ②P=0.000, compared with para-carcinoma tissues. C. Detection of the mRNA and protein expression of SNX1 in four PDAC cells and hTERT-HPNE cells by qPCR and Western blotting. ③P=0.000, ④P=0.001, ⑤P=0.005, ⑥P=0.045, compared with hTERT-HPNE cells. D. Detection of SNX1 expression in PDAC tissues and para-carcinoma tissues from PDAC patients by IHC. E. Correlation between SNX1 mRNA expression and tumor size of patients in TCGA database. ⑦P=0.024, compared with the ≤4 cm group. F. Correlation between SNX1 mRNA expression and TNM staging of patients in TCGA database. ⑧P=0.003, compared with the ⅠA-ⅡB group. G. Correlation between SNX1 mRNA expression and atypia grades of PDAC patients. ⑨P=0.012, ⑩P=0.015, compared with the G1 group.
Fig 1
Expression of SNX1 in PDAC cells and tissues and its correlation with clinical characteristics of patients
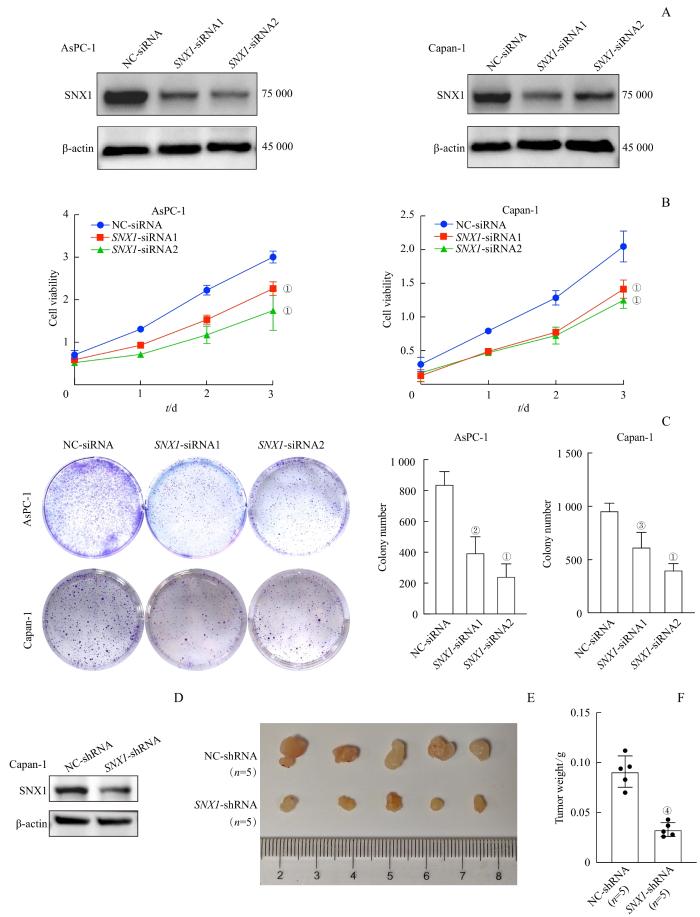
2.2 下调 SNX1 对PDAC细胞增殖能力的影响
图2
图2
体内、外研究分析下调 SNX1 对PDAC细胞增殖能力的影响
Note: A. Detection of SNX1 expression in AsPC-1 and Capan-1 cells by Western blotting. B/C. Detection of the effect of SNX1 knockdown on the proliferation capacity of AsPC-1 and Capan-1 cells by CCK8 (B) and plate clonal formation experiment (C). ①P=0.000, ②P=0.002, ③P=0.008, compared with the NC-siRNA group. D. Detection of SNX1 expression in Capan-1 cells by Western blotting. E. Photos of subcutaneous xenograft tumors from Capan-1 cells infected with NC-shRNA or SNX1-shRNA lentivirus. F. Statistical analysis of tumor weight growth of Capan-1 cells infected with NC-shRNA or SNX1-shRNA lentivirus over 3 weeks. ④P=0.000, compared with the NC-shRNA group.
Fig 2
Effect of SNX1 knockdown on the proliferation capacity of PDAC cells in vivo and in vitro
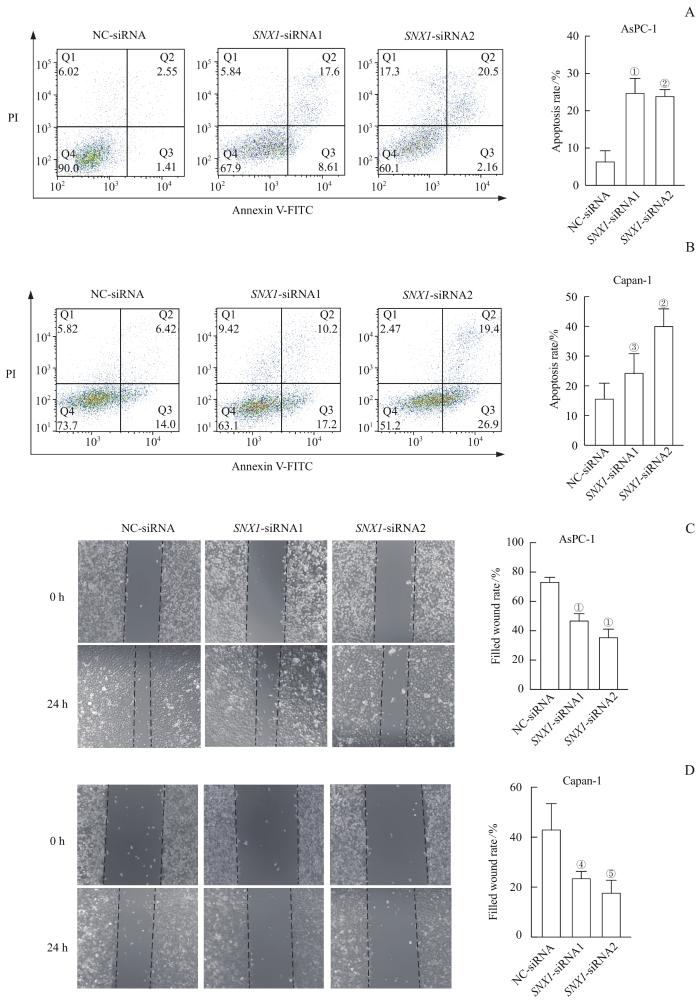
2.3 下调 SNX1 对PDAC细胞凋亡水平、迁移能力的影响
图3
图3
下调 SNX1 对PDAC细胞凋亡水平和迁移能力的影响
Note: A/B. Detection of the effect of SNX1 knockdown on the apoptosis levels of AsPC-1 cells (A) and Capan-1 cells (B) by FCM. C/D. Detection of the effect of SNX1 knockdown on the migration capacity of AsPC-1 cells (C) and Capan-1 cells (D) by cell scratch assay. ①P=0.000, ②P=0.001, ③P=0.019, ④P=0.020, ⑤P=0.006, compared with the NC-siRNA group.
Fig 3
Effect of SNX1 knockdown on the apoptosis levels and migration capacity of PDAC cells
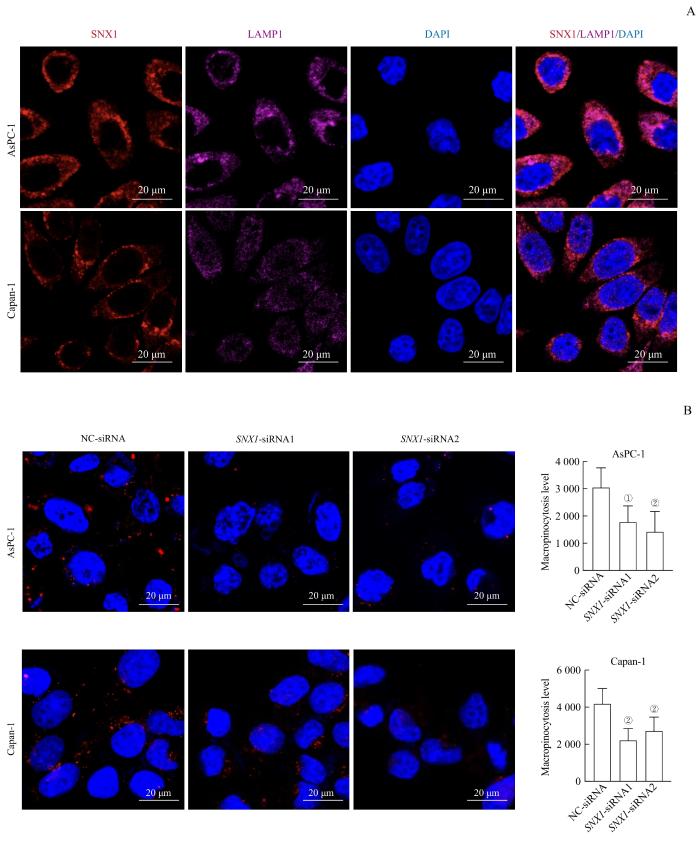
2.4 SNX1在PDAC细胞中的分布及下调 SNX1 对PDAC细胞巨胞饮水平的影响
图4
图4
SNX1在PDAC细胞中的分布以及下调 SNX1 对PDAC细胞巨胞饮水平的影响
Note: A. Observation of location and distribution of SNX1 in AsPC-1 and Capan-1cells by IF. B. Detection of the effect of SNX1 knockdown on the macropinocytosis levels in AsPC-1 and Capan-1 cells by TMR-dextran. ①P=0.009, ②P=0.001, compared with the NC-siRNA group.
Fig 4
Distribution of SNX1 in PDAC cells and the effect of SNX1 knockdown on the macropinocytosis levels in PDAC cells
2.5 SNX1 相关信号通路的筛选及通路中关键蛋白表达量变化的分析
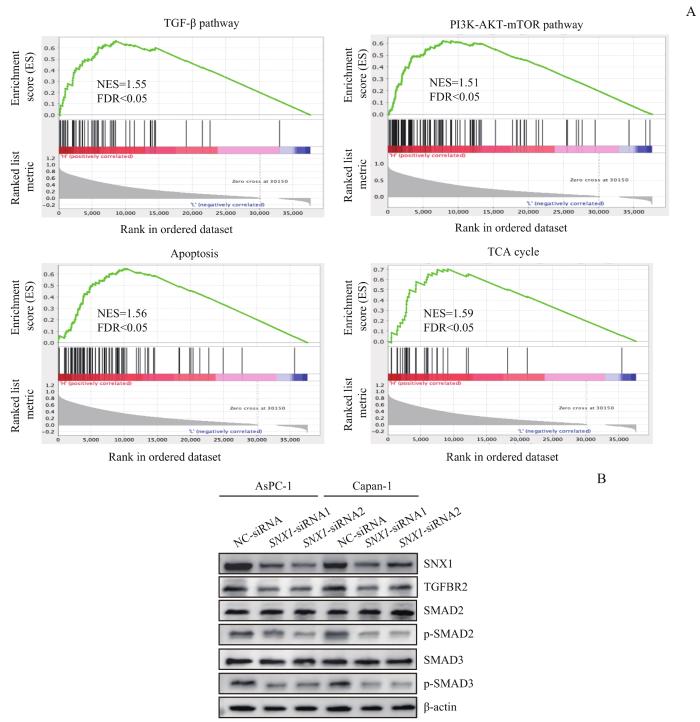
为进一步研究SNX1在促进PDAC进展过程中的分子机制,本研究对来自TCGA数据库的SNX1高表达组和SNX1低表达组数据进行KEGG通路分析,结果(图5A)显示SNX1在PDAC中的高表达与TGF-β、磷脂酰肌醇3-激酶-丝氨酸/苏氨酸蛋白激酶-哺乳动物雷帕霉素靶蛋白(phosphoinositide 3-kinase-serine/threonine-protein kinase-mammalian target of rapamycin,PI3K-AKT-mTOR)等信号通路的激活相关,也与细胞凋亡、三羧酸(tricarboxylic acid cycle,TCA)循环等信号通路的调控相关。
图5
图5
SNX1 相关信号通路的筛选及下调 SNX1 对通路活化的影响
Note: A. KEGG pathway analysis of SNX1 in TCGA database. B. Detection of the effect of SNX1 knockdown on TGF-β signaling pathway by Western blotting.
Fig 5
Screening of SNX1-related signaling pathway and the effect of SNX1 knockdown on pathway activation
2.6 Oxy处理对过表达 SNX1 的PDAC细胞及TGF-β通路中关键蛋白表达变化的影响
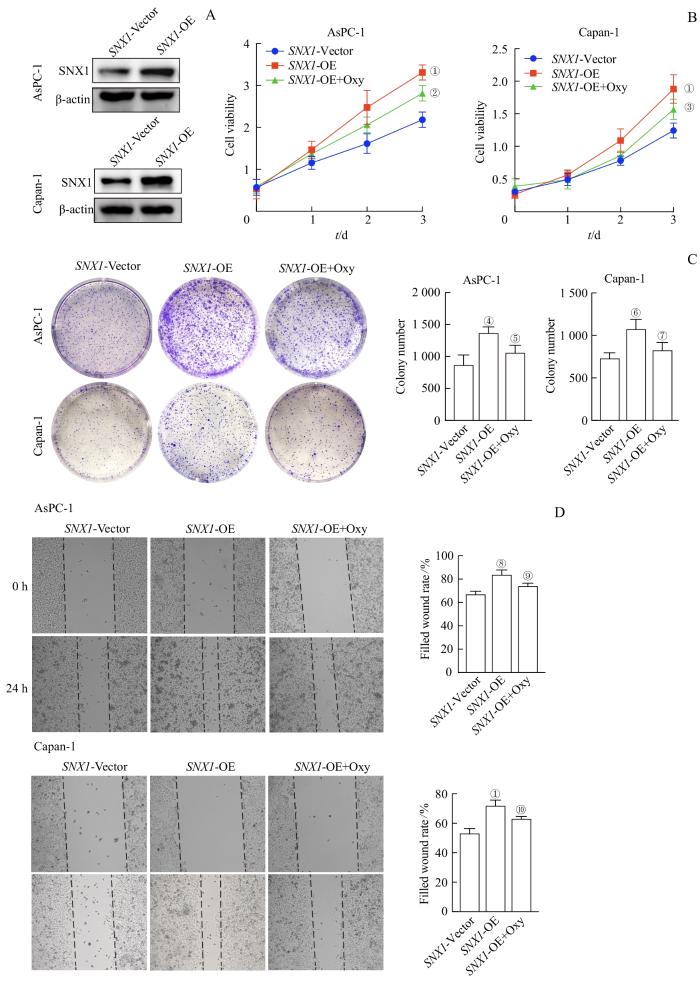
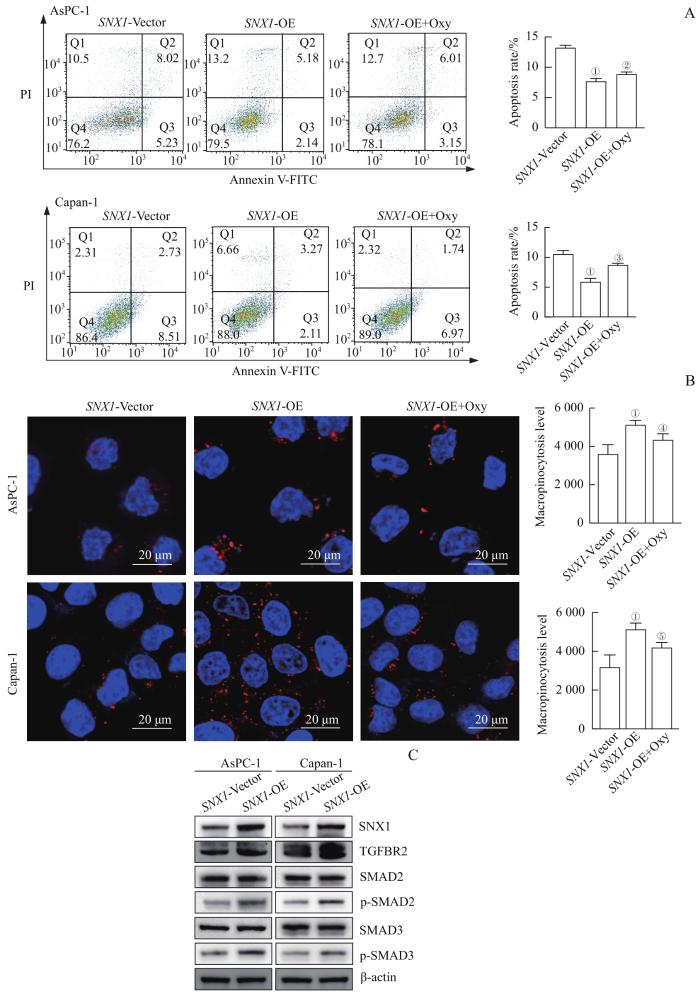
采用Western blotting检测AsPC-1、Capan-1细胞中SNX1的过表达情况,结果(图6A)显示,与感染SNX1-Vector相比,感染SNX1-OE慢病毒液的上述细胞SNX1表达明显增加。随后,分别采用CCK8法、平板克隆形成实验检测稳定过表达SNX1的AsPC-1、Capan-1细胞的增殖能力,采用细胞划痕实验、FCM检测上述细胞的迁移能力和凋亡水平,采用TMR-dextran检测上述细胞的巨胞饮水平;结果(图6B~D,图7A、B)显示,相较于感染SNX1-Vector,感染SNX1-OE慢病毒液的细胞增殖能力、迁移能力、巨胞饮水平均有显著上调,凋亡水平均有显著下调(均P<0.05)。
图6
图6
Oxy处理对过表达 SNX1 的PDAC细胞及TGF-β信号通路中关键蛋白表达的影响(Ⅰ)
Note: A. Detection of SNX1 overexpression in AsPC-1 and Capan-1 cells by Western blotting. B/C. Detection of the effect of SNX1 overexpression and Oxy treatment on the proliferation capacity of AsPC-1 and Capan-1 cells by CCK8 (B) and plate clonal formation experiment (C). D. Detection of the effect of SNX1 overexpression and Oxy treatment on the migration capacity of AsPC-1 and Capan-1 cells by cell scratch assay. ①P=0.000, ④P=0.004, ⑥P=0.006, ⑧P=0.001, compared with the SNX1-Vector group; ②P=0.003, ③P=0.033, ⑤P=0.037, ⑦P=0.026, ⑨P=0.010, ⑩P=0.015, compared with the SNX1-OE group.
Fig 6
Effects of Oxy treatment on PDAC cells and key proteins expression in TGF-β signaling pathway induced by SNX1 overexpression (Ⅰ)
图7
图7
Oxy处理对过表达 SNX1 的PDAC细胞及TGF-β信号通路中关键蛋白表达的影响(Ⅱ)
Note: A. Detection of the effect of SNX1 overexpression and Oxy treatment on the apoptosis levels of AsPC-1 and Capan-1 cells by FCM. B. Detection of the effect of SNX1 overexpression and Oxy treatment on the macropinocytosis levels in AsPC-1 and Capan-1 cells by TMR-dextran. C. Detection of the effect of SNX1 overexpression on TGF-β signaling pathway by Western blotting. ①P=0.000, compared with the SNX1-Vector group; ②P=0.014, ③P=0.001, ④P=0.020, ⑤P=0.024, compared with the SNX1-OE group.
Fig 7
Effects of Oxy treatment on PDAC cells and key proteins expression in TGF-β signaling pathway induced by SNX1 overexpression (Ⅱ)
同时,在上述增殖、迁移、巨胞饮、凋亡水平检测的实验中,我们使用TGF-β信号通路抑制剂Oxy(5 mg/mL)分别处理经SNX1-OE慢病毒液感染的AsPC-1、Capan-1细胞,观察该抑制剂对由SNX1过表达引起的细胞表型变化的影响,结果(图6B~D,图7A、B)显示Oxy能够显著恢复由SNX1过表达引起的上述表型变化(均P<0.05)。随后,为了研究过表达SNX1对TGF-β信号通路的影响,我们采用Western blotting对稳定过表达SNX1的AsPC-1、Capan-1细胞中的TGF-β信号通路关键蛋白进行检测,结果(图7C)显示,与感染SNX1-Vector相比,在感染SNX1-OE慢病毒液的细胞中TGFBR2的表达及SAMD2/SMAD3磷酸化水平均有所上调,继而表明该信号通路被激活。
3 讨论
在本研究中,我们发现下调SNX1能够抑制PDAC细胞的增殖能力、迁移能力、巨胞饮水平,而增加细胞的凋亡水平;过表达SNX1则产生了相反的结果。通过KEGG通路分析我们发现,SNX1与多种促癌信号通路相关。本课题组最近的研究[15]发现,与对照组相比,使用转化生长因子-β1(transforming growth factor-β1,TGFB1)处理的具有RAS突变的PDAC细胞表现出了更高水平的巨胞饮,而同时使用TGFB1和Oxy处理后的细胞的巨胞饮水平则较TGFB1处理有所下降;继而证明,TGF-β信号通路可以作为上游因素调控PDAC细胞的巨胞饮。
本研究的蛋白水平检测发现,下调SNX1能够抑制TGF-β信号通路的激活,过表达SNX1则能促进该信号通路的激活;同时,在SNX1过表达组中加入TGF-β信号通路抑制剂Oxy后,我们发现该抑制剂可以显著挽救由SNX1过表达引起的对PDAC细胞增殖能力、迁移能力、凋亡和巨胞饮水平的影响。继而表明,SNX1可通过调控TGF-β信号通路来影响PDAC细胞的增殖能力、迁移能力、凋亡和巨胞饮水平。本研究通过IF发现SNX1与溶酶体存在共定位,且在细胞质中也有分布;同时有研究[16]发现SNX1和SNX5可形成异源二聚体,参与到巨胞饮体的成熟过程中。因此我们推测,SNX1可能参与了巨胞饮过程中的多个阶段,进而调控PDAC细胞的巨胞饮水平,但其具体的作用机制仍有待进一步研究。
近年来,越来越多的研究发现巨胞饮是肿瘤发生发展过程中的重要分子生物学机制。如生长停滞特异性蛋白6-酪氨酸蛋白激酶受体(growth arrest-specific protein 6-AXL receptor tyrosine kinase,GAS6-AXL)信号轴可通过影响肌动蛋白重塑及下游PI3K、Rho家族G蛋白成员1(Rac family small GTPase 1,RAC1)的激活来影响细胞动力学、黏附和代谢等多个肌动蛋白依赖性过程,进而触发肿瘤细胞的巨胞饮和侵袭[17];在营养应激的微环境下,磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)缺失的前列腺癌细胞可利用巨胞饮过程维持其存活和细胞增殖,且只有在AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)激活的情况下PTEN的缺失才会促进巨胞饮过程的发生,继而揭示了AMPK在营养应激的情况下促进前列腺癌细胞存活的新机制[18];在氧气、营养均较为缺乏的肝细胞癌(hepatocellular carcinoma,HCC)微环境中,缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)可通过激活含EH结构域2(EH domain containing 2,EHD2)的转录来诱导HCC细胞巨胞饮的发生[19];在低谷氨酰胺条件下,表皮生长因子受体(epidermal growth factor receptor,EGFR)信号可通过激活P21活化蛋白激酶(p21-activated kinase,Pak)来调节PDAC细胞的巨胞饮,以应对营养缺乏的微环境[20]。与此同时,本研究亦探讨了SNX1调控PDAC细胞巨胞饮的分子生物学机制。因此,针对不同癌种及在不同肿瘤细胞中探究巨胞饮是如何发挥功能来影响肿瘤的发生发展机制具有十分重要的科学意义。
综上所述,SNX1能够通过激活TGF-β信号通路来促进PDAC细胞的增殖能力、迁移能力、巨胞饮水平并抑制其发生凋亡,继而提示SNX1可能是治疗PDAC的有效靶点。本研究的结果或为PDAC发生和发展的机制研究提供新的思路。
作者贡献声明
潘泓、廖颖娜、聂惠贞参与了实验设计,潘泓、盖严支、钱立恒、聂惠贞参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed by PAN Hong, LIAO Yingna and NIE Huizhen. The manuscript was drafted and revised by PAN Hong, GAI Yanzhi, QIAN Liheng and NIE Huizhen. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
参考文献