内质网的主要功能是细胞内蛋白的加工、修饰以及合成,并为其他细胞器供给脂质,稳定细胞内Ca2+的浓度[5]。缺血缺氧等不良刺激可以引起细胞内质网伴侣蛋白葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)的表达增加;GRP78与蛋白激酶R样内质网激酶[protein kinase R(PKR)-like endoplasmic reticulum kinase,PERK]、转录激活因子6(activating transcription factor 6,ATF6)和真核翻译起始因子2α(eukaryotic initiation factor 2α,eIF2α)分离后,PERK激活GRP78和CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP),促进非折叠蛋白积聚,内质网应激过度导致细胞损伤[6]。内质网应激还可以促进细胞氧化应激爆发,诱发过氧化损伤[7-8]。我们以往的研究[9]证实,脑卒中能诱导脑血管内皮细胞内质网应激的发生,并加重细胞损伤。因此,脑卒中后内质网应激是血管内皮细胞损伤和BBB破坏的重要环节。
研究[15]发现,抑制人胚肾293细胞中内质网应激相关蛋白eIF2α和CHOP的上调可以降低β-catenin的表达水平。也有研究[16-17]证实内质网应激和Wnt通路的抑制密切相关,但脑卒中后内质网应激对Wnt7/β-catenin通路的影响还未阐明。因此本研究在小鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型和人脑血管内皮细胞糖氧剥夺(oxygen and glucose deprivation,OGD)模型中探讨脑卒中后内质网应激对Wnt7/β-catenin通路的调控作用,并阐明脑卒中后内质网应激爆发抑制Wnt7/β-catenin信号通路从而导致脑血管内皮细胞和BBB损伤的关键机制,以期为临床减轻脑卒中后脑水肿的形成提供参考。
1 材料与方法
1.1 实验动物
SPF级C57BL/6野生型小鼠,性别不限,6~8周龄,购于上海南方模式生物科技有限公司。实验动物生产许可证号:SCXK(沪)2017-0010。实验动物使用许可证号:SYXK(沪)2017-0012。小鼠饲养于上海交通大学医学院附属仁济医院实验动物中心,饲养环境12 h光照与12 h黑暗交替,自由饮食。
1.2 实验细胞
人脑微细血管内皮细胞(human brain microvascular endothelial cell,HBMEC)购自美国ScienCell公司。
1.3 主要试剂及仪器
4-苯基丁酸(4-phenylbutyric acid,4-PBA)、戊巴比妥钠、伊文思蓝(Evans blue,EB)、FITC标记的牛血清白蛋白(FITC-BSA)均购自Sigma(美国);cell counting kit-8(CCK-8)试剂盒(Dojindo,日本),紧密连接蛋白1(zonula occludens-1,ZO-1)一抗(Proteintech,美国),CCAAT/CHOP、门冬氨酸特异性半胱氨酸蛋白酶12(cysteine-containing aspartate-specific proteases 12,Caspase-12)、GPR78、密封蛋白5(claudin-5)、Wnt7、β-catenin、CD31、CD13、actin一抗以及血小板衍生生长因子β(platelet-derived growth factor β,PDGF-β)ELISA试剂盒(Abcam,英国),二抗和DAPI(北京中杉金桥生物技术有限公司),CM-H2DCFDA活性氧荧光探针(Invitrogen,美国),Fluo-3 AM钙离子荧光探针(Thermo Fisher Scientific,美国),小鼠线栓(北京西浓科技有限公司);BS110S化学天平(Sartourius,德国),细胞培养箱(Thermo Fisher Scientific,美国),Ti2E荧光显微镜(Nikon,日本),SP8激光共聚焦显微镜(Leica,德国),Chemidoc XRS+化学发光成像系统、多功能酶标仪(Bio-Rad Laboratories,美国)。
1.4 动物实验方法
1.4.1 动物分组
小鼠共45只,分为3组,分别为假手术组(Sham组)、MCAO组、4-PBA+MCAO组,每组15只。Sham组小鼠进行解剖和血管分离,不放置线栓;MCAO组小鼠放置线栓阻塞大脑中动脉60 min后拔除线栓;4-PBA+MCAO组小鼠放置线栓阻塞大脑中动脉即刻腹腔注射内质网应激抑制剂4-PBA(3 mg/kg),药物的用法用量与课题组前期报道的实验方法一致[9]。
1.4.2 小鼠MCAO模型制备
腹腔注射0.3%戊巴比妥钠(0.2 mL/10 g)麻醉小鼠。颈部正中切口,分离右侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)。将具有圆形尖端的单丝尼龙缝合线通过ECA残端插入ICA,并轻轻插入,以达到Willis环,阻塞大脑中动脉;闭塞60 min后,取出缝合线并开始再灌注。对Sham组小鼠进行手术操作但未阻断血流。在整个手术过程中,使用加热毯保持小鼠直肠温度在36.5~37.5 ℃。
1.4.3 BBB通透性检测
MCAO后24 h,每组小鼠各取5只,经尾静脉注射0.5% EB,剂量为0.1 mL/10 g。循环1 h后,用0.9%生理盐水经心脏灌注处死小鼠,直到右心房流出的液体清澈为止。取脑组织,加入1 mL PBS,迅速匀浆,1 000×g离心15 min。取上清液,使用酶标仪在波长632 nm条件下检测。根据标准曲线,测定EB渗出量。
1.4.4 水含量测定
MCAO后24 h,每组小鼠各取5只,断颈处死后使用生理盐水冲洗采集的大脑,再用中性滤纸吸干表面的水分。取缺血侧脑半球,使用天平测定其湿质量,之后将组织在110 ℃的烘箱中烘烤24 h,并测定干质量。根据以下公式计算大脑的增水量:大脑增水量(%)=(湿质量-干质量)/湿质量×100%。
1.4.5 免疫荧光检测内皮细胞和周细胞之间的黏附情况
MCAO后24 h,麻醉小鼠,用生理盐水通过左心室冲洗血液后,用4%多聚甲醛灌注固定;随后取出全脑,继续用4%多聚甲醛固定6~12 h并采用高糖溶液脱水;使用组织包埋剂包埋后切片,并用1%山羊血清封闭,CD31、CD13、actin一抗(均为1∶1 000)分别孵育过夜后,二抗(1∶5 000)孵育,封片后显微镜下观察。CD31标记血管内皮细胞,CD13标记周细胞。显微镜下观察CD31和CD13的标记情况以明确血管内皮细胞和周细胞之间的关系。
1.5 细胞实验方法
1.5.1 HBMEC培养
HBMEC接种在100 mm培养皿(106个/皿),用含有10%胎牛血清、1%青霉素和链霉素溶液的DMEM培养基在37 ℃、5% CO2条件下培养。用1 mL胰蛋白酶消化细胞2~3 min,300×g离心5 min,之后传代到新的培养皿中,消化后将细胞以300×g离心5 min,去除上清液,冷冻保存。
1.5.2 OGD模型建立
弃去HBMEC培养皿中的完全培养液,更换平衡盐溶液,置于37 ℃、85% N2 +5% CO2 +0.02%~0.2% O2密闭缺氧的培养箱中培养4 h;改用DMEM培养基,将细胞移入CO2培养箱中复氧(5% CO2+95%空气)24 h。
1.5.3 细胞实验分组
细胞实验分为空白对照组(Blank组)、OGD组和OGD+4-PBA组。Blank组正常培养不做任何干预;OGD组HBMEC培养后OGD处理4 h;OGD+4-PBA组HBMEC在OGD处理4 h后即刻加入内质网应激抑制剂4-PBA(10 mmol/L)。
1.5.4 细胞活性和通透性检测
使用CCK-8试剂测定细胞增殖。CCK-8溶液孵育细胞2 h后,用多功能酶标仪在450 nm波长下测量吸光度值。采用Transwell实验检测细胞通透性。每个迁移小室内加入100 μL含1×105个细胞的培养基,下室加入600 μL培养基;24 h后按照Sham组、OGD组和OGD+4-PBA组的要求分别对3组细胞进行处理,之后每个迁移小室加入10 μL FITC-BSA(1 mg/mL),继续培养2 h。取100 μL下室中的培养基,使用多功能酶标仪在495 nm的激发波长和525 nm的发射波长下测量荧光发射光谱。
1.5.5 细胞内ROS水平测定
活性氧(reactive oxygen species,ROS)水平通过CM-H2DCFDA荧光探针测定。细胞以1×104个/孔的密度接种在96孔板中。PBS洗涤后在37 ℃下用20 μmol/L CM-H2DCFDA孵育30 min,使用多功能酶标仪在495 nm的激发波长和525 nm的发射波长下测量荧光发射光谱。
1.5.6 细胞内钙离子水平测定
按5×105个/孔将细胞接种到6孔板。培养24~36 h,OGD处理4 h后再培养24 h,PBS洗涤2次,加入Hank′s平衡盐溶液(Hank′s balanced salt solution,HBSS)稀释的Fluo-3 AM工作液(1∶200),30 ℃孵育20 min;弃工作液,HBSS洗涤2次充分去除残留的工作液,加入HBSS在培养箱内继续孵育20 min,激光共聚焦显微镜拍照并使用Image J软件分析荧光强度。
1.5.7 蛋白质印迹法检测连接蛋白和内质网应激蛋白的表达水平
收集细胞样本,裂解后使用BCA测定样本中蛋白的浓度。根据目标蛋白分子量大小选择浓度合适的蛋白电泳凝胶,进行蛋白电泳、转膜,然后封闭1 h。分别使用CHOP(1∶200)、Caspase-12(1∶2 000)、GPR78(1∶500)、ZO-1(1∶1 000)、claudin-5(1∶5 000)、Wnt7(1∶1 000)、β-catenin(1∶1 000)、actin(1∶1 000)一抗孵育,放入4 ℃摇床过夜;二抗(1∶5 000)孵育后显影,用Bio-Rad Chemidoc XRS+成像系统记录,使用Image J软件进行灰度分析计算蛋白的表达水平。
1.5.8 ELISA检测HBMEC分泌PDGF-β的情况
收集细胞后用冷PBS洗涤3次,通过反复冻融裂解细胞标本后1 500×g离心10 min,收集上清液。在空白对照孔、待测样品孔及标准品孔中均加入辣根过氧化物酶(HRP)标记的PDGF-β抗体和底物液,37 ℃避光放置3~5 min;每孔加入50 μL终止液终止反应,加终止液后20 min内使用酶标仪在450 nm波长测量各孔的吸光度值,计算样品中PDGF-β含量。
1.6 统计学分析
用GraphPad Prism 8.3软件进行统计分析。定量资料采用x±s表示。2组数据之间比较采用Tukey多重比较检验,3组数据之间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 小鼠脑卒中后阻断内质网应激可减轻BBB的损伤
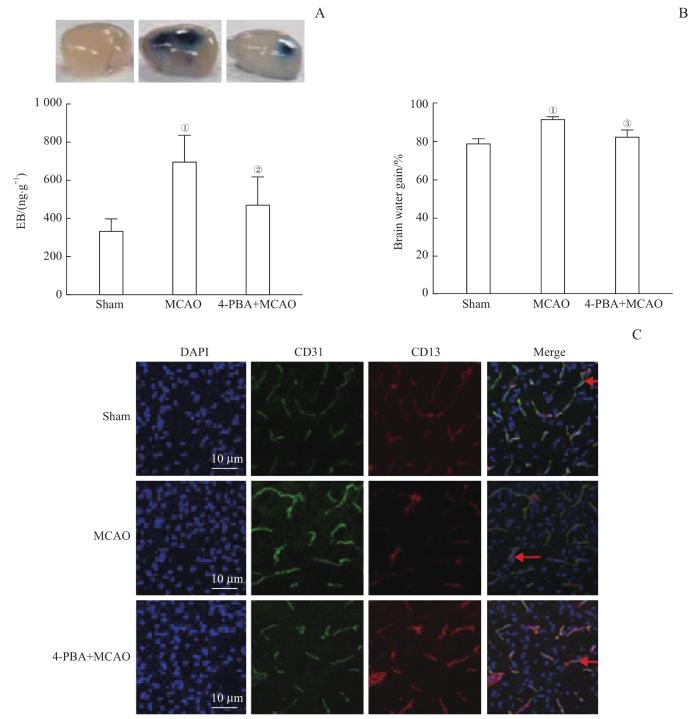
与Sham组比较,小鼠MCAO 24 h后,脑缺血区EB渗出量明显增加(P=0.000),表明BBB通透性显著增加,BBB功能被破坏(图1A)。同时发现,与Sham组比较,脑缺血后脑水含量明显增加(P=0.000,图1B)。我们还关注了BBB关键结构脑血管内皮细胞和周细胞之间的黏附状态。免疫荧光检测结果(图1C)显示,MCAO发生后脑血管内皮细胞和周细胞的标记蛋白CD31和CD13的重叠显著减少,表明周细胞从脑血管内皮细胞上脱离下来,BBB的完整性被破坏。为了探讨内质网应激在MCAO破坏BBB功能中的作用,我们在脑缺血即刻向小鼠腹腔注射内质网应激抑制剂4-PBA,发现4-PBA+MCAO组脑缺血区EB渗出量较MCAO组明显减少(P=0.011,图1A),脑水肿程度也减轻(P=0.000,图1B);并且CD31和CD13的重叠明显增加,提示脑血管内皮细胞和周细胞之间的黏附性提高(图1C)。以上结果证实了MCAO导致BBB功能和结构明显受损,而阻断内质网应激可能可以有效减轻BBB的破坏程度。
图1
图1
小鼠脑卒中对BBB的损伤以及抑制内质网应激对该损伤的缓解
Note: A. EB exudation in the brain of mice. B. Water content of mice brain. C. Adhesion of cerebrovascular endothelial cells and pericytes in mice. Red arrows indicate overlap of CD31 and CD13. ①P=0.000, compared with the Sham group; ②P=0.011, ③P=0.000, compared with the MCAO group.
Fig 1
Injury of BBB after stroke in mice and the alleviating effect of endoplasmic reticulum stress inhibition on the injury
2.2 抑制内质网应激可减轻OGD对HBMEC的损伤
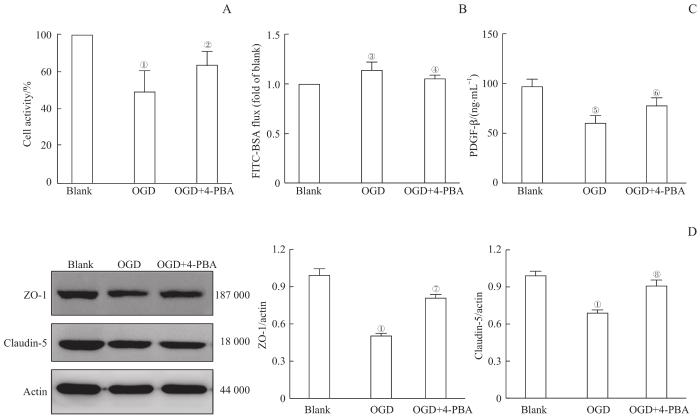
为探讨缺血缺氧对脑血管内皮细胞的作用,我们构建HBMEC的OGD模型进行进一步研究。如图2A和2B所示,与Blank组比较,经过4 h的OGD处理并24 h的复氧后,CCK-8实验测定的细胞活力明显下降(P=0.000),并且HBMEC对FITC-BSA的透过率显著增加(P=0.002)。内皮细胞分泌的PDGF-β是对周细胞产生黏附的主要因子。因此我们观察了HBMEC分泌的PDGF-β水平。ELISA结果(图2C)显示,OGD后HBMEC分泌PDGF-β的水平下降(P=0.001),提示血管内皮细胞的分泌功能也受损,对周细胞的黏附功能削弱。蛋白质印迹法(Western blotting)检测结果(图2D)显示,OGD后HBMEC中的ZO-1和claudin-5的表达受到明显抑制(P=0.000),提示血管内皮细胞之间的紧密连接性降低。
图2
图2
OGD引起的HBMEC损伤以及抑制内质网应激对该损伤的缓解作用
Note: A. Determination of activity of HBMECs by CCK-8 assay. B. The cell permeability of HBMECs analyzed with FITC-BSA leakage. C. Determination of the PDGF-β secretion of HBMECs by ELISA. D. Determination of the expression of ZO-1 and claudin-5 in HBMECs by Western blotting. ①P=0.000, ③P=0.002, ⑤P=0.001, compared with the Blank group; ②P=0.026, ④P=0.005, ⑥P=0.042, ⑦P=0.000, ⑧P=0.001, compared with the OGD group.
Fig 2
OGD-induced HBMEC damage and the alleviating effect of inhibiting endoplasmic reticulum stress on this injury
2.3 4-PBA可缓解OGD引起的HBMEC内质网应激爆发
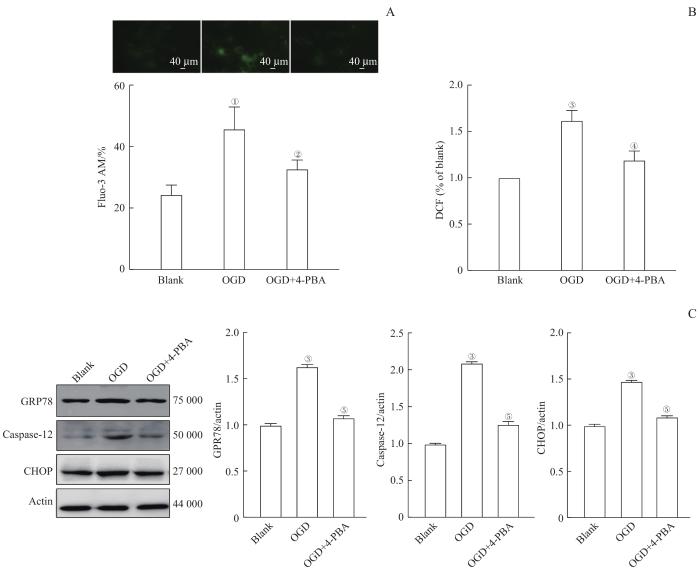
为了探讨缺血缺氧对脑血管内皮细胞中内质网应激的影响,我们进一步检测OGD后的HBMEC内质网应激情况。如图3A和3B所示,与Blank组比较,OGD组细胞内Ca2+水平明显增加,出现了钙超载,并且细胞的ROS水平也显著增加(均P<0.05);使用了4-PBA后细胞内Ca2+及ROS水平较OGD组明显下降(均P<0.05)。Western blotting测定OGD后HBMEC内质网应激相关蛋白的表达(图3C),结果显示:与Blank组比较,OGD组内质网应激相关蛋白CHOP、Caspase-12和GPR78的表达水平显著增加(均P<0.05);加入了4-PBA之后各蛋白的表达水平均较OGD组明显下降(均P<0.05)。以上结果提示,HBMEC的OGD模型中内质网应激爆发,4-PBA可阻断OGD条件下的内质网应激爆发。
图3
图3
OGD以及4-PBA处理对HBMEC内质网应激的影响
Note: A. Intracellular Ca2+ level in HBMECs. B. Intracellular ROS level in HBMECs. C. Expression of endoplasmic reticulum stress proteins in HBMECs. ①P=0.003, ③P=0.000, compared with the Blank group; ②P=0.033, ④P=0.003, ⑤P=0.000, compared with the OGD group.
Fig 3
Effects of OGD and 4-PBA treatment on HBMEC endoplasmic reticulum stress
2.4 OGD后HBMEC的内质网应激造成Wnt7/β-catenin信号失活
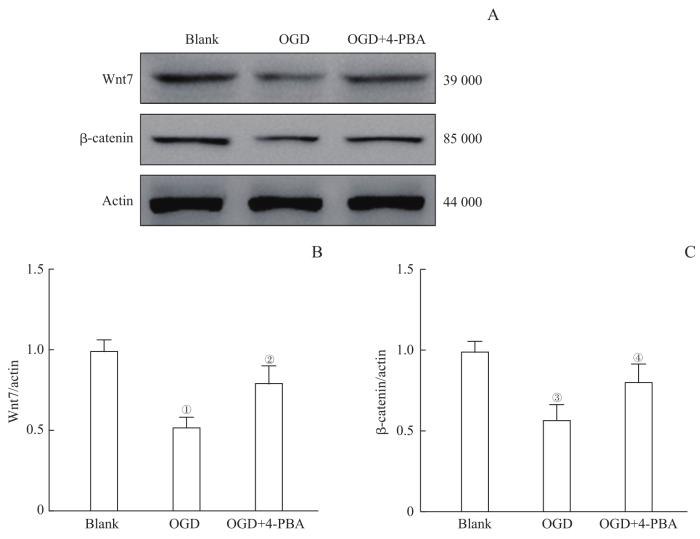
为了探讨内质网应激损伤脑血管内皮细胞的机制,我们观察HBMEC在OGD后Wnt7/β-catenin信号通路的变化。Western blotting测定Wnt7和β-catenin蛋白的表达水平(图4),结果显示,与Blank组比较,OGD组内皮细胞在缺糖缺氧4 h后Wnt7和
图4
图4
抑制内质网应激对OGD后HBMEC内Wnt7/β-catenin信号的影响
Note: A. Wnt7 and β-catenin protein expression bands. B. Analysis of Wnt7 protein expression in HBMECs. C. Analysis of β-catenin protein expression in HBMECs. ①P=0.000, ③P=0.002, compared with the Blank group; ②P=0.000, ④P=0.023, compared with the OGD group.
Fig 4
Effect of inhibiting endoplasmic reticulum stress on Wnt7/β-catenin signaling in HBMECs after OGD
β-catenin的表达水平明显下调(均P<0.05),提示Wnt7/β-catenin信号通路被抑制。为阐明内质网应激是否可以对Wnt7/β-catenin信号通路发挥调控作用,HBMEC复氧后采用抑制剂4-PBA阻断内质网应激,结果发现OGD+4-PBA组中Wnt7和/β-catenin的表达水平较OGD组上调(均P<0.05),提示4-PBA处理后Wnt7/β-catenin信号的活性明显恢复。
3 讨论
流行病学调查[18]显示,在我国脑卒中和缺血性心脏病是死亡和残疾的两大主要原因。BBB的破坏在治疗导致的继发性脑出血中发挥重要作用。脑卒中24 h时BBB的破坏程度达到了高峰[17]。磁共振成像(MRI)显示,BBB的破坏程度与脑卒中急性期血管内治疗后颅出血的风险和严重程度有关[19]。近年来,相关的临床证据越来越多,但目前针对脑卒中造成BBB功能脆弱的机制还有待进一步阐明。本研究在小鼠MCAO模型中观察到脑卒中后BBB被破坏,通透性显著增加,并伴随着脑水肿的出现。通过免疫荧光双标记技术观察脑血管内皮细胞和周细胞之间的黏附关系,发现脑卒中24 h后脑血管内皮细胞和周细胞之间出现了明显的剥离,推测两者之间黏附性降低造成的结构性破坏是导致BBB功能障碍的基础。我们还采用腹腔注射内质网应激抑制剂4-PBA探讨内质网应激在BBB破坏中的作用,发现4-PBA能有效减轻EB从脑血管中渗出,降低脑水肿的程度,并能有效改善脑血管内皮细胞和周细胞的紧密度,证实了脑卒中诱发的内质网应激确实在BBB损伤和功能障碍中起到了关键作用。课题组前期的研究[9]也证实了在大鼠脑卒中后采用4-PBA抑制内质网应激,减轻了BBB的损伤,改善脑卒中的预后。
FRANCIS等[11]的研究表明脑血管内皮细胞在脑卒中后出现损伤,紧密连接被破坏,细胞通透性增加,并且脑血管内皮细胞和周细胞覆盖度的减少可直接导致脑血管结构破坏和通透性增加。我们在OGD模型中也证实缺血缺氧4 h后HBMEC出现明显的活力下降和细胞损伤,细胞通透性遭到破坏,并且细胞表达的紧密连接蛋白ZO-1和claudin-5的水平也受到抑制,表明细胞的屏障功能受损。PDGF-β作为一种细胞表面黏附分子,可特异性识别表达于周细胞上的血小板衍生生长因子受体β(platelet-derived growth factor receptor β,PDGFR-β),将周细胞募集在内皮细胞周围[20]。文献[16]显示在内皮细胞和周细胞之间众多交互影响的因子中,PDGF在脑卒中后内皮细胞对周细胞的调控起到了关键的作用。OGD后HBMEC分泌的PDGF-β水平明显下降。结合小鼠OGD模型的结果,推测脑卒中后脑血管内皮细胞分泌PDGF-β减少,可导致脑血管内皮细胞对周细胞吸附功能削弱,使得周细胞由内皮细胞上脱离,启动了脑卒中早期BBB的破坏。
研究[21]表明内质网应激爆发会加重BBB的破坏。OGD条件下HBMEC中内质网应激相关蛋白CHOP、Caspase-12、GPR78表达水平均显著增加,钙离子水平明显增高,ROS水平也升高,表明OGD确实诱发了HBMEC的内质网应激。在OGD处理后加入内质网应激抑制剂4-PBA,HBMEC的损伤程度明显减轻。因此,我们认为OGD诱发的内质网应激爆发导致HBMEC损伤是引起BBB破坏的原因之一。
近年来,Wnt信号通路已被证明在维持脑血管和神经细胞功能方面发挥重要的调节作用。在神经系统中Wnt7能调节BBB的形成并维持其通透性。研究[22]表明,脑血管内皮细胞Wnt7蛋白的表达减少会导致内皮细胞通透性增加,且内皮细胞中β-catenin的存在也非常重要,其通过与其他基因的相互作用来维持BBB的完整性。以往有研究[23]探索了Wnt/β-catenin在脑卒中后BBB功能维护中的作用。本研究同样发现Wnt7/β-catenin信号通路在OGD后的内皮细胞中被抑制,Wnt7和β-catenin蛋白的表达水平显著下降。有研究[24]发现缺氧导致的内质网应激和Wnt通路之间存在密切关系:低氧诱导内质网应激,并下调Wnt受体低密度脂蛋白受体相关蛋白6(low-density lipoprotein receptor related protein 6,LRP6)以及β-catenin的表达来抑制Wnt下游信号。我们在小鼠体内和HBMEC体外实验中均证实,脑缺血缺氧导致的脑血管内皮细胞内质网应激爆发,可能是内皮细胞损伤和BBB功能障碍的重要机制。基于Wnt7/β-catenin信号通路在病理生理状态下对BBB和脑血管内皮细胞的重要作用,我们在HBMEC中用抑制剂4-PBA阻断OGD后的内质网应激;研究结果显示内皮细胞Wnt7和β-catenin的蛋白表达水平均显著提高,表明减轻内质网应激可以促进Wnt7/β-catenin信号通路的活化。
综上所述,本研究阐明了内质网应激导致脑血管内皮细胞的损伤可能是脑卒中BBB功能紊乱的关键,其中Wnt7/β-catenin信号通路的抑制是内质网应激损伤作用的机制之一。
作者贡献声明
王震虹负责课题指导;董海平、谢海怡、马晓晓参与了实验设计;董海平、谢海怡参与了实验操作;谢海怡、马晓晓参与了数据整理分析、论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was instructed by WANG Zhenhong, and designed by DONG Haiping, XIE Haiyi and MA Xiaoxiao. Experimental operation was conducted by DONG Haiping and XIE Haiyi. The data was analyzed by XIE Haiyi and MA Xiaoxiao. The manuscript was drafted and revised by XIE Haiyi and MA Xiaoxiao. All the authors have read the last version of paper and consented for submission.
利益冲突声明
本研究作者均声明不存在利益冲突。
All authors declare no conflict of interest.
参考文献