慢性髓系白血病(chronic myeloid leukemia,CML),是一种髓系造血干细胞异常增殖的恶性疾病,全球每年每10万人中有1~2例,占成人白血病总数的15%~20%,在各年龄段中均可发生。CML发生的主要原因是白血病细胞的增殖失控、分化障碍以及凋亡受阻。在95%的CML患者体内均能检测到染色体易位产生的BCR-ABL1融合基因,该融合基因编码一种持续活化的蛋白酪氨酸激酶,能诱导CML的发生[1]。目前,对于CML的治疗方案以靶向BCR-ABL1融合蛋白的酪氨酸激酶抑制剂类药物为主。以伊马替尼(imatinib)为代表的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)可通过竞争性结合激酶区ATP位点,特异性占据BCR-ABL1融合基因的酪氨酸激酶受体,从而阻断肿瘤细胞的恶性克隆性增殖过程[2]。随着伊马替尼及后续第二、三代TKI的广泛临床应用,CML治疗的10年总生存率达到85%以上,CML患者的疾病缓解率及长期生存率得到了显著改善[3]。但是,使用TKI治疗CML时,有约15%的患者出现了耐药性,且疾病分期越差,越容易出现耐药。此外,经过长期TKI治疗,大部分患者的造血干细胞中仍能检测到BCR-ABL1的mRNA表达;即使是分子层面上检测不到肿瘤标志物的CML患者,在中断治疗后,仍有约60%的患者会出现病情复发[4]。因此,阐明CML细胞增殖及分化的分子机制和寻找CML新的治疗靶点,是目前CML疾病研究的重点方向。
癌-睾丸抗原(cancer-testis antigen,CTA)是一类多功能蛋白家族,生理状态下主要在男性生殖细胞中表达,而在其他成人体细胞中不表达或低水平表达。研究[5]表明,CTA参与调控肿瘤细胞的转录网络、有丝分裂保真和减数分裂重组、干细胞分化、细胞癌变等过程。CTA作为一类重要的肿瘤抗原,在多种癌细胞中表达,但在正常细胞中表达受限,具有较好的免疫原性,可诱导机体产生特异性细胞免疫应答和体液免疫反应[6]。因此,CTA作为肿瘤诊断的生物标志物和免疫治疗的靶点,具有很大的应用潜力。临床试验中已针对CTA家族蛋白黑色素瘤相关抗原1(MAGE1)和纽约食管鳞状上皮细胞癌抗原(NY-ESO-1)进行了多种肿瘤疫苗研究,展现出一定的临床疗效及良好的生物安全性[7]。目前,大多数CTA在肿瘤发生和发展过程中的生物学功能尚不清楚。
CT63是CTA家族的一员,亦称PASD1(Per ARNT Sim domain containing 1),最早在弥散性大B细胞淋巴瘤中被发现[8]。2005年,研究者在急性髓系白血病患者的血清、骨髓和外周血中检测到CT63高表达[9]。2019年,研究者发现CT63在胶质瘤患者中的表达上调,且敲降CT63表达可抑制胶质瘤细胞的增殖能力[10]。2022年,研究者在结直肠癌组织样本中检测到CT63高表达,并认为CT63可作为结直肠癌的免疫治疗靶点[11]。在健康人体中,CT63仅在生殖组织中表达;但对于肿瘤患者,肿瘤组织和癌旁一些正常组织中也发现该基因的表达,这提示CT63表达对肿瘤的发生和发展具有促进作用。癌症基因组图谱(the cancer genome atlas,TCGA)数据库中现有数据显示,CT63在CML患者肿瘤细胞中的表达量升高,然而CT63在CML中的具体作用及其分子机制目前尚不清楚。本研究拟探讨CT63在CML细胞增殖与分化过程中的作用及其可能的分子机制,以期为相关的靶向治疗研究提供理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞、基因与质粒
人慢性髓系白血病K562细胞系以及人胚肾上皮HEK293T细胞系均为本实验室保存。人源CT63基因的CDS区片段来自NCBI RefSeq数据库的NM_173493.3序列,特异靶向CT63基因的短发夹RNA(short hairpin RNA,shRNA)序列通过InvivoGen网站设计(
1.1.2 主要试剂与仪器
DMEM培养基、RPMI-1640培养基(源培生物,中国),胎牛血清(Gibco,新西兰),限制性核酸内切酶、T4 DNA连接酶(Thermo Fisher,美国),兔源CT63抗体(NOVUS,美国),兔源CD11b、CD14抗体(Abcam,英国),鼠源α-tubulin、HSP60抗体(Proteintech,美国),兔源细胞色素C氧化酶Ⅳ(cytochrome C oxidase Ⅳ,COX Ⅳ)、丙酮酸脱氢酶、电压依赖性阴离子通道(voltage-dependent anion channel,VDAC)、琥珀酸脱氢酶A(SDHA)抗体(CST,美国),Lipo3000细胞转染试剂盒(Invitrogen,美国),反转录试剂盒(Takara,日本),Hieff qPCR SYBR Green Master Mix(翌圣生物,中国),CCK8试剂、线粒体呼吸链复合物Ⅳ活性检测试剂盒(生工生物,中国),Blood & Cell Culture DNA Mini Kits(QIAGEN,德国)。
凝胶电泳仪、PCR仪(Bio-Rad,美国),超灵敏多功能成像仪(GE,美国),共聚焦显微镜(ZEISS,德国),QuantStudio™ 7 Flex实时荧光定量PCR仪(Thermo Fisher,美国),接触式超声波裂解仪(SONICS,美国),FACSCalibur™流式细胞分选仪(BD,美国),Livecyte™活细胞成像分析系统(Sartorius,德国),IVIS™小动物活体成像系统(PerkinElmer,美国)。
1.2 实验方法
1.2.1 细胞培养
HEK293T细胞使用含10% FBS的DMEM培养基培养,K562细胞使用含10% FBS的RPMI-1640培养基培养。培养基中均加入100 U/mL青霉素和100 U/mL链霉素双抗混合液,并培养于37 ℃、含有5% CO2的恒温培养箱中。除病毒生产部分使用HEK293T细胞系外,其余实验结果均来源于K562细胞系。
1.2.2 质粒构建
对单链DNA引物进行沸水浴10 min,通过自然降温退火,使其形成具有BamH Ⅰ/EcoR Ⅰ黏性末端的双链产物。使用BamH Ⅰ/EcoR Ⅰ限制性内切酶切割pGreen-Puro载体并切胶回收,将带有BamH Ⅰ/EcoR Ⅰ黏性末端的pGreen-Puro线性化片段与退火产物进行连接,构建特异性敲降CT63基因的shRNA敲降质粒,以下记为shCT63。同时,使用不靶向任何基因的相同大小片段作为阴性对照,记为shCtrl。含有shRNA片段的敲降质粒在细胞中表达后,能够通过产生siRNA特异性结合并降解靶基因的mRNA,下调靶基因的表达水平。shRNA片段的目的序列见表1。
表1 shRNA片段的目的序列
Tab 1
| shRNA | Target sequence (5′→3′) |
|---|---|
| PG-shCT63-1 | GCTTTGCATATCCATGTTCTA |
| PG-shCT63-2 | GCCATTGATAGATACCTCAAA |
| PG-shCT63-3 | CCAAACACATTACGCCACGTT |
| PG-shCT63-4 | GCTACAGTTATTAGATGGCT |
| PG-shCT63-5 | GCCTGAGGTGAATCCATTGTA |
| PG-shCtrl | CCTAAGGTTAAGTCGCCCTCG |
1.2.3 稳转细胞系构建
将带有绿色荧光信号且含shRNA片段的质粒与dR8.9、VSVG质粒按比例配置(4∶3∶2),使用Lipo3000转染试剂将质粒转染至细胞密度约80%的HEK293T细胞中。转染6 h后更换培养基,48 h后收集上清液,使用孔径0.22 μm的滤膜过滤,得到病毒液。将病毒液与培养基按1∶1比例配置后加入polybrene(终浓度为10 μg/mL),将混合液加入细胞密度40%~60%的待转K562细胞系中,24 h后换为含10% FBS的RPMI-1640培养基。病毒感染72 h后使用细胞流式分选仪筛选绿色荧光信号阳性的细胞,得到敲降CT63表达的实验组K562细胞(shCT63 K562细胞系)和未敲降CT63表达的对照组K562细胞(shCtrl K562细胞系)。
1.2.4 qRT-PCR实验
使用TRIzol法提取细胞的RNA后,使用反转录试剂盒,参照说明书步骤进行操作,获得细胞的cDNA。使用SYBR试剂配制反应体系,并设定反应条件,上机进行定量PCR扩增。参照内参基因,以算法
表2 qRT-PCR的引物序列
Tab 2
| Gene | Forward primer (5′→3′) | Reverse primer (5′→3′) |
|---|---|---|
| CT63 | CATCGTGGGGAATGAGAGGG | GATTGCAGAGGGGCACAGAT |
| mtDNA | CGAAAGGACAAGAGAAATAAGG | CTGTAAAGTTTTAAGTTTTATGCG |
| Nuclear | CAACTTCATCCACGTTCACC | GAAGAGCCAAGGACAGGTAC |
| HSP60 | GTGTAGACCTTTTAGCCGATGC | GTGCCAGTACAGTAGCAGTGG |
1.2.5 蛋白质印迹检测
细胞沉淀中加入适量体积裂解液,混匀后冰上静置10 min。使用超声裂解仪40%功率裂解,超声条件为超声3 s,间隔3 s,8个循环。12 000×g离心10 min后吸取上清液,蛋白定量后加入适量上样缓冲液,95 ℃加热10 min形成上样样品。进行SDS PAGE电泳,使用湿转仪将蛋白转移至PVDF膜上。用含有5%脱脂牛奶的TBST溶液封闭,加入对应的一抗,4 ℃孵育过夜。用TBST洗膜3次,每次10 min,加入对应二抗室温孵育1 h,再经TBST洗膜后加入高敏型化学发光检测试剂,利用化学发光法进行成像。
1.2.6 Livecyte™活细胞成像细胞增殖实验
将shCtrl K562或shCT63 K562细胞系以1×104个/孔的密度接种于多聚赖氨酸包被的96孔板中,每组6个重复。100×g离心6 min使细胞贴壁后,将96孔板置于Livecyte™仪器中,在37 ℃、含有5% CO2的条件下培养。每间隔4 h对生长中的细胞进行1次拍摄,连续拍摄4 d,并使用Livecyte™软件分析细胞成像和增殖。
1.2.7 小鼠成瘤实验
使用6~8周龄的裸鼠,以注射K562 shCtrl细胞的裸鼠作为对照组(12只),以注射K562 shCT63-2细胞(简称shCT63)的裸鼠作为实验组(12只)。对小鼠左上肢腋下皮肤进行消毒后,皮下注射基质胶与细胞悬液1∶1混合的液体,每只小鼠注射2×106个细胞。注射4周后取出小鼠,麻醉后在IVIS™小动物成像系统中检测并拍摄荧光信号图。颈椎断裂处死小鼠,解剖取出肿瘤,拍照并称重肿瘤,使用4%多聚甲醛固定后进行石蜡包埋并切片。
1.2.8 苏木精-伊红染色(H-E染色)
石蜡切片在二甲苯、乙醇溶液和水中依次浸泡后,使用苏木精染液对切片染色4 min。切片用流水冲洗10 min,1%盐酸乙醇冲洗3 s,流水冲洗10 min,再浸泡在伊红染液中染色1 min。最后将切片依次在水、乙醇溶液和二甲苯中浸泡,取出晾干后封片。
1.2.9 免疫荧光染色
细胞在4%多聚甲醛中固定10 min。PBS洗2次,使用少量PBS重悬细胞后,100×g离心8 min。轻轻吸去残留液体,用含0.25% NP40、1% Triton X-100的通透液破膜10 min,PBS洗3次。用含5% BSA的封闭液孵育30 min,一抗4 ℃孵育过夜。用PBS洗3次,加荧光二抗(1∶500)室温孵育1 h。用PBS洗3次,加入1 μg/mL浓度的DAPI染液室温孵育10 min。PBS洗3次后封片,在显微镜下观察并拍照。
1.2.10 佛波酯诱导分化
使用DMSO配置浓度为1 mmol/L的佛波酯(phorbol 12-myristate 13-acetate,PMA)溶液。将适量PMA溶液分别加入敲降CT63表达的实验组细胞与未敲降CT63表达的对照组细胞的培养基中,使PMA工作浓度达到1 μmol/L。加药后即开始计时,48 h后收取细胞样品。
1.2.11 线粒体DNA(mtDNA)检测
1.2.12 线粒体呼吸链复合物Ⅳ活性检测
大量培养shCtrl K562和shCT63 K562细胞系,使用线粒体呼吸链复合物Ⅳ活性检测试剂盒,参照说明书操作,检测细胞中线粒体呼吸链复合物Ⅳ的活性。
1.2.13 细胞活性测定
使用细胞计数试剂盒8(cell counting kit-8,CCK-8)检测细胞增殖情况。将shCtrl K562或shCT63 K562细胞以1×104个/孔接种于96孔板中,在37 ℃含有5% CO2的条件下培养。每组设立10个重复孔。细胞每培养24 h后,吸去培养基并在每孔中加入含检测试剂的培养基继续培养4 h,使用酶标仪测定各孔在450 nm波长下的吸光度数值D(450 nm),计算相对细胞活力,反映各组细胞增殖情况。
1.3 数据分析
1.3.1 生存曲线分析
使用Kaplan-Meier plotter生存分析网站(
1.3.2 RNAseq数据分析
使用R软件(v4.3.1)分析来自上海旭燃生物科技有限公司提供的RNA-seq数据。将原始数据导入R语言程序中,进行质量控制和预处理,使用limma包进行差异分析,设置差异表达倍数(fold change)大于1.5或小于-1.5,以P值0.05为阈值,筛选出差异表达的基因列表。使用clusterProfiler包对差异基因列表作GO分析与GSEA分析,探究差异基因在生物学功能和信号通路上的富集情况。使用enrichplot包对GO分析和GSEA分析的结果进行可视化,生成图表展示差异基因在功能富集上的结果。
2 结果
2.1 敲降 CT63 对K562细胞增殖的作用
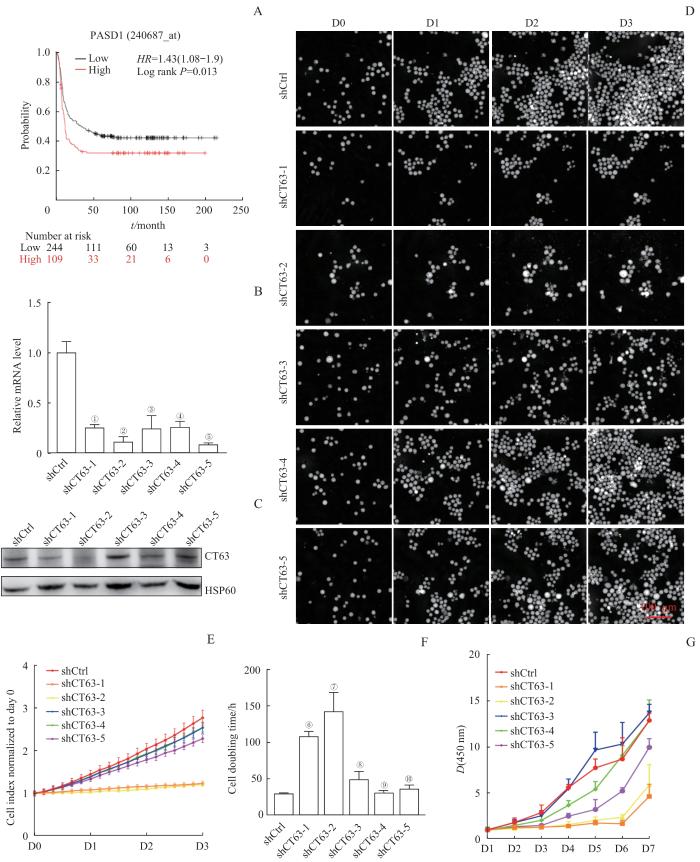
从TCGA数据库中筛选出353份髓系白血病患者的样本,Kaplan-Meier生存曲线分析结果显示CT63高表达的患者生存期显著缩短(图1A)。
图1
图1
CT63 敲降后K562细胞增殖能力变化
Note: A. Kaplan-Meier survival curves of high and low expression of CT63 in myeloid leukemia patients. B. qRT-PCR analysis of CT63 knockdown efficiency in K562 cells. C. Western blotting analysis of CT63 levels in stable CT63 knockdown cell lines. D. Proliferation of stable shCtrl and CT63 knockdown cell lines assessed by live cell image assay. E. Live cell image analysis of proliferation rate of K562 after down-regulation of CT63 protein. F. Cell doubling time of K562 after down-regulation of CT63 protein. G. CCK-8 proliferation assay of indicated K562 cells. ①P=0.004, ②P=0.001, ③P=0.004, ④P=0.004, ⑤P=0.001, ⑥P=0.003, ⑦P=0.017, ⑧P=0.095, ⑨P=0.463, ⑩P=0.145, compared with the shCtrl group.
Fig 1
Proliferation of K562 cells after down-regulation of CT63
qRT-PCR和Western blotting结果显示,与对照组相比,实验组细胞的CT63表达量在mRNA水平均显著降低(图1B),shCT63-1和shCT63-2细胞中的CT63在蛋白水平的敲降最明显(图1C)。活细胞实时监控显示,与对照组相比,CT63敲降效果好的实验组细胞(shCT63-1、2)增殖速度降低(图1D、E),细胞倍增时间显著增加,而蛋白水平降低不明显细胞的倍增时间与对照组相比则无显著差异(图1F)。活细胞实时监控结果显示,敲降CT63能抑制人CML细胞K562细胞系的增殖。CCK-8实验结果显示,与shCtrl组相比,敲降CT63导致K562细胞的增殖速度和细胞活力降低(图1G)。
2.2 敲降 CT63 对小鼠皮下成瘤的影响
注射肿瘤细胞4周后,对照组12只裸鼠均长出了肉眼可见的皮下肿瘤,而实验组仅有3只长出肿瘤(图2A)。使用IVIS™小动物活体成像系统检测裸鼠肿瘤部位的mCherry荧光信号强度。结果显示,与对照组相比,实验组的肿瘤荧光信号强度显著降低(图2B)。对裸鼠进行解剖,取出肿瘤组织后对比发现,实验组肿瘤的大小和质量与对照组相比均显著降低(图2C、D)。H-E染色结果显示,对照组的肿瘤细胞核染色较深,提示肿瘤具有较高的恶性程度(图2E)。免疫荧光染色结果显示,敲降肿瘤细胞中CT63表达后(图2F、G),Ki67阳性的细胞比例降低(图2H、I),说明敲降CT63使肿瘤组织中处于活跃分裂期的细胞减少,肿瘤生长可能因此受到了抑制。
图2
图2
CT63 敲降后K562细胞在裸鼠皮下成瘤的能力变化
Note: A. Subcutaneous tumor of nude mice. B. Average radiant efficiency of region of interest. C. Tumor size. D. Tumor weight. E. H-E staining of tumor. F/H. Immunofluorescence staining of CT63 and Ki67 in tumor tissue. G/I. Relative fluorescence density of Immunofluorescence staining in F and H. ①P=0.000, ②P=0.029, ③P=0.000, ④P=0.000, compared with the shCtrl group.
Fig 2
Tumorigenic ability of K562 cells in nude mice after down-regulation of CT63
2.3 敲降 CT63 对K562细胞分化的影响
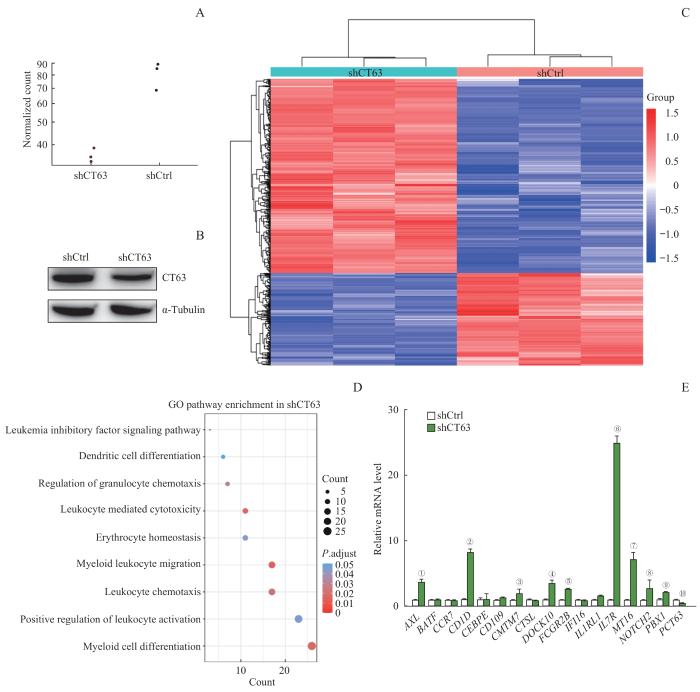
筛选CT63敲降后造成的人CML细胞差异表达mRNA,采用RNA-Seq技术研究人CML细胞的表达谱改变,每组设置3个重复。确认了实验组细胞CT63在RNA水平(图3A)和蛋白水平(图3B)的表达量均被降低后,筛选对照组与实验组中基因表达量差异倍数大于1.5(log2FC≥1.5,P≥0.80)的差异表达mRNA,对其进行分层聚类热图分析(图3C)。图中每个矩形方块代表一个差异表达值,红色表示表达上调的mRNA,蓝色表示表达下调的mRNA,分层聚类热图分析2组细胞中差异表达mRNA的分布情况。结果显示,敲降CT63后,476个基因的表达上调,同时297个基因的表达下调(图3C)。对2组细胞差异表达mRNA进行GO功能分类及富集分析,发现聚集差异表达mRNA数量前9位的GO term分别是髓系细胞分化、白细胞活化的正调节、白细胞趋化性、髓系白细胞迁移、红细胞稳态、红细胞介导的细胞毒性、粒细胞趋化性的调节、树突状细胞分化和白血病抑制因子信号通路(图3D)。为验证GO分析的结果,利用qRT-PCR实验检测CT63敲降对K562细胞髓系分化相关基因mRNA表达水平的影响,结果显示CT63敲降导致髓系细胞分化相关标志物IL7R、AXL、CD1D和MT16等表达上调(图3E)。
图3
图3
CT63下调后K562细胞分化能力变化
Note: A/B. CT63 knockdown efficiency in K562 in RNA and protein level. C. Heat maps and hierarchical clustering of differently expressed mRNA in shCtrl and shCT63 K562 cells. D. GO function analysis of differently expressed mRNA in shCtrl and shCT63 K562 cells. E. qRT-PCR analysis of the expression of myeloid cell differentiation genes. ①P=0.000, ②P=0.000, ③P=0.063, ④P=0.001, ⑤P=0.000, ⑥P=0.000, ⑦P=0.001, ⑧P=0.077, ⑨P=0.001, ⑩P=0.003, compared with the shCtrl group.
Fig 3
Differentiation of K562 cells after CT63 downregulation
2.4 敲降 CT63 后K562细胞向单核/巨噬细胞分化
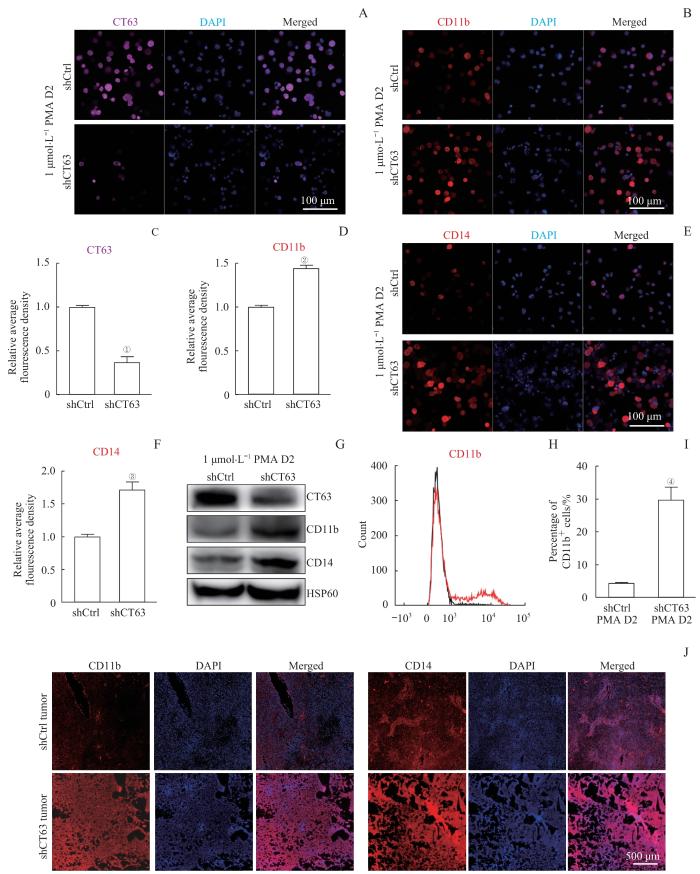
使用PMA分别诱导对照组shCtrl K562细胞和实验组shCT63 K562细胞向单核/巨噬细胞分化。免疫荧光染色结果表明,实验组CT63蛋白下调后(图4A、C),单核/巨噬细胞的细胞表面标志物CD11b(图4B、D)和CD14(图4E、F)阳性的细胞显著增加。Western blotting(图4G)和流式细胞术检测(图4H、I)结果显示CT63敲降促进单核/巨噬细胞的细胞表面标志物CD11b和CD14表达。对皮下成瘤实验获得的肿瘤组织样本进行免疫荧光染色实验,结果同样显示实验组细胞衍生的肿瘤组织中CD11b和CD14阳性的细胞较对照组显著增多(图4J)。该结果提示CT63可能限制肿瘤细胞向单核/巨噬系分化。
图4
图4
敲降 CT63 对K562细胞向单核/巨噬细胞分化的影响
Note: A, B, E. Immunofluorescence staining of CT63, CD11b, and CD14 after 48 h of PMA exposure in K562 cells. C, D, F. Relative fluorescence density of immunofluorescence staining. G. Western blotting analysis of CT63, CD11b and CD14 in K562 cells after 48 h of PMA exposure. H. CD11b positive cells of CT63-knockdown K562 cells and control after 48 h of PMA exposure. I. The percentage of CD11b positive cells. J. Immunofluorescence staining for CD11b and CD14 in tumor tissues. ①P=0.007, ②P=0.001, ③P=0.024, ④P=0.021, compared with the shCtrl group.
Fig 4
Effect of knockdown of CT63 on the differentiation of K562 cells into monocytes/macrophages
2.5 CT63对细胞代谢的调控作用
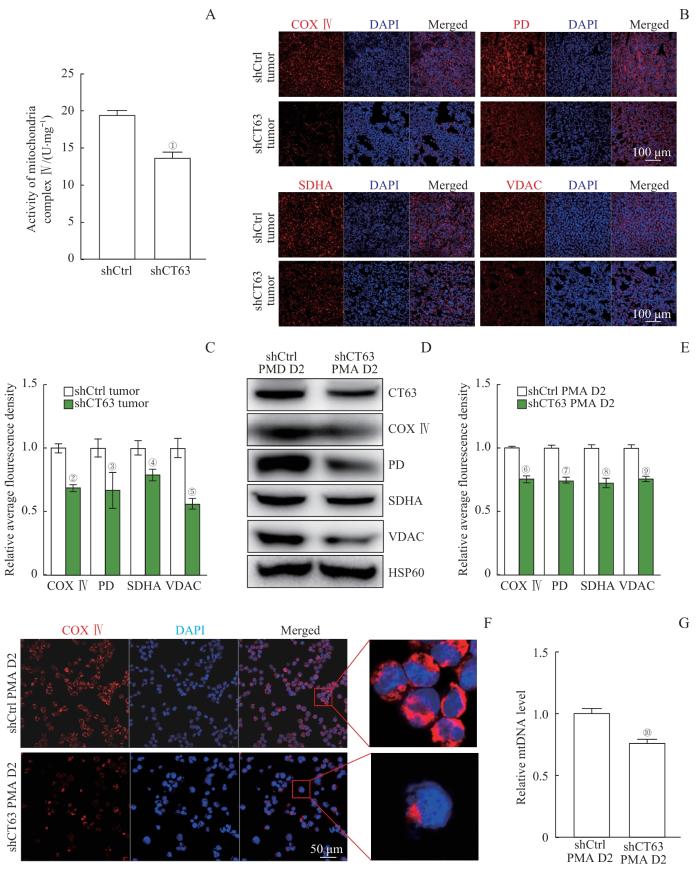
细胞线粒体呼吸链复合物Ⅳ的活性检测结果显示,实验组shCT63 K562细胞中其活性受到抑制(图5A)。免疫荧光实验检测线粒体相关标志物在实验组和对照组肿瘤中的表达(图5B),结果显示,敲降CT63后标志蛋白表达降低(图5C)。对PMA诱导分化2 d后的对照组和实验组细胞进行Western blotting检测(图5D、E),结果也与肿瘤免疫荧光实验结果一致。COX Ⅳ的免疫荧光实验结果显示:与对照组相比,实验组细胞中的COX Ⅳ表达显著降低,且亚细胞定位也发生变化(图5F)。提取细胞基因组DNA检测mtDNA的含量,结果显示实验组的mtDNA含量降低(图5G),进一步证明敲降CT63导致线粒体功能受损。
图5
图5
CT63对细胞代谢的调控作用
Note: A. Activity of mitochondria complex Ⅳ in shCtrl and shCT63 K562 cells. B. Immunofluorescence staining of mitochondrial markers in tumors. PD—pyruvate dehydrogenase C. Relative fluorescence density of immunofluorescence staining in B. D. Western blotting analysis of mitochondrial markers in shCtrl and shCT63 K562 cells with PMA treatment. E. Relative average fluorescence density of Western blotting analysis. F. Immunofluorescence staining and subcellular localization of COX Ⅳ, G. Relative mtDNA level in shCtrl and shCT63 K562 cells. ①P=0.006, ②P=0.000, ③P=0.021, ④P=0.007, ⑤P=0.001, ⑥P=0.000, ⑦P=0.000, ⑧P=0.001, ⑨P=0.000, ⑩P=0.035, compared with the shCtrl group.
Fig 5
Regulation of CT63 on cell metabolism
3 讨论
CML是一种危害较大的恶性肿瘤疾病,在早期,该疾病的治疗多采用羟基脲、白消安、干扰素等药物治疗;造血干细胞移植也可有效消除费城染色体阳性的细胞,起到一定治疗效果[13]。随后,TKI的临床应用大大改善了CML的治疗效果,但仍面临耐药和复发的挑战。为了提高完全治愈率,避免让患者终身服药,迫切需要一种能有效治愈CML的新方法。
许多CTA家族蛋白已经被证明参与肿瘤的发生与发展过程,其表达与多种肿瘤疾病密切相关。CT63在多种血液系统肿瘤和实体瘤中特异性表达,是急性白血病中最常见的CTA之一[9]。由此,我们推测CT63蛋白在血液系统肿瘤发生和发展过程中发挥重要功能。在本研究中,我们通过分析TCGA数据库中的数据发现,CT63高表达的髓系白血病患者存在显著的预后不良,这表明CT63具有成为CML治疗靶点的潜力。研究[14]表明,弥漫性大B细胞淋巴瘤患者的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)可以杀死CT63阳性的肿瘤细胞。基于CT63的DNA序列设计出的抗肿瘤疫苗能在动物体内诱导CTL细胞生成,且由此激活的免疫反应能成功杀死多发性骨髓瘤细胞[15]。这些结果都证明了CT63具有较强的免疫原性。CT63仅在精原干细胞中表达,这意味着CT63的表达局限于精子发生的早期阶段。所以我们推测,基于CT63设计出的肿瘤免疫疗法对治疗白血病具有较高的特异性,且不良反应相对较小。
无限增殖是肿瘤的主要特征之一,持续性的细胞增殖是肿瘤致病性的基础。肿瘤细胞的倍增时间表示细胞增殖1倍所需的时间,是用于量化计算肿瘤生长速度的参数。本研究通过体外活细胞实时成像和CCK-8实验,证实抑制CT63表达可导致CML细胞的增殖速率被抑制,细胞倍增时间增加。裸鼠成瘤实验证实,抑制CT63表达可导致CML细胞成瘤能力下降。免疫荧光染色结果显示,在敲降CT63的CML细胞及其衍生的肿瘤组织中,Ki67阳性的细胞显著减少。这些结果共同表明CT63可能通过调控细胞增殖参与CML细胞的恶性生长。
生理状态下,造血干细胞在骨髓中完全成熟后,会进入循环系统行使正常功能。对于CML患者,造血干细胞发生恶性转化后出现不受限的克隆性增殖,细胞成熟受阻,不成熟细胞大量增殖并被释放到血液中。通过血液细胞形态学检查可以检测到外周血中的不成熟细胞,这也是白血病筛查的一个重要指标[1]。本研究通过PMA诱导分化实验证实,敲降CT63显著促进CML细胞向单核/巨噬细胞分化。裸鼠成瘤实验结果进一步表明,敲降CT63后CML细胞的衍生肿瘤组织中单核/巨噬细胞表面标志物CD11b和CD14显著上调。这些结果共同表明,CT63可能通过抑制肿瘤细胞分化促进肿瘤生长。
研究[16]表明,线粒体与细胞分化之间存在着密切联系,在CML细胞向巨核细胞分化过程中,线粒体功能会发生显著变化。本研究发现抑制CT63表达可导致CML细胞线粒体呼吸链复合物Ⅳ活性显著下调;免疫荧光染色结果显示,敲降CT63后,CML细胞及其衍生的肿瘤组织中的某些线粒体相关标志蛋白表达显著下降。其中COX Ⅳ蛋白是线粒体呼吸链复合物Ⅳ的一个亚单位,与其他亚单位共同组成了该复合物。复合物Ⅳ是细胞线粒体呼吸链中的关键组成部分,负责将氧气与电子转化为水,同时提供细胞生理活动所需的能量。COX Ⅳ在这个过程中发挥着调节作用,参与调节复合物Ⅳ的活性和稳定性。COX Ⅳ表达正常与否显著影响整条呼吸链的功能状态以及细胞的能量生成。本研究表明,在CML细胞分化的过程中,敲降CT63导致肿瘤细胞COX Ⅳ表达降低,并改变了其在细胞内的定位。线粒体的功能与mtDNA的数量和质量紧密相关,mtDNA的数量(即mtDNA拷贝数)又受到mtDNA质量的影响,因此mtDNA拷贝数可作为线粒体功能的重要表征。本实验发现敲降CT63会导致mtDNA拷贝数降低,提示线粒体功能受损。这些结果表明,CT63通过调节线粒体的功能维持肿瘤细胞的持续增殖和未分化状态。
综上所述,本研究发现CT63在髓系白血病细胞中的高表达与患者不良预后密切相关。在实验中,我们观察到敲降CT63不仅延长了细胞的倍增时间,还显著抑制了CML细胞的增殖能力和在裸鼠皮下的成瘤能力。此外,体外实验证实,敲降CT63可促进CML细胞向单核/巨噬细胞分化,进而减弱其增殖和自我更新的能力。进一步的机制研究表明,CT63通过调控线粒体呼吸链复合物Ⅳ的功能,维持CML恶性发展。这些研究发现为CML的临床治疗提供了新的科学依据,提示CT63有望成为该疾病分子靶向治疗的新靶点。
作者贡献声明
雷鸣负责研究设计和指导;孔汝心负责实验操作、数据收集、数据分析及文章撰写;周亚群协助部分实验操作;魏婷宜负责实验指导以及论文修改。所有作者均阅读并同意最终稿件的提交。
AUTHOR's CONTRIBUTIONS
LEI Ming designed and guided the research project. KONG Ruxin completed the work of experiment conducting, data collection, data analysis and article writing. ZHOU Yaqun assisted with some of the experiments. WEI Tingyi was responsible for the guidance of experiment design and the revision of the paper. All authors have read the final manuscript and approved the submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献