在先天免疫反应中,髓系细胞发挥着重要的作用。健康个体中未成熟髓系细胞代表着不具有免疫抑制性的祖细胞。然而,癌症、慢性感染以及自身免疫性疾病等慢性炎症会影响未成熟髓系细胞分化,诱导具有强免疫抑制模式和功能的髓系细胞积累[1]。这群来源于骨髓祖细胞和未成熟髓系细胞且具有异质性和免疫抑制功能的细胞,称为髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)。小鼠MDSCs被定义为CD11b+ Gr1+。
近年来,一碳代谢在肿瘤中的重要性和功能引起了研究者的浓厚兴趣。一碳单位是仅含有一个碳原子的有机基团,如甲基、甲烯基、甲炔基、甲酰基等;而一碳代谢是一碳单位在生物体内生成与转移利用的过程。一碳代谢为细胞提供大量的一碳单位,在维持细胞核苷酸的合成、氨基酸的稳态和表观遗传的稳定方面起重要作用。糖代谢、脂代谢等对MDSCs的调控作用的研究较多,但叶酸循环代谢参与调控MDSCs的研究还未见报道。MDSCs的免疫抑制对肿瘤免疫治疗有很大的阻碍作用。靶向MDSCs提高肿瘤免疫疗效已成为肿瘤免疫治疗的趋势,完善 MDSCs的免疫抑制机制有助于寻找新的治疗靶点。MDSCs代谢对MDSCs的免疫抑制起到至关重要的作用,重编程MDSCs是提高肿瘤免疫疗效的有效策略。
本研究通过使用亚甲基四氢叶酸脱氢酶2(methylenetetrahydrofolate dehydrogenase 2,MTHFD2)抑制剂DS18561882和具有多靶点的小分子药物培美曲塞靶向MDSCs的叶酸循环代谢通路,探究叶酸循环对MDSCs免疫抑制作用的影响,通过细胞实验和荷瘤小鼠模型解析叶酸循环抑制剂对MDSCs分化和抑制功能的调控作用,并探讨靶向叶酸代谢通路联合免疫检查点阻断剂对肿瘤免疫疗效的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
小鼠为C57BL/6品系,小鼠繁育均在上海交通大学医学院无特定病原体(special pathogen free,SPF)级屏障设施中进行。
1.1.2 试剂和仪器
PBS(pH7.4)缓冲液和ACK Lysing Buffer购自美国Gibco;RPMI1640培养基、DMEM培养基购自美国Hyclone;胎牛血清、青霉素/链霉素购自爱必信(上海)生物科技有限公司;无水乙醇、三氯甲烷、异丙醇购自中国医药集团有限公司;牛血清白蛋白(bovine serum albumin,BSA)购自德国BioFROXX公司;HBSS缓冲液(含钙镁)购自北京索莱宝科技有限公司;0.5 mol/L EDTA(pH8.0)、TRIzol购自美国Thermo;Collagenase Ⅳ购自瑞士Rache;DNaseⅠ购自德国Sigma;DEPC water购自上海碧云天生物技术股份有限公司;AceQ® Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技股份有限公司;荧光标记抗体包括抗小鼠CD11b-APC (cat 101212)、抗小鼠Ly6g-PB(cat 127612)、抗小鼠Ly6c-APC-Cyanine7(cat 128026)、抗小鼠CD274-PE(cat 124308)和抗小鼠CD45-Percp(cat 103130)以及Zombie死活染料(cat 423101)和Fc block(cat 101320)购自美国BioLegend公司;重组小鼠粒细胞巨噬细胞集落刺激因子(GM-CSF)(cat 315-03)、重组小鼠粒细胞集落刺激因子(G-CSF)(cat 250-05)和重组小鼠白细胞介素-6(IL-6)(cat 216-16)购自美国Peprotech公司;DS18561882购自美国MedChemexpress公司;培美曲塞购自上海陶素生化科技有限公司;NAC购自美国Selleck公司;小鼠CD8a(Ly-2)磁珠试剂盒购自德国Miltenyi公司;小鼠抗CD3抗体(Cat 16-0032-82)、抗CD28抗体(cat 16-0281-82)、总活性氧簇检测试剂盒(cat 88-5930-74)、MitoSOX™ 线粒体超氧化物指示剂(cat M36005)、CFSE细胞增殖试剂盒(cat C34570)、CellTrace™ Violet 细胞增殖试剂盒(cat C34557)购自美国Thermo;抗CD8单抗、抗Gr1单抗和抗PD-1单抗购自美国Bioxcell公司。主要仪器:ThermoFisher培养箱,Eppendorf Centrifuge 5810R离心机,BD CantoⅡ流式细胞仪,BD FACS AriaⅢ流式分选仪,BIORAD CFX384 Touch qRT-PCR仪。
1.2 实验方法
1.2.1 体外诱导MDSCs以及DS18和培美曲塞处理
在RPMI完全培养基中加入120 ng/mL GM-CSF、120 ng/mL G-CSF和20 ng/mL IL-6,按照每毫升1×106个小鼠骨髓细胞的密度,将RPMI完全培养基铺至培养皿中,置于37 ℃的CO2培养箱,培养4 d[4]。在上述培养体系中额外加入3 μmol/L DS18或者培美曲塞,置于37 ℃的CO2培养箱,培养4 d。
1.2.2 RNA提取
在诱导的细胞(2×106)中加入1 mL TRIzol裂解,加入200 μL氯仿(三氯甲烷)剧烈震荡1 min,冰上静置10 min,离心后缓慢吸取上清,约400 μL,置于新的1.5 mL RNase-free EP管中,加入等体积的异丙醇,上下颠倒混匀,冰上静置30 min,离心后可见白色沉淀,加入950 μL 75%乙醇洗涤离心后弃上清,每个样品加30 μL DEPC水溶解,吹打溶解RNA。
1.2.3 反转录及实时定量PCR
TRIzol法抽提细胞总RNA,用5×HiScript Ⅱ qRT SuperMix Ⅱ将RNA反转录为cDNA,利用AceQ® Universal SYBR qPCR Master Mix进行实时定量PCR反应(表1)。
表1 实时定量PCR引物信息
Tab1
| Primer | Forward sequence (5'→3') | Reverse sequence (5'→3') |
|---|---|---|
| Aldh1l1 | CAGGAGGTTTACTGCCAGCTA | CACGTTGAGTTCTGCACCCA |
| Dhfr | CGCTCAGGAACGAGTTCAAGT | TGCCAATTCCGGTTGTTCAATA |
| Gapdh | AGGTCGGTGTGAACGGATTTG | TGTAGACCATGTAGTTGAGGTCA |
| Mthfd1 | GGGAATCCTGAACGGGAAACT | TGAGTGGCTTTGATCCCAATC |
| Mthfd2 | AGTGCGAAATGAAGCCGTTG | GACTGGCGGGATTGTCACC |
| Shmt1 | CAGGGCTCTGTCTGATGCAC | CGTAACGCGCTCTTGTCAC |
| Shmt2 | TGGCAAGAGATACTACGGAGG | GCAGGTCCAACCCCATGAT |
1.2.4 CD8+ T细胞增殖抑制
实验前1 d在96孔板中加入100 μL抗体稀释液(用PBS稀释抗体,终浓度为5 μg/mL anti-CD3和2 μg/mL anti-CD28),4 ℃静置过夜。采用CD8a(Ly-2)MicroBeads磁选出CD8+ T细胞。吸净包被的抗体稀释液,按照计数用RPMI完全培养基稀释CD8+ T细胞,每100 μL含有2×105个CD8+ T细胞,再将MDSCs和CD8+ T细胞按照1∶8的比例共培养于96孔圆底板,培养体系补液至200 μL,置于37 ℃的CO2培养箱,培养72 h。
1.2.5 检测MDSCs的活性氧(reactive oxygen species,ROS)水平
在收集的MDSCs中加入ROS 稀释液(RPMI基培稀释至5 μmol/L),置于37 ℃ 避光孵育30 min,待后续流式染色后,上机检测。
1.2.6 检测MDSCs的MitoROS水平
在收集的MDSCs中加入MitoROS稀释液(用含Ca2+和Mg2+的HBSS缓冲液稀释至5 μmol/L),置于37 ℃避光孵育10 min,待后续流式染色后,上机检测。
1.2.7 流式染色
取1×107个细胞过滤至流式管内,先用100 μL zombie死活染料稀释液(500×,用PBS稀释)加至细胞中,室温孵育30 min;加1 mL PBS清洗,400×g离心后弃上清;再用100 μL Fcblock稀释液(500×,用FACS Buffer稀释)孵育15 min,4 ℃;加1 mL FACS Buffer清洗,400×g离心后弃上清;最后在细胞中加入100 μL抗体稀释液(200×,用FACS Buffer稀释)染色,4 ℃ 孵育30 min,加1 mL FACS Buffer清洗,400×g离心后弃上清,加200 μL FACS Buffer重悬细胞,流式上机检测。
1.2.8 建立荷瘤小鼠模型
小鼠皮下注射100 μL 2×105个MC38或LLC肿瘤细胞,第10天起每隔1 d记录肿瘤最长径(a)和最短径(b),绘制肿瘤生长曲线。肿瘤体积(V)计算公式为V =0.5×a×b2。
1.2.9 荷瘤小鼠处理
培美曲塞单独处理组:小鼠肿瘤模型建立第10天起,每天给予荷瘤小鼠腹腔注射培美曲塞(200 mg/kg),连续给药5 d。抗CD8单抗处理组:小鼠肿瘤模型建立第10天起,隔天给予荷瘤小鼠腹腔注射抗CD8单抗(1 mg/kg),直至模型建立第21天。培美曲塞联合抗CD8单抗处理组:小鼠肿瘤模型建立第10天起,每天给予荷瘤小鼠腹腔注射培美曲塞(200 mg/kg),隔天给予荷瘤小鼠腹腔注射抗CD8单抗(10 mg/kg),直至模型建立第21天。抗Gr1单抗处理组:小鼠肿瘤模型建立第10天起,隔天给予荷瘤小鼠腹腔注射抗Gr1单抗(12.5 mg/kg),直至模型建立第21天。培美曲塞联合抗Gr1单抗处理组:小鼠肿瘤模型建立第10天起,每天给予荷瘤小鼠腹腔注射培美曲塞(200 mg/kg),隔天给予荷瘤小鼠腹腔注射抗Gr1单抗(12.5 mg/kg),直至模型建立第21天。抗PD-1单抗处理组:小鼠肿瘤模型建立第10天起,隔天给予荷瘤小鼠腹腔注射抗PD-1单抗(2.5 mg/kg),直至模型建立第21天。培美曲塞联合抗PD-1单抗处理组:小鼠肿瘤模型建立第10天起,每天给予荷瘤小鼠腹腔注射培美曲塞(200 mg/kg),隔天给予荷瘤小鼠腹腔注射抗PD-1单抗(2.5 mg/kg),直至模型建立第21天。绘制各组肿瘤生长曲线。
1.3 数据分析
流式数据均使用Flowjo10软件分析,利用Graphpad prism8软件进行统计分析,P<0.05表示差异具有统计学意义。RNA-seq数据利用DESeq2软件进行标准化处理,计算差异倍数,并采用NB(负二项分布检验的方式)进行差异显著性检验,最终根据差异倍数及差异显著性检验结果来筛选差异蛋白编码基因。筛选差异的条件为q<0.05且差异倍数(foldChange)>1.2或<0.4。
2 结果
2.1 体外诱导MDSCs高表达叶酸循环通路相关代谢酶
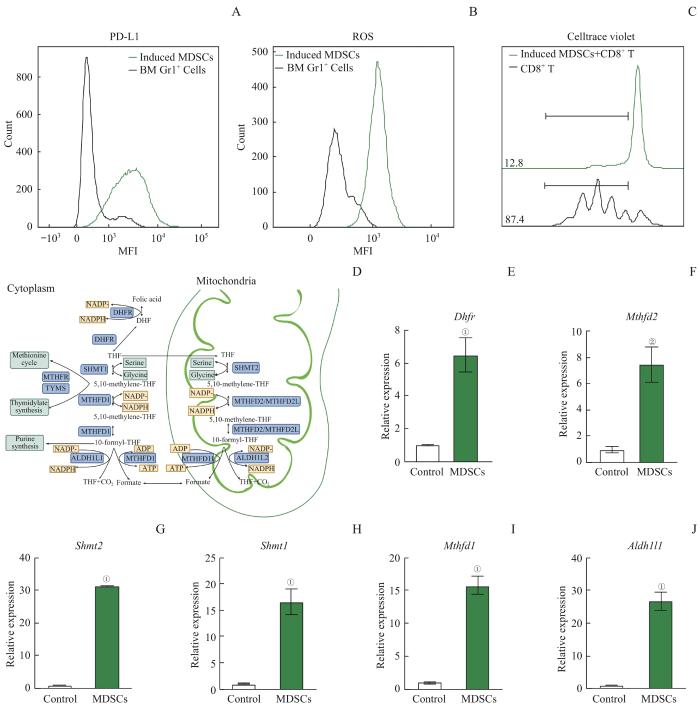
建立体外诱导MDSCs体系,使用含有GM-CSF、G-CSF以及IL-6细胞因子的RPMI完全培养基培养C57BL/6小鼠骨髓细胞,4 d后利用流式细胞术检测诱导的细胞PD-L1和ROS的水平。经诱导后,骨髓细胞的PD-L1表达量升高,ROS的产生量也增加,如图1A、B所示。在肿瘤微环境中,MDSCs高表达PD-L1,通过PD-L1/PD-1轴作用于CD8+ T细胞,抑制T细胞介导的抗肿瘤免疫应答。MDSCs释放ROS是抑制T细胞反应的主要机制之一[5-6]。为了验证诱导的MDSCs对CD8+ T细胞的抑制作用,将诱导的细胞和磁选纯化且violet染料标记的CD8+ T细胞共培养,72 h后利用流式细胞术检测CD8+T细胞增殖情况。结果显示体外诱导的细胞具有明显抑制CD8+ T细胞增殖的作用,如图1C所示,即成功建立体外诱导MDSCs体系。为了探究叶酸循环对MDSCs抑制功能的影响,利用qRT-PCR检测参与叶酸循环通路的代谢酶在MDSCs中的表达情况。细胞的一碳单位代谢发生在胞质区和线粒体[7],如图1D所示。结果显示不管是胞质内还是线粒体内,MDSCs叶酸循环通路关键代谢酶的表达都有明显的升高,如图1E~J所示。其中,MTHFD2在嘌呤或胸苷生物合成的一碳单位代谢中起到关键作用。肿瘤细胞中MTHFD2高度表达与血液和实体恶性肿瘤的不良预后呈正相关,抑制MTHFD2会减少肿瘤细胞的增殖、侵袭、迁移并诱导肿瘤细胞死亡,从而抑制多种恶性肿瘤的进展[8]。
图1
图1
体外诱导MDSCs高表达叶酸循环通路相关代谢酶
Note: A. Expression of PD-L1 in in vitro induced MDSCs detected by flow cytometry. B. ROS levels of in vitro induced MDSCs detected by flow cytometry. C. CD8 T cells proliferation was assessed by flow cytometry. D. One-carbon unit metabolic pathway. E‒J. RNA levels of folate cycle-related metabolic enzymes [Dhfr (E), Mthfd2 (F), Shmt2 (G), Shmt1 (H), Mthfd1 (I), and Aldh1l1 (J)] in induced MDSCs detected by qRT-PCR. ①P=0.000, ②P=0.001, compared with the control group.
Fig 1
Expression of folate cycle-related metabolic enzymes in induced MDSCs in vitro
2.2 靶向叶酸循环抑制MDSCs的存活
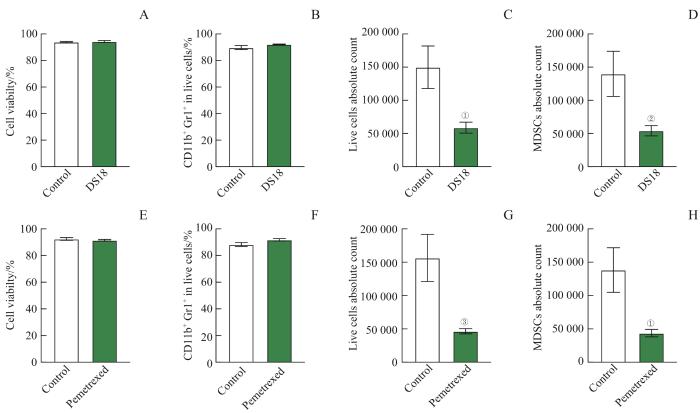
为了探究叶酸循环对MDSCs免疫抑制作用的影响,在MDSCs的体外诱导体系中分别加入叶酸循环代谢酶MTHFD2抑制剂(DS18561882,以下简称DS18)和叶酸拮抗剂培美曲塞,利用流式细胞术检测体外诱导的细胞活率以及活细胞占比。结果显示:与正常诱导的MDSCs细胞相比,加入DS18处理后的MDSCs细胞活率以及活细胞的比例并未受到影响,见图2A、B;但是受DS18处理后,诱导后的细胞总数以及MDSCs的数量减少,见图2C、D。以上结果说明抑制MTHFD2能够抑制骨髓细胞向MDSCs的诱导。与正常诱导的MDSCs相比,加培美曲塞处理后的MDSCs细胞活率以及活细胞的比例并未受到影响,如图2E、F;但从MDSCs的绝对计数来看,培美曲塞也影响了MDSCs的存活,如图2G~H。培美曲塞作为非小细胞肺癌的临床药物,已经被证实以DHFR、TS为靶点从而影响癌细胞的核苷酸代谢[9]。但是培美曲塞对肿瘤微环境中免疫细胞的作用尚不清楚,有研究认为培美曲塞会增加肿瘤中CD8+ T细胞的数量,并依赖CD8+ T细胞发挥抗肿瘤作用[8]。
图2
图2
靶向叶酸循环抑制MDSCs的分化
Note: A/E. Cell viability of bone marrow cells treated with DS18 (A) or Pemetrexed (E) detected by flow cytometry. B/F. Percentages of CD11b+ Gr1+ cells treated with DS18 (B) or Pemetrexed (F). C/G. Absolute count of live cells treated with DS18 (C) or Pemetrexed (G). D/H. Absolute count of MDSCs treated with DS18 (D) or Pemetrexed(H). ①P= 0.008, ②P= 0.013, ③P= 0.005, compared with the control group.
Fig 2
Targeting folate cycle inhibits differentiation of MDSCs
2.3 靶向叶酸循环解除MDSCs的免疫抑制功能
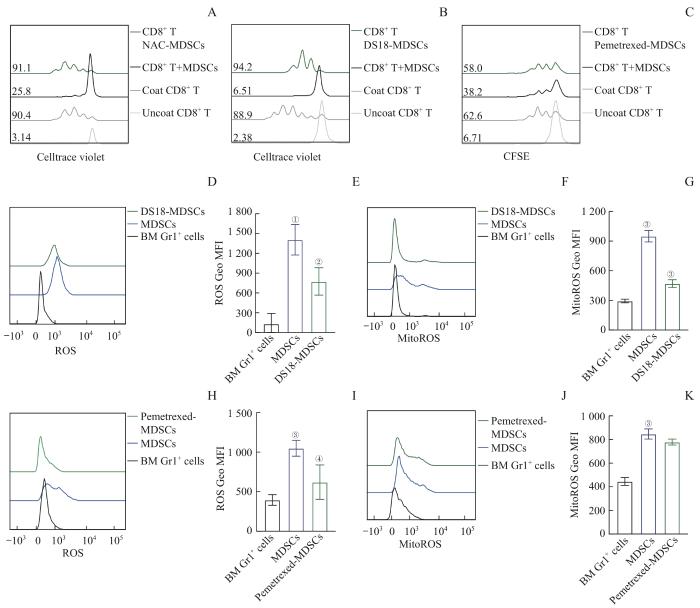
MDSCs抑制CD8+ T细胞的作用机制主要通过ROS等[10]。在前面的研究中我们也证实正常诱导的MDSCs抑制CD8+ T细胞增殖,如图1C。在共培养的体系中加入ROS的清除剂NAC,结果显示NAC处理组恢复了CD8+ T细胞的正常增殖,如图3A。以上结果提示清除共培养体系中的ROS会解除MDSCs对CD8+ T细胞增殖的抑制作用。将DS18处理的MDSCs和Celltrace violet标记的CD8+ T共培养,72 h后流式检测CD8+ T细胞增殖。与对照组相比,DS18处理后的MDSCs对CD8+ T细胞增殖的抑制作用明显降低,如图3B。流式检测对照组和DS18处理组MDSCs的细胞总ROS和线粒体ROS产生情况,结果显示DS18抑制MDSCs的ROS和线粒体ROS产生,如图3D~G。综上所述,抑制MTHFD2导致MDSCs的ROS水平降低,并能解除MDSCs对CD8+ T细胞的免疫抑制作用。和MTHFD2抑制剂一样,我们也将培美曲塞处理的MDSCs和CFSE标记的CD8+ T细胞共培养,72 h后流式检测CD8+ T细胞增殖情况。与对照组相比,培美曲塞处理后的MDSCs对CD8+ T细胞增殖的抑制作用降低,见图3C。此外,我们还检测了培美曲塞处理的MDSCs细胞中ROS和线粒体ROS水平,发现培美曲塞会减少MDSCs细胞内总ROS的产生,对线粒体ROS产生没有显著影响,见图3H~K。
图3
图3
靶向叶酸循环解除MDSCs的免疫抑制功能
Note: A. Proliferation of CD8+ T cells cocultured with NAC treated-MDSCs. B/C. Proliferation of CD8+ T cells cocultured with DS18-treated MDSCs (B) or Pemetrexed-treated MDSCs (C). D/H. ROS levels of DS18-treated MDSCs (D) or Pemetrexed-treated MDSCs (H) detected by flow cytometry. E/G. Quantitation of ROS Geo MFI. F/J. MitoROS levels of DS18-treated MDSCs (F) or Pemetrexed-treated MDSCs (J) detected by flow cytometry. I/K. Quantitation of MitoROS Geo MFI. ①P= 0.001, ②P= 0.024, ③P= 0.000, ④P= 0.035, compared with the control group.
Fig 3
Targeting folate cycle relieves immunosuppressive function of MDSCs
2.4 叶酸循环抑制剂处理后MDSCs的转录组分析
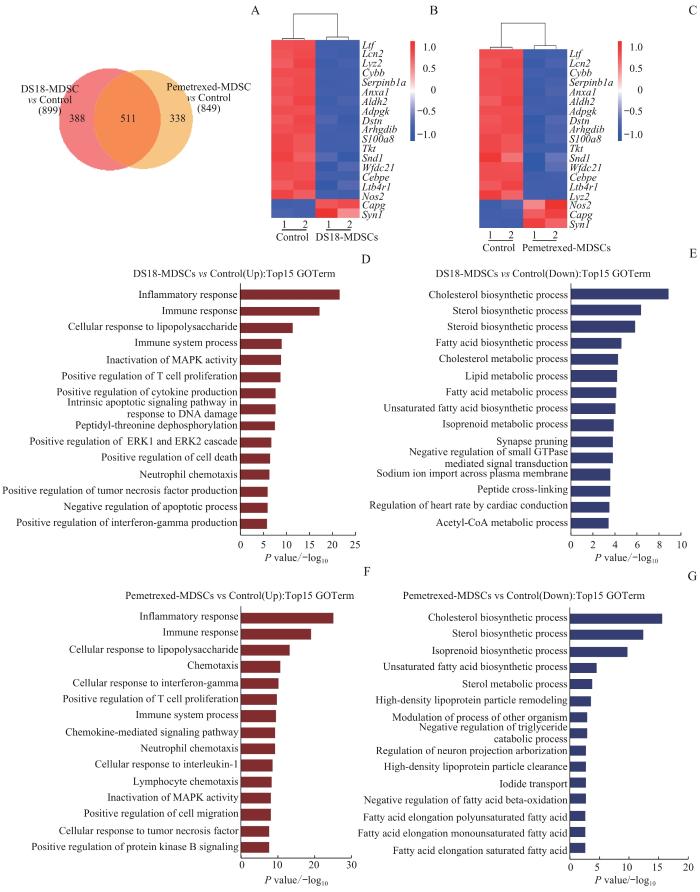
为了更加深入地探究抑制叶酸循环对MDSCs的影响,利用RNA-seq检测DS18和培美曲塞处理后MDSCs在转录组水平的变化。结果显示:DS18和培美曲塞处理后MDSCs与未处理MDSCs相比各有899及849个差异表达基因,其中包括511个共同的差异表达基因,见图4A。在2种叶酸循环抑制剂处理后,与MDSCs分化相关基因(S100a8、Cebpe、Anxa1、Ltf、Ltb4r1等)下调。另外,MDSCs抑制功能相关基因都有所下调,包括ROS产生有关的基因(Cybb)以及iNOS相关基因(Nos2),见图4B、C。通路分析显示抑制叶酸循环会导致炎症反应、免疫应答、正向调控T细胞增殖和IFN-γ产生等通路的上调,以及与胆固醇合成与代谢、脂质合成与代谢相关通路的下调,见图4D~G。以上结果提示抑制MDSCs叶酸循环可能影响更加广泛的代谢过程。有报道指出利用脂质作为能源对于MDSCs在肿瘤微环境中发挥免疫抑制作用至关重要[11]。
图4
图4
叶酸循环抑制剂处理后MDSCs的转录组分析
Note: A. Differentially expressed genes between DS18 and Pemetrexed-treated MDSCs, compared with the control group. B/C. Cluster analysis of differential gene groups in DS18 (B)- or Pemetrexed (C)-treated MDSCs, compared with the control group. D/E. GO enrichment analysis of differentially upregulated (D)or downregulated (E) genes in DS18-treated MDSCs (biological process). F/G. GO enrichment analysis of differentially upregulated (F) or downregulated (G) genes in Pemetrexed-treated MDSCs (biological process).
Fig 4
Transcript analysis of MDSCs after treatment with folate cycle inhibitors
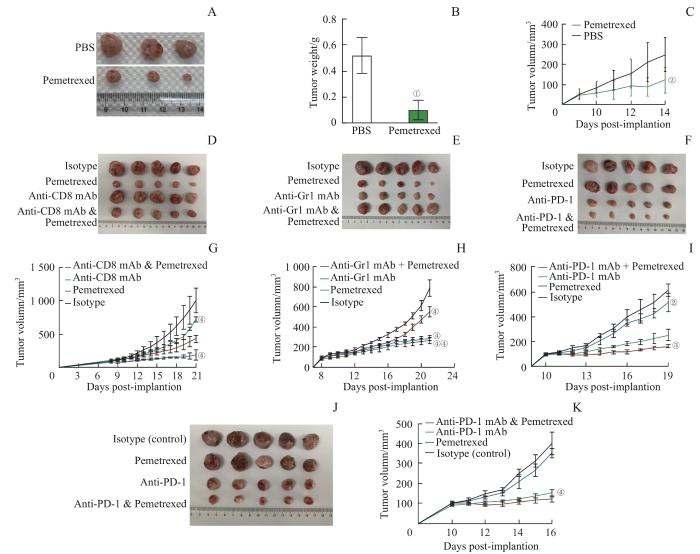
2.5 叶酸循环抑制剂的抗肿瘤作用
图5
图5
叶酸循环抑制剂的抗肿瘤作用
Note: A. MC38 tumor burden assessed by gross visualization. B. Tumor weight of MC38 tumor-bearing mice in pemetrexed-treated group. C. Tumor growth curve of MC38 tumor-bearing mice in pemetrexed-treated group. D/G. After combination of anti-CD8 monoclonal antibody and Pemetrexed treatment, MC38 tumor burden(D) was assessed by gross visualization, and tumor growth curve (G) was drawn. E/H. After combination of anti-Gr1 monoclonal antibody and Pemetrexed treatment, MC38 tumor burden(E) was assessed by gross visualization, and tumor growth curve (H) was drawn. F/I. After combination of anti-PD-1 monoclonal antibody and Pemetrexed treatment, MC38 tumor burden(F) was assessed by gross visualization, and tumor growth curve (I) was drawn. J/K.After combination of anti-PD-1 monoclonal antibody and Pemetrexed treatment, LLC tumor burden (J) was assessed by gross visualization, and tumor growth curve(K) was drawn.①P=0.009, ②P=0.029, ③P=0.001, compared with the control group. ④P=0.000, compared with the control group, combination of anti-CD8 monoclonal antibody and Pemetrexed group, combination of anti-Gr1 monoclonal antibody and Pemetrexed group, or combination of anti-PD-1 monoclonal antibody and Pemetrexed group.
Fig 5
Antitumor effects of folate cycle inhibitor
为了探究培美曲塞是否是依赖于CD8+ T细胞发挥抗肿瘤作用,我们分别用Isotype抗体、抗CD8单抗(1 mg/kg清除CD8+ T细胞)、培美曲塞(200 mg/kg)以及抗CD8单抗联合培美曲塞处理MC38荷瘤小鼠。结果显示:与培美曲塞处理组相比,抗CD8单抗联合培美曲塞处理组肿瘤进展加剧;与抗CD8单抗处理组相比,抗CD8单抗联合培美曲塞处理组肿瘤进展受到限制,如图5D、G。以上结果说明培美曲塞不仅可以直接限制肿瘤的生长,还部分依赖CD8+ T细胞发挥抗肿瘤作用。
为了进一步明确培美曲塞处理对肿瘤中的MDSCs是否有调控作用,我们分别用Isotype抗体、抗Gr1单抗(1.25 mg/kg,清除MDSCs)、培美曲塞(200 mg/kg)以及抗Gr1单抗联合培美曲塞处理MC38荷瘤小鼠。清除MDSCs能显著抑制肿瘤生长,证明MDSCs的免疫抑制作用。然而在清除MDSCs的荷瘤小鼠中,培美曲塞的抗肿瘤作用显著低于培美曲塞单独处理的小鼠,如图5E、H。单独使用抗Gr1单抗时,肿瘤减小,说明清除抗体则清除了具有免疫抑制性的MDSCs;而抗Gr1单抗和培美曲塞二者联用后肿瘤反而增大,说明培美曲塞治疗的情况下清除Gr1+ 细胞不利于抗肿瘤,那么清除的这些Gr1+ 可能就是具有抗肿瘤作用的细胞,这和MDSCs的免疫抑制功能相悖。所以我们推断,在培美曲塞治疗时,将肿瘤内这些具有免疫抑制功能的MDSCs细胞重编成为具有抗肿瘤作用的细胞。以上结果提示培美曲塞的处理不仅降低了肿瘤中MDSCs的免疫抑制功能,还可能进一步使MDSCs重编程具有免疫活化或“抗肿瘤”表型,进而阻碍肿瘤的生长。
免疫检查点治疗是现在临床肿瘤免疫治疗的主要方法。PD-1/PD-L1是主要的免疫检查点,通过单克隆抗体阻断PD-1或PD-L1,可恢复并增强肿瘤中的CD8+ T细胞的杀伤功能。由于肿瘤微环境中免疫抑制因子和免疫抑制细胞的存在,免疫检查点治疗肿瘤具有局限性。若同时靶向肿瘤中免疫抑制因素,就可以增强免疫检查点治疗的效果。接下来,我们想要探究培美曲塞联用抗PD-1抗体是否可以增强免疫治疗的效果。为了探究这一问题,我们建立C57小鼠MC38(如图5F、I),以及LLC皮下瘤模型(如图5J、K),在建模第10天后分别给予荷瘤小鼠小剂量培美曲塞(50 mg/kg)治疗、抗PD-1单克隆抗体(250 μg/kg)治疗以及培美曲塞联用抗PD-1单克隆抗体治疗。结果显示在MC38和LLC 2个小鼠皮下瘤模型中,培美曲塞联用抗PD-1抗体比抗PD-1抗体单独治疗均有更好的抗肿瘤作用。
3 讨论
本研究优化并建立体外诱导MDSCs体系,重点探讨MDSCs的叶酸循环对其免疫抑制功能的影响。我们分别用DS18561882和培美曲塞2种叶酸循环抑制剂处理体外诱导的MDSCs,发现其均会影响MDSCs的分化以及ROS的产生。MDSCs叶酸循环受到抑制后,对CD8+ T细胞增殖的抑制作用受到限制。通过建立C57小鼠MC38皮下瘤模型,给予培美曲塞治疗,发现肿瘤生长明显受到抑制。通过Gr1中和抗体处理清除肿瘤MDSCs后,培美曲塞联合处理反而加剧了肿瘤进展,说明在荷瘤模型中培美曲塞发挥作用依赖于浸润的MDSCs。基于以上发现及转录组测序结果,我们推测抑制叶酸循环不仅抑制了MDSCs的“促肿瘤”表型,还有可能重编程MDSCs成为“抗肿瘤的表型”,具体机制有待进一步探索。
叶酸循环是一碳单位代谢的主要部分,为其提供合成DNA的原料,同时会产生大量还原型烟酰胺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH),而线粒体和NADPH氧化酶又是产生内源性ROS的主要来源,ROS对MDSCs发挥免疫抑制功能及其分化具有重要的调控作用。研究表明MDSCs产生的ROS和过氧亚硝酸盐修饰TCR和CD8[14]。通过这些修饰,CD8+ T细胞失去了结合磷酸化的MHC和诱导外周CD8+ T细胞抗原特异性耐受的能力。ROS抑制剂处理后,MDSCs对CD8+ T细胞的抑制作用解除[15],用ROS清除剂NAC处理体外诱导的MDSCs与CD8+ T细胞共培养,CD8+T细胞增殖也得到了恢复。qPCR结果表明体外诱导的MDSCs比正常的骨髓CD11b+ Gr1+细胞叶酸循环相关代谢酶的RNA水平高,其中MTHFD2作为参与线粒体叶酸一碳单位代谢主要的酶,其表达也有所升高。MTHFD2也被称为NMDMC(NAD-dependent mitochondrial methylenetetrahydrofolate dehydrogenase-cyclohydrolase,NAD依赖性线粒体亚甲基四氢叶酸脱氢酶-环水解酶),具有脱氢酶和水解酶双功能。使用MTHFD2抑制剂处理MDSCs能够降低其ROS以及线粒体ROS的产生,NADPH/NADP+比例下降,说明MTHFD2调控髓源性抑制细胞ROS的产生。ROS是MDSCs抑制CD8+ T细胞功能的重要介质,而MTHFD2抑制剂处理后的MDSCs对CD8+ T细胞增殖的抑制作用减弱。以上结果提示MTHFD2可能成为限制MDSCs免疫抑制功能的新靶点。
经典的叶酸循环拮抗剂培美曲塞和MTHFD2抑制剂处理的结果一致,对MDSCs诱导分化以及ROS的产生有影响。由于2种叶酸循环抑制剂对MDSCs的作用一致,我们将2种抑制剂处理的MDSCs与正常诱导的MDSCs进行RNA-seq分析,发现两种抑制剂对MDSCs表达有影响的共同基因超过各自差异基因的50%以上。目前培美曲塞已是临床上治疗非小细胞肺癌和恶性胸膜间皮瘤的化疗药物,作为叶酸拮抗剂, 能够抑制胸苷酸合成酶、二氢叶酸还原酶以及甘氨酰胺核苷甲酰基转移酶等多种与叶酸合成相关的酶活性,减少细胞DNA合成,致使肿瘤细胞的分裂停滞在S期,抑制肿瘤的进展。既往研究多使用体外细胞培养体系或具有免疫缺陷的裸鼠荷瘤模型探索药物靶标,因此忽略了药物对肿瘤微环境中其他成分特别是免疫细胞的作用。近年来,有研究表明培美曲塞能提高肿瘤微环境中CD8+ T细胞的数量。我们进一步发现培美曲塞对MDSCs浸润的影响不大,但结合体外实验和转录组测序结果,我们推测培美曲塞可能通过重编程MDSCs为抗肿瘤的表型提高抗肿瘤免疫应答。然而培美曲塞并不仅仅抑制叶酸循环代谢,还包括直接抑制TS酶,导致肿瘤嘧啶代谢障碍。另外,由于多聚谷氨酸化使得培美曲塞在肿瘤细胞内活性更强、更持久,发挥其相对特异的抗肿瘤活性。本研究中动物实验采用培美曲塞作为抗叶酸循环代谢用药,还存在一些潜在的干扰因素,有待进一步研究。
MTHFD2在成熟分化的组织中表达很低甚至不表达,而在胚胎以及大部分肿瘤中高表达,是开发抗肿瘤药物的靶标,且不良反应较小[16]。DS18561882[17]和LY345899[18]是目前研究使用最多的2种MTHFD2抑制剂。与LY345899(IC50为663 nmol/L)相比,DS18561882(IC50为 6.3 nmol/L)对MTHFD2的选择性更高,具有更高效的抗肿瘤效果和良好的口服药代动力学特性。这对药物转向临床治疗具有重大的意义,但未来还需要更多的体内实验验证其有效性及作用机制。另外,在我们的前期研究中,LY345899并未展现出和DS18561882一样的抑制MDSCs的作用(结果未展示)。
综上所述,本研究主要以肿瘤中MDSCs为研究重点,探究叶酸循环对MDSCs免疫抑制功能的影响,靶向叶酸循环代谢重编程MDSCs。另外,我们的研究完善了抗癌药物培美曲塞抗肿瘤的免疫作用机制,并为肿瘤免疫治疗提供了新的治疗靶点。
作者贡献声明
王静和颜克鹏参与了实验设计,王静、颜克鹏和何蕊参与了数据分析和整理,王静和何蕊参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was designed by WANG Jing and YAN Kepeng. The data was collected and analyzed by WANG Jing, YAN Kepeng and HE Rui. The manuscript was drafted and revised by WANG Jing and HE Rui. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献