骨质疏松症、关节炎、佩吉特病、肿瘤性骨溶解,以及骨科植入物的无菌性松动都与骨溶解有关,骨溶解导致骨量减少、骨折风险增加[1]。在口腔颌面部,颞下颌关节炎导致的骨溶解会引发髁突吸收,使患者张口受限,严重影响患者的生活质量。这些疾病有一个共同特点,即破骨细胞过度活化、骨吸收功能增强[2]。骨代谢为一个动态均衡体系,其间成骨细胞的骨生成与破骨细胞的骨溶解相辅相成[3]。作为已知唯一的专职执行骨吸收功能的细胞类型,破骨细胞在骨骼的发育、生长和代谢稳态中发挥关键作用[4]。目前,治疗骨溶解性疾病的常用药物包括非甾体类抗炎药、双膦酸盐以及各类单克隆抗体药物;然而,这些药物的应用受限于显著的不良反应和高昂的成本[5]。鉴于此,近年来降低破骨细胞活性和相应炎症反应的新药研发,已成为一个新的研究热点。
骨溶解通常伴随炎症过程,其明显特征是免疫细胞和破骨细胞的显著浸润[6]。作为免疫系统的关键组成部分,巨噬细胞是分泌炎症因子的主要来源。巨噬细胞在核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)作用下,会发生分化并形成破骨细胞[7];即使在缺乏RANKL的条件下,多种炎症因子也能促使破骨细胞的形成[8]。此外,炎症因子,如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)等,与RANKL之间存在明显的协同效应,不仅能够激发RANKL及其受体(receptor activator of nuclear factor-κB,RANK)的表达,从而促进破骨细胞的形成,还能够加剧骨质吸收,进而加速炎症性骨溶解[9]。因此,在骨溶解的微观环境中,协同调控骨髓来源巨噬细胞(bone marrow-derived macrophage,BMM)诱发的炎症过程与破骨细胞驱动的骨侵蚀尤为重要。
亚精胺(spermidine,SPD)是一种普遍存在于各类生物体的天然多胺物质,包括自细菌至人类体内。大量食物中都含有丰富的多胺,其中大豆、茶叶和蘑菇富含SPD[10]。然而,瑞典青少年膳食调查[11]显示,其多胺摄入量仅为(316±170)μmol/d,低于瑞典营养建议书中所推荐的541 μmol/d。作为一种多胺,SPD已被证明具有保护心脏和神经的作用[12]。近年来,随着研究的深入,SPD在治疗类风湿性关节炎方面的作用也逐渐被发现[13]。已有研究[14]报道,同属多胺的精胺在胶原诱导的大鼠关节炎模型中对软骨和骨破坏具有一定的改善作用;然而另一方面,有研究[15]发现,精胺对细胞的增殖和迁移具有促进作用,可能引起细胞的过度增殖,从而增加肿瘤发生的风险。本研究通过探究不同剂量SPD对脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7巨噬细胞功能及BMM分化为破骨细胞的影响,评估SPD在抑制巨噬细胞炎症反应和破骨细胞活性方面的作用,并探讨SPD对LPS诱导的小鼠颅骨骨溶解的治疗效果,旨在为骨溶解治疗提供潜在的思路和策略。
1 对象与方法
1.1 实验动物及细胞来源
C57BL/6雄性小鼠,SPF级,6周龄,购自上海吉辉实验动物饲养有限公司,实验动物生产许可证号为SCXK(沪)2022-0009。小鼠饲养于上海交通大学医学院附属第九人民医院实验动物中心SPF级屏障系统中,实验动物使用许可证号为SYXK(沪)2020-0025。饲养环境温度20~26 ℃,湿度40%~70%,光照周期为12 h/12 h明暗交替。
小鼠巨噬细胞系RAW264.7购自中国科学院细胞库。
1.2 主要试剂和仪器
SPD、二氯二氢荧光素乙酰酯(dichlorodihydrofluorescein diacetate,DCFH-DA)染色液、苏木精-伊红(hematoxylin-eosin,H-E)染色液(上海碧云天生物技术有限公司),胎牛血清(Avantor,美国),细胞培养基α-MEM、DMEM(HyClone,美国),大肠埃希菌来源的LPS(InvivoGen,美国),重组小鼠RANKL(RD,美国),重组小鼠巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)、Cell Counting Kit-8(CCK-8)试剂盒(MCE,美国),二氢乙锭(dihydroethidium,DHE)染色液(Proteintech,中国),RNA提取试剂盒(Axygen,美国),实时荧光定量PCR试剂(TaKaRa,日本),抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(南京建成生物工程研究所有限公司)。
倒置显微镜(ECLIPSE Ti-E,日本Nikon),实时荧光定量PCR仪(QuantStudio 5,美国Applied Biosystems),高分辨率Micro-CT扫描机(μCT100,瑞士SCANCO Medical AG)。
1.3 细胞培养
首先,将RAW264.7细胞接种至含10%胎牛血清的DMEM培养基中,并在37 °C、5% CO₂环境下培养。当RAW264.7细胞的汇合度达到80%~90%时,使用一次性无菌刮刀轻轻刮取并吹散细胞,进行传代培养。
小鼠原代BMM的制备方法参考文献[16]。从2只4~6周龄的C57BL/6雄性小鼠股骨和胫骨的骨髓腔中收集骨髓细胞,并将收集的细胞重悬于含30 ng/mL M-CSF的完全α-MEM培养基中,于37 ℃、5%CO2的环境条件下培养。每隔2 d换1次培养基。待细胞汇合度达到80%~90%时,消化、传代。使用第1代BMM用于后续实验。
1.4 细胞毒性检测
将对数生长期的RAW264.7细胞按2×105个/孔接种至96孔板中,采用不同浓度的SPD(0、31.25、62.5、125、250、500、1 000 μmol/L)处理细胞,分别在96孔板中孵育24 h和48 h。处理完成后,每孔加入10 μL CCK-8溶液,继续孵育4 h,随后使用酶标仪在450 nm波长处测定吸光度。
1.5 TRAP染色
小鼠原代BMM以1×104个/孔的密度接种于96孔板中,待细胞贴壁后,分别添加50 ng/mL的RANKL和不同浓度(250、500、1 000 μmol/L)的SPD,每2 d更换1次培养基,持续诱导5 d。之后,弃去培养液,用PBS清洗3次,加入4%的多聚甲醛溶液,在室温下固定15~20 min后,使用PBS清洗3次。加入TRAP染色液,在室温下染色10 min。弃去染色液后,再次用PBS清洗3次。采用倒置显微镜观察标本后,随机挑选5个视场进行摄影,继而利用ImageJ工具分析阳性多核细胞的数量。
1.6 活性氧检测
将RAW264.7细胞接种于共聚焦培养皿中,接种密度为5×104个/孔。待细胞贴壁后,分别加入100 ng/mL的LPS和不同浓度(250、500、1 000 μmol/L)的SPD,培养24 h。然后使用DCFH-DA和DHE染色液分别测定细胞内的活性氧(reactive oxygen species,ROS)水平。
1.7 反转录实时荧光定量PCR检测
将小鼠BMM以5×105个/孔的密度接种于6孔板。待细胞贴壁后,分别加入50 ng/mL的RANKL及不同浓度(500、1 000 μmol/L)SPD作用24 h。用试剂盒从各组细胞中提取总RNA,反转录合成cDNA。随后,配置实时荧光定量PCR(real-time fluorescence quantitative PCR,qPCR)反应体系。扩增条件为:94 ℃预变性10 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸20 s,共40个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,Gapdh)基因作为内参基因,检测与骨吸收过程密切关联基因的表达,包括Trap、组织蛋白酶K(cathepsin K,Ctsk)、降钙素受体(calcitonin receptor,Ctr)以及树突状细胞特异性跨膜蛋白(dendritic cell-specific transmembrane protein,Dcstamp)。
将RAW264.7细胞接种于6孔板中,接种密度为4×105个/孔。待细胞贴壁后,分别加入100 ng/mL的LPS和不同浓度(500、1 000 μmol/L)的SPD,培养24 h。用同样的方式检测RAW264.7细胞炎症相关因子Il6、Tnf、一氧化氮合酶2(nitric oxide synthase 2,Nos2)的表达。
qPCR引物序列见表1。
表1 qPCR引物序列
Tab 1
| Gene | Forward primer (5'→3') | Reverse primer (5'→3') |
|---|---|---|
| Gapdh | TGGAGCCAAAAGGGTCATCA | ATGAGCCCTTCCACAATGCC |
| Trap | CAAAGAGATCGCCAGAACCG | GAGACGTTGCCAAGGTGATC |
| Ctsk | CTTCCAATACGTGCAGCAGA | TCTTCAGGGCTTTCTCGTTC |
| Ctr | TGCAGACAACTCTTGGTTGG | TCGGTTTCTTCTCCTCTGGA |
| Dcstamp | TTGAACCGAGCTGCATTCCT | GTTTCCCGTCAGCCTCTCTC |
| Il6 | TGCCTTCTTGGGACTGAT | CTGGCTTTGTCTTTCTTGTT |
| Tnf | TTAGAAAGGGGATTATGGCTCA | TTTGCAGAACTCAGGAATGGAC |
| Nos2 | CGTTCCTGGAGGTGCTTGA | TCTCGGGTGCGGTAGGTG |
1.8 LPS诱导的小鼠颅骨骨溶解模型建立
LPS诱导的小鼠颅骨骨溶解模型是根据先前的研究方法[17]建立的。选取24只6周龄的C57BL/6雄性小鼠,体质量为(20±2)g,并将其随机分为4组:假手术对照组、LPS组、SPD低剂量组和SPD高剂量组。首先,通过腹腔注射2%戊巴比妥溶液40 μL,深度麻醉小鼠;随后用去毛膏清除小鼠头部的毛发;沿颅骨长轴方向进行切割,运用剥离器细致地挑开骨膜。对LPS组、SPD低剂量组、SPD高剂量组的小鼠,在人字缝中央植入一块尺寸为4 mm×4 mm×2 mm、已浸润100 ng/mL LPS的明胶海绵;对照组则植入同体积的浸透PBS的明胶海绵。随后将创口严密缝合。3 d后,创口基本愈合,在LPS组和2个SPD干预组小鼠颅顶明胶海绵处皮下注射100 ng/mL LPS 10 μL;假手术组注射等体积的PBS。2个SPD干预组小鼠注射LPS同时,腹腔注射500 μmol/L(低剂量组)或1 000 μmol/L(高剂量组)SPD 200 μL;LPS和SPD注射频率均为1次/2 d,共注射7次。建模期间,各组小鼠均未出现不良反应或死亡。末次注射后次日,使用颈椎脱位法处死小鼠,断头后取颅骨。颅骨样本置于4%多聚甲醛中固定48 h,随后以流水冲洗过夜,最终保存于75%乙醇中。
1.9 Micro-CT扫描
使用Micro-CT扫描(分辨率9 μm,X射线源29 kV/175 μA,曝光时间300 ms)对颅骨样本进行扫描。感兴趣区域定义为骨吸收区周围的正方形区域,扫描后进行三维重建和定量形态学分析,计算骨体积分数(bone volume/trabecular volume,BV/TV)和骨矿物质密度(bone mineral density,BMD)。
1.10 组织切片染色
将颅骨样本浸泡在10% EDTA溶液(pH=7.4)中作脱钙处理,并置于常温下。每3 d更换1次脱钙液,脱钙过程持续4周。脱钙完成后,样本依次经过脱水、浸蜡、包埋以及切片处理。组织切片分别经过H-E染色和TRAP染色后,于显微镜下观察。
1.11 统计学方法
利用GraphPad Prism 8.0软件进行统计分析。正态分布的定量资料用x±s表示。多组间比较采用单因素方差分析,组间两两比较采用Tukey检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 SPD的细胞毒性
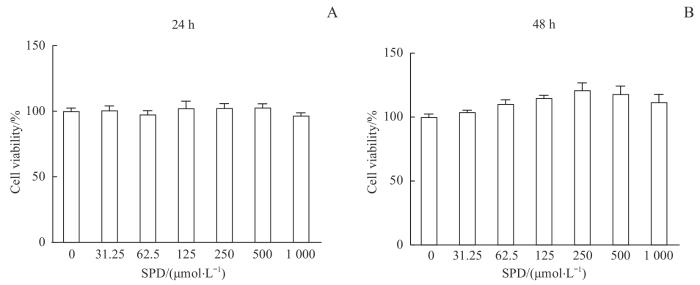
为了排除SPD对细胞的毒性作用,通过CCK-8实验评估SPD对细胞活力的影响。结果(图1)显示,1 000 μmol/L SPD在干预24 h和48 h后对RAW264.7细胞活性没有显著的影响,说明1 000 μmol/L及以下浓度的SPD对巨噬细胞无明显毒性。
图1
图1
CCK-8实验检测不同浓度SPD对RAW264.7细胞的毒性作用
Note: A. Cells cultured with SPD for 24 h. B. Cells cultured with SPD for 48 h.
Fig 1
Cytotoxicity of different concentrations of SPD on RAW264.7 cells detected by CCK-8 assay
2.2 SPD对LPS激活的巨噬细胞内ROS水平的抑制作用
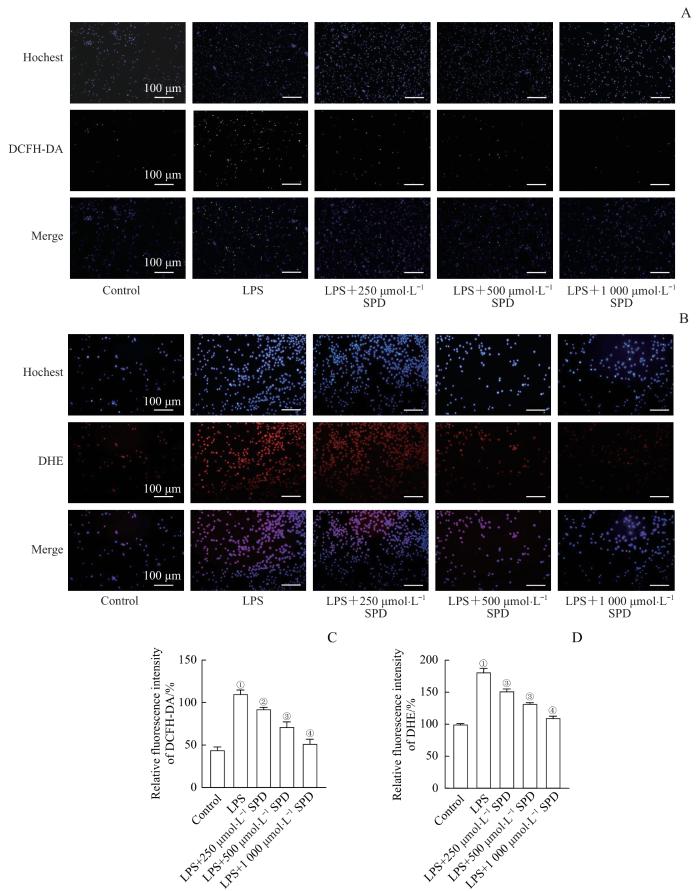
DCFH-DA主要用于检测细胞内的总ROS。如图2A、C所示,经过LPS激活后,RAW264.7细胞中ROS水平显著升高;在不同浓度SPD的作用下,细胞内ROS水平显著下降。
图2
图2
SPD对LPS激活的巨噬细胞内ROS水平的影响
Note: A/B. ROS levels in different groups of RAW264.7 macrophages detected by DCFH-DA probes (A, ×200) or DHE probes (B, ×200). C/D. Statistical analysis of relative fluorescence intensity of each group detected by DCFH-DA probes (C) or DHE probes (D). ①P<0.001, compared with the control group; ②P=0.002, ③P=0.001, ④P<0.001, compared with the LPS group.
Fig 2
Effects of SPD on ROS levels in LPS-activated macrophages
DHE主要用于检测细胞内的超氧阴离子水平。如图2B、D所示,经LPS激活后,RAW264.7巨噬细胞内的超氧阴离子水平显著升高,而经过不同浓度SPD处理后,细胞内超氧阴离子水平呈下降趋势。
2.3 SPD对LPS激活的巨噬细胞促炎相关基因表达的抑制作用
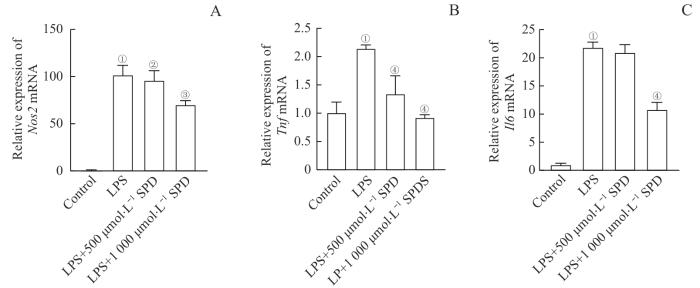
反转录qPCR(reverse transcription qPCR,RT-qPCR)分析结果(图3)表明,LPS刺激可显著提高RAW264.7细胞促炎基因Nos2、Tnf和Il6的mRNA表达水平。与LPS组相比,500 μmol/L和1 000 μmol/L SPD处理组细胞促炎基因的表达减少,并且表现出一定的浓度依赖性。这些结果表明,SPD对LPS诱导的巨噬细胞促炎基因表达具有抑制作用。
图3
图3
SPD对LPS激活的巨噬细胞促炎基因表达的影响
Note: A‒C. mRNA levels of Nos2 (A), Tnf (B), and Il6 (C). ①P<0.001, compared with the control group; ②P=0.031, ③P=0.001, ④P<0.001, compared with the LPS group.
Fig 3
Effects of SPD on expression levels of pro-inflammatory genes in LPS-activated macrophages
2.4 SPD在体外对破骨细胞分化的抑制作用
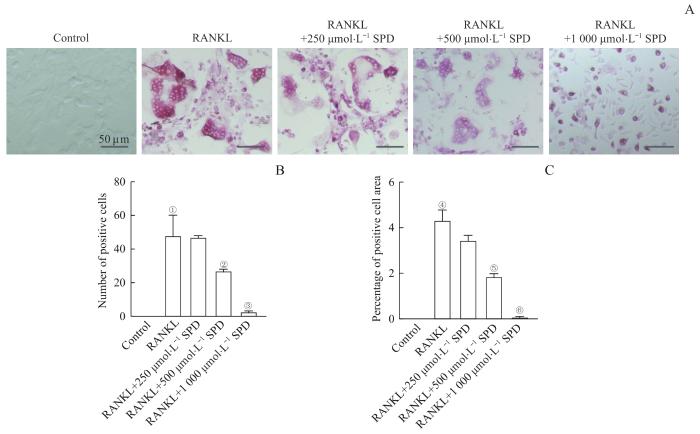
我们通过体外实验研究SPD对RANKL诱导的小鼠原代BMM向破骨细胞分化的影响。如图4所示,原代BMM经RANKL诱导后,形成大量TRAP阳性的多核破骨细胞,而SPD处理后,TRAP阳性破骨细胞的数量和面积减少,呈一定剂量依赖性;尤其是500 μmol/L和1 000μmol/L的SPD显著抑制破骨细胞的生成。可见,SPD可以抑制RANKL诱导的破骨细胞分化。
图4
图4
SPD对RANKL诱导的破骨细胞分化的影响
Note: A. TRAP staining of mouse BMMs 5 d after RANKL stimulation (×200). B. Number of positive cells.C. Percentage of positive cell area. ①P=0.002, ④P<0.001, compared with the control group; ②P=0.041, ③P=0.003, ⑤P=0.001, ⑥P<0.001, compared with the RANKL group.
Fig 4
Effects of SPD on RANKL-induced osteoclast differentiation
2.5 SPD对破骨细胞分化和功能相关基因表达的抑制作用
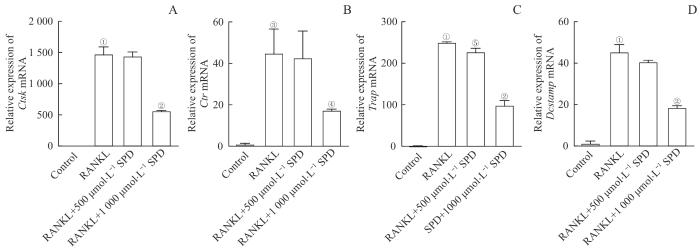
破骨细胞相关基因的表达代表了BMM向破骨细胞分化的能力,RANKL刺激引起的骨吸收和破骨细胞形成通常伴随着这些特异性标志基因的上调。为了研究SPD的抗破骨细胞分化的作用,我们通过RT-qPCR检测Ctsk、Ctr、Trap、Dcstamp基因的表达情况,结果(图5)显示:与对照组相比,破骨诱导组Ctsk、Ctr、Trap、Dcstamp基因的表达显著增加;而与破骨诱导组相比,1 000 μmol/L SPD处理组这4个基因的mRNA表达显著降低。
图5
图5
SPD对RANKL刺激24 h后BMM表达破骨细胞相关基因的影响
Note: A‒D. mRNA levels of Ctsk (A), Ctr (B), Trap (C), and Dcstamp (D). ①P<0.001, ③P=0.001, compared with the control group; ②P<0.001, ④P=0.020, ⑤P=0.018, compared with the RANKL group.
Fig 5
Effects of SPD on the expression of osteoclast-related genes in BMMs after 24 h of RANKL stimulation
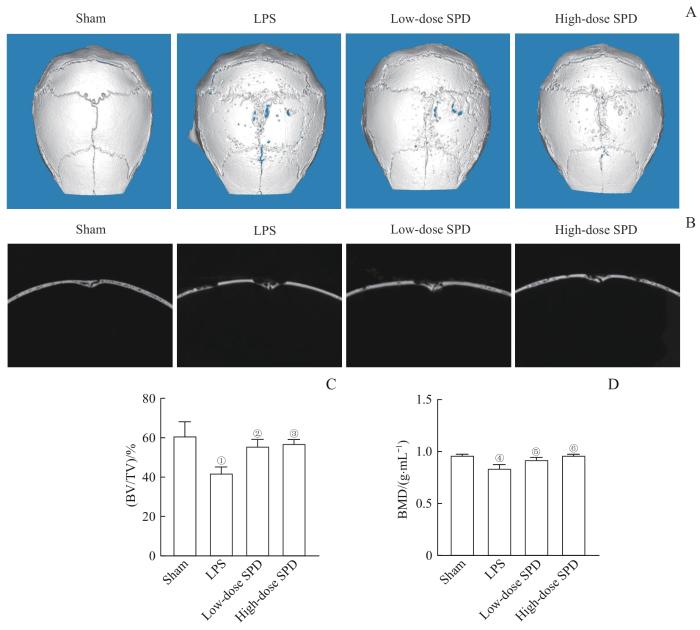
2.6 SPD对LPS诱导的小鼠颅骨骨溶解的抑制作用
图6
图6
Micro-CT分析SPD对小鼠颅骨骨溶解的治疗效果
Note: A. 3D reconstruction of mouse cranial bone. B. Sagittal CT images of mouse cranial bone. C. Statistical analysis of BV/TV. D. Statistical analysis of BMD. ①P=0.003, ④P<0.001, compared with the sham group; ②P=0.020, ③P=0.012, ⑤P=0.005, ⑥P<0.001, compared with the LPS group.
Fig 6
Micro-CT analysis of therapeutic effects of SPD on mouse calvarial osteolysis
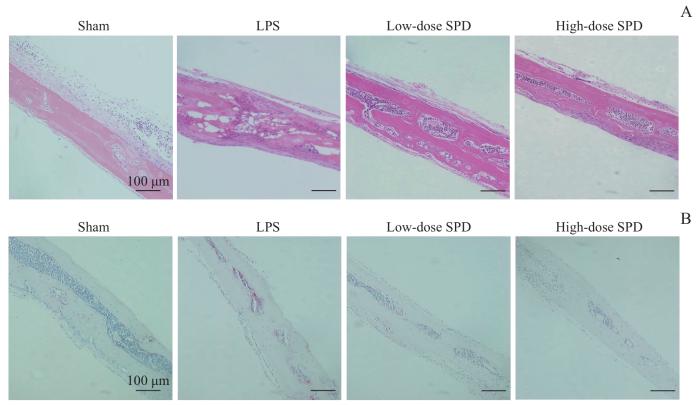
2.7 SPD对LPS诱导的小鼠颅骨内破骨细胞生成的抑制作用
图7
图7
SPD对小鼠颅骨骨溶解治疗效果的组织学分析
Note: A. H-E staining (×20). B. TRAP staining (×20).
Fig 7
Histological analysis of therapeutic effects of SPD on mouse calvarial osteolysis
3 讨论
小鼠RAW264.7细胞与破骨细胞的基因谱相似[24];作为破骨细胞的前体细胞,它是研究破骨细胞的重要工具。破骨细胞由单核巨噬细胞系或骨髓间充质干细胞在RANKL的诱导作用下融合形成[25]。本研究采用RANKL诱导体系,在体外成功将BMM分化为破骨细胞,并观察到多核破骨细胞的形成。本研究采用CCK-8法探究SPD干预RAW264.7细胞的安全浓度范围(0~1 000 μmol/L),然后选取250、500、1 000 μmol/L浓度的SPD开展后续实验。巨噬细胞在受到炎症因子刺激时,会激活呼吸爆发机制[26],致使线粒体功能变异[27]、氧气消耗显著增加,从而导致大量ROS的生成[28]。本研究中,我们发现在1 000 μmol/L SPD作用下,DCFH-DA和DHE的荧光强度,与未经LPS刺激的对照组细胞相近,表明SPD对ROS生成具有一定的抑制作用。同时,SPD对LPS刺激后的巨噬细胞炎症相关因子(Nos2、Tnf、Il6)基因的表达水平,呈剂量依赖性抑制作用,表明SPD具有一定的抗炎作用。TRAP由破骨细胞产生,是骨溶解性疾病诊断和监测的重要指标[29]。TRAP染色结果显示,SPD能够显著抑制BMM向破骨细胞的分化。这一发现对于临床治疗骨溶解性疾病具有重要的参考价值。通过RT-qPCR检测,我们发现,BMM在RANKL诱导下,参与破骨细胞前体细胞融合的Dcstamp基因、影响骨组织钙磷代谢的Ctr基因以及编码骨吸收所需蛋白水解酶的Trap和Ctsk基因的表达水平显著升高;而经过1 000 μmol/L SPD干预后,这些基因的表达水平显著下降。这进一步提示,SPD可能对破骨细胞的形成、扩散及骨吸收功能具有抑制作用。
骨溶解性疾病的标志性特征是破骨细胞介导的过度骨丢失[30]。为了深入探讨SPD在体内的效应,我们建立了由LPS诱导的小鼠炎症性颅骨骨溶解模型。该模型被广泛应用于骨溶解的研究,能够有效模拟局部骨缺损和骨吸收等现象,因此在一定程度上可反映骨溶解性疾病的某些临床特征。骨溶解性疾病的主要表现为骨吸收过度和骨质疏松等,这些变化在这个模型中也可以观察到。LPS为革兰阴性菌细胞壁的关键成分,能模拟体内炎症性骨质破坏的过程[31]。Micro-CT分析显示,SPD可显著改善由LPS诱导的颅骨骨溶解现象,BV/TV及BMD量化指标显著优于LPS组。同样地,组织形态学方法也进一步证实,SPD可抑制由LPS诱导的炎症反应、破骨细胞激活,以及骨组织丢失。
然而,本研究仍然存在一些局限性。首先,尽管SPD在体外展示了抑制巨噬细胞炎症反应与破骨细胞分化的作用,但未能深入探讨其中的具体机制。其次,SPD在更高剂量下的毒性及治疗效果有待进一步探究。最后,SPD是否能够通过口服途径抑制炎症性骨溶解尚不清楚。
综上所述,SPD在体外能够有效抑制巨噬细胞的炎症反应,以及RANKL诱导的破骨细胞分化;在实验动物模型中,SPD可改善由LPS诱导的小鼠炎症性颅骨骨溶解。这一发现揭示SPD在防治骨溶解相关疾病中具有潜在的应用价值。
伦理批准和动物权利声明
本研究涉及的所有动物实验均已通过上海交通大学医学院附属第九人民医院实验动物伦理委员会批准(审批号:SH9H-2022-A874-1)。所有实验过程均遵照《上海交通大学医学院附属第九人民医院实验动物相关规章制度》的条例进行。
Ethics Approval and Animal Right
All animal experiment protocols in this study were reviewed and approved by Animal Ethics Review Committee of Shanghai Ninth People′s Hospital, Shanghai Jiao Tong University School of Medicine (Approval No. SH9H-2022-A874-1), and all the protocols were carried out by following the guidelines of Rules and Regulations for Experimental Animals of Shanghai Ninth People′s Hospital, Shanghai Jiao Tong University School of Medicine.
作者贡献声明
赵心雨、陈旭卓参与实验设计,赵心雨、宋佳琪参与论文的写作和修改,赵心雨、张文超、陈旭卓参与实验操作,赵心雨、张文超参与数据分析,张善勇、黄慧参与课题指导及文章的审阅和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
ZHAO Xinyu and CHEN Xuzhuo were involved in the experimental design. ZHAO Xinyu and SONG Jiaqi contributed to the writing and revision of the manuscript. ZHAO Xinyu, ZHANG Wenchao and CHEN Xuzhuo carried out the experiments. ZHAO Xinyu and ZHANG Wenchao were responsible for data analysis. ZHANG Shanyong and HUANG Hui supervised the project, reviewed the manuscript, and provided critical revisions. All authors have read and approved the final version of the manuscript for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献