抗体是分泌形式的B细胞受体(B cell receptor,BCR),由2条相同的重链和2条相同的轻链组成[1]。编码抗体重链的基因由可变(variable,V)、多样(diversity,D)和连接(joining,J)基因组成,编码轻链的基因仅由V和J基因组成。抗体重链和轻链的氨基端可结合抗原且序列高度可变,被称为抗体V区。在该区中存在一些氨基酸序列高频变化的区域,称为互补决定区(complementarity-determining region,CDR),且重链和轻链的CDR在立体构象上共同决定了抗体分子的独特性[2]。在抗体重链或轻链的V区,CDR以外的氨基酸组成了骨架区(framework region,FR)。在抗体多样化的过程中,B细胞首先会发生VDJ基因随机重排以形成多样的抗体库,而后于外周生发中心(germinal center,GC)经历抗原刺激发生体细胞高频突变(somatic hypermutation,SHM),从而使抗体V区发生氨基酸改变及类别转换重排,以进一步增加抗体的多样性。
抗体基因序列发生突变的数量和位置可影响其自身的功能。研究发现,HIV的bnAbs的SHM极高,如在VRC01抗体谱系中存在高达40%~48%的氨基酸改变[7];而在SARS-CoV-2的nAbs中通常只在CDR有1~2个突变发生[8]。在人兔嵌合抗体中重链FR的单个氨基酸改变可使其活性发生极大改变[9],一些nAbs可通过重链CDR3结合SARS-CoV-2的受体结合结构域(receptor-binding domain,RBD)来发挥作用[10-12],因此许多研究者认为抗体重链氨基酸变化是决定其亲和力的关键。抗体行使功能时需要重链和轻链配对形成完整结构,而过往研究鲜少关注到抗体轻链氨基酸变化对亲和力的影响。因此,本研究聚焦于人鼠嵌合抗体轻链,探讨在具有中和SARS-CoV-2能力的人鼠嵌合抗体中,其轻链的氨基酸改变是否对抗体亲和力有关键影响,期望能够为nAbs和bnAbs的筛选提供新的思路并为人源化抗体编辑工程提供一定的基础。
1 对象与方法
1.1 实验对象
1.1.1 实验动物
以C57BL/6品系雌性小鼠为背景小鼠,用已重排的人源IGHV1-2*02、IGHD2-15*01、IGHJ1*01基因替换小鼠染色体上的J基因,并委托赛业生物科技有限公司构建抗体重链基因人源化小鼠,动物生产许可证号为SCXK(苏)2022-0016。
将上述已构建小鼠(实验组、对照组各3只)饲养于上海交通大学医学院实验动物中心清洁级动物房的标准笼中,3只/笼,使用许可证号:SYXK(沪)2018-0027。饲以标准饲料,自由摄食、饮水。饲养条件:照明周期为12 h/12 h,温度约为25 ℃,湿度为50%~60%,环境噪声小于60 dB。
1.1.2 细胞与载体
293T细胞株由上海交通大学医学院梁启明课题组馈赠,293S细胞株由上海交通大学医学院周爱武课题组馈赠,BHK21-ACE2细胞由上海交通大学医学院徐颖洁课题组馈赠。抗体人源重链、人源轻链表达载体由上海交通大学医学院李福彬课题组馈赠。
1.1.3 主要试剂
MnJ佐剂(由北京大学生命科学学院细胞分化与增殖教育部重点实验室蒋争凡课题组馈赠),编码SARS-CoV-2 RBD的mRNA疫苗(由上海交通大学医学院徐颖洁课题组馈赠)。DMEM培养基(Corning,美国),转染试剂(Polysciences,美国),无内毒素质粒大抽试剂盒(MACHEREY-NAGEL,德国),同源重组试剂(南京诺唯赞生物科技股份有限公司),无血清培养基(上海源培生物科技公司股份有限公司),SARS-CoV-2刺突三聚体(spike trimer,S-trimer)蛋白(苏州近岸蛋白质科技股份有限公司),N96 DNA产物纯化试剂盒、N96高纯质粒DNA小提试剂盒(北京天根生化科技有限公司)。
1.2 实验方法
1.2.1 抗体重链基因人源化小鼠的免疫及其血清抗体水平分析
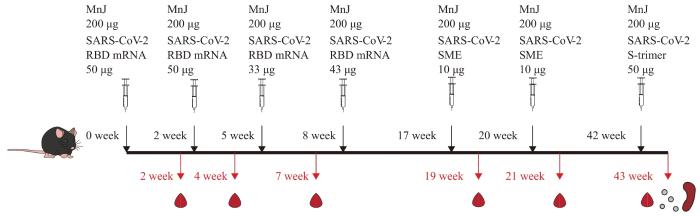
使用不同的SARS-CoV-2相关抗原成分对实验组小鼠进行多次免疫刺激,即每次将抗原成分与MnJ佐剂混合后,行腹腔和肌内同时注射;其中,第0、2、5、8周免疫刺激使用RBD mRNA作为抗原,第17、20周使用包膜蛋白(spike membrane envelope,SME)作为抗原,第42周使用S-trimer蛋白作为抗原。
于第2、4、7周,收集2组小鼠血清并采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)分析血清抗体水平;于第19、21周,再次收集小鼠血清并通过假病毒中和实验检测血清nAbs水平;于第43周,继续收集小鼠血清并通过ELISA分析其血清抗体水平(图1)。而后,选择血清中抗体水平最高的小鼠,用于后续抗体筛选。
图 1
图 1
小鼠免疫及血清抗体水平分析
Fig 1
Mice immunization and analysis of serum antibody levels
1.2.2 小鼠脾脏和淋巴结B细胞的分选及分析
获取血清抗体水平最高的小鼠的脾脏以及位于腘窝、腹股沟和肾脏的淋巴结,制备单细胞悬液。通过流式细胞术分选小鼠脾脏、淋巴结的浆细胞和GC B细胞作为抗体筛选候选细胞群,并分析脾脏、淋巴结的幼稚B细胞占比。使用跨膜激活剂及钙调亲环素配体相互作用因子[transmembrane activator and CAML(calcium-modulating cyclophilin ligand) interactor,TACI]和分化簇138(cluster of differentiation 138,CD138)作为浆细胞表面的标记分子,使用B220(B细胞表面相对分子质量为220 000的分子)作为B细胞表面的标记分子;其中,B细胞表面表达花生凝集素(peanut agglutinin,PNA)的为GC B细胞,不表达PNA的为幼稚B细胞。
1.2.3 鼠源抗体轻链基因文库的构建
分别裂解来自脾脏、淋巴结的浆细胞和GC B细胞(由“1.2.2”中获取),以构建4个不同的抗体轻链基因文库。行RNA抽提后经反转录获得cDNA,参考VON BOEHMER等[13]设计的鼠源轻链混合简并引物序列,并在其基础上添加载体同源臂序列以合成新的混合引物序列(具体序列信息见表1、2),通过两轮巢式PCR扩增轻链抗体V区基因序列,以构建来自不同B细胞群的鼠源抗体轻链基因文库。第一轮巢式PCR的反应条件为:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min(2个循环);94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min(6个循环);94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min(9个循环);72 ℃ 10 min。第二轮巢式PCR的反应条件为:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min(12个循环);94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min(23个循环);72 ℃ 10 min。
表 1 鼠源抗体轻链基因文库构建的第一轮巢式PCR的引物序列
Tab 1
| Primer | Sequence (5'→3') |
|---|---|
| 1mFK_Ⅰ | RGTGCAGATTTTCAGCTTCCTGCT |
| 1mFK_Ⅱ | TGGACATGAGGGCYCCTGCTCAGT |
| 1mFK_Ⅲ | CTSTGGTTGTCTGGTGTTGAYGGA |
| 1mFK_Ⅳ | GTTGCTGCTGCTGTGGCTTACA |
| 1mFK_Ⅴ | GTATCTGGTACCTGTGG |
| 1mFK_Ⅵ | TGCCTGTTAGGCTGTTGGTGCT |
| 1mFK_Ⅶ | GCTCAGTTCCTTGGTCTCCTGTTGC |
| 1mFK_Ⅷ | TGGGTGCTGCTGCTCTGGGT |
| 1mFK_Ⅸ | CAGTTCCTGTTTCTGTTARTGCTCTGG |
| 1mFK_Ⅹ | TGCTCTGGTTATATGGTGCTGATGGG |
| 1mFK_Ⅺ | GCTGTTTTGTATACCTGGG |
| 1mFK_Ⅻ | CTCAGCTCCTGTTGCTGTGGC |
| 1mFK_ | CCTCATATTTTTGCTGCTATGGG |
| 1mFK_ⅩⅣ | TGCTTTTCTGGATTTCAGCCTCCAG |
| 1mFK_ⅩⅤ | TCAACTTCTGCTCTTCCTGCTGTTC |
| 1mFK_ⅩⅥ | CTAGCTCYTCTCCTCAGYCTTCTTCTCCTC |
| 1mFK_ⅩⅦ | GTGTMTGGTGCTBRTGGG |
| 1mFK_ⅩⅧ | STGYTGHTGYTCTGG |
| 1mFK_ⅩⅨ | GGGTATCTGGTACCTGTGG |
| 1mRK | ACTGAGGCACCTCCAGATGTT |
| 1mFL_Ⅰ | ACTTATACTCTCTCTCCTGGCTCTC |
| 1mFL_Ⅱ | CTCTTCTTCTTCTTTGTTCTTCATTGCT |
| 1mRL | GTACCATYTGCCTTCCAGKCCACT |
表 2 鼠源抗体轻链基因文库构建的第二轮巢式PCR的引物序列
Tab 2
| Primer | Sequence (5'→3') |
|---|---|
| 2mFK_Ⅰ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGAAAWTGTGCTCACCCAGTC |
| 2mFK_Ⅱ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCCAAATTGTTCTCACCCAGTC |
| 2mFK_Ⅲ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCRACATTGTGCTGACCCAATC |
| 2mFK_Ⅳ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGAAACAACTGTGACCCAGTC |
| 2mFK_Ⅴ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGATATTGTGATGACSCAGGC |
| 2mFK_Ⅵ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCRRTRTTGTGATGACCCARAC |
| 2mFK_Ⅶ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGATATCCAGATGACACAGAC |
| 2mFK_Ⅷ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGACATTGTGATGACMCAGTC |
| 2mFK_Ⅸ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGACATCCAGATGACHCAGTC |
| 2mFK_Ⅹ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGACATCTTGCTGACTCAGTC |
| 2mFK_Ⅺ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCACACAGGCTGCACTCTCCAA |
| 2mFK_Ⅻ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCACTGGAGAAACAACACAGGC |
| 2mFK_ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGATGTCCAGATAACCCAG |
| 2mFK_ⅩⅣ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGACATCCTGATGACCCAATC |
| 2mFK_ⅩⅤ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCGATGTTGTGGTGACTCAAAC |
| 2mFK_ⅩⅥ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCAATATCCAGGTGATCCAG |
| 2mRK_Ⅰ | GATGAAGACAGATGGCGCCGCCACAGTTCGTTTCAGCTCCAGCTTGGTCCC |
| 2mRK_Ⅱ | GATGAAGACAGATGGCGCCGCCACAGTTCGTTTTATTTCCAGTCTGGTCCC |
| 2mRK_Ⅲ | GATGAAGACAGATGGCGCCGCCACAGTTCGTTTKATTTCCARCTTKGTSCC |
| 2mFL_Ⅰ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCTTACTCAGCCAAGCTCT |
| 2mFL_Ⅱ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCCAGGCTGTTGTGACTCAG |
| 2mFL_Ⅲ | CTGCTGCTCTGGTTCCCAGGTTCCAGATGCCAACYTGTGCTCACTCAG |
| 2mRL_Ⅰ | AGTGACCGTGGGGTTGGCCTTGGGCTGACCTAGGACAGTCAGTTTGGTTCC |
| 2mRL_Ⅱ | AGTGACCGTGGGGTTGGCCTTGGGCTGACCTAGGACAGTGACCTTGGTTCC |
1.2.4 嵌合抗体轻链表达质粒的构建及高亲和力人鼠嵌合抗体的筛选
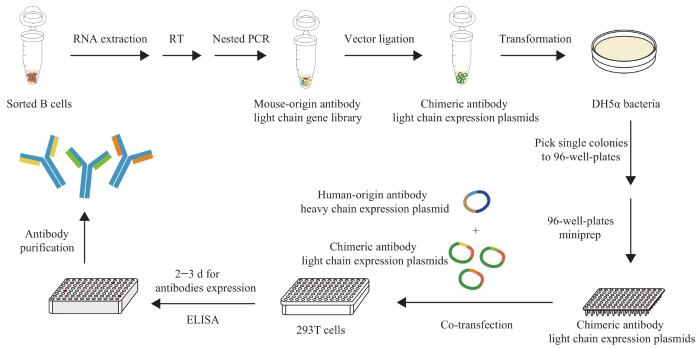
通过同源重组分别将4个鼠源抗体轻链基因文库与人源轻链表达载体相连接,构成完整的嵌合抗体轻链表达质粒,经DH5α细菌转化、单克隆挑选后纯化该质粒。分别将上述4个嵌合抗体轻链表达质粒与固定的人源抗体重链表达质粒共同转染至293T细胞,培养2~3 d后吸取细胞上清液作为嵌合抗体筛选样本。随后,以SARS-CoV-2 S-trimer蛋白为抗原,采用ELISA对人鼠嵌合抗体行初轮筛选,筛选条件为D(450 nm)>0.2。将此轮筛选得到的嵌合抗体依次以数字命名并进行纯化,采用ELISA行第2轮筛选。其中,以已发表的SARS-CoV-2的高亲和力抗体CR3022[8]作为阳性对照,以HIV的抗体VRC01[5]作为阴性对照,筛选出亲和力最高的人鼠嵌合抗体用于后续研究。上述构建及筛选流程如图2所示。
图 2
图 2
鼠源抗体轻链基因文库构建及高亲和力人鼠嵌合抗体筛选流程
Fig 2
Construction of mouse-origin antibody light chain gene library and screening workflow of high-affinity human-mouse chimeric antibody
1.2.5 轻链氨基酸变化位点分析
对筛选到的高亲和力人鼠嵌合抗体的表达质粒进行Sanger测序,获取轻链V、J基因序列信息。根据Igblast网站(
1.2.6 鼠源抗体轻链单个氨基酸位点改变抗体的构建及纯化
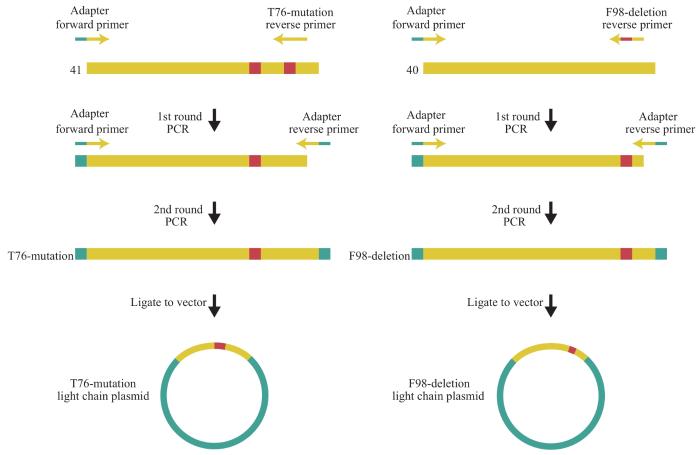
以“1.2.4”部分获得的具有最高亲和力的人鼠嵌合抗体为对象,仅保留其中1个氨基酸的变化,以构建鼠源抗体轻链单个氨基酸位点改变的抗体,经纯化后对该系列抗体开展关键位点的研究,具体步骤如下:①根据序列比对结果和鼠源胚系抗体基因序列,分别设计引物行PCR扩增(引物序列见表3),模板为筛选到的41号、40号抗体的轻链基因序列(其中40号抗体基因序列与鼠源胚系抗体基因序列相同),以得到拟构建的抗体轻链基因片段。②将基因片段连接到轻链表达载体上,构成完整的仅含1个氨基酸变化的抗体轻链表达质粒(图3)。③分别将上述一系列抗体轻链表达质粒与固定的人源抗体重链表达质粒共同转染至293S细胞进行抗体表达,并使用G蛋白亲和层析对其进行纯化。
表 3 鼠源抗体轻链单个氨基酸改变的质粒构建的引物序列
Tab 3
| Primer | Sequence (5 ́→3 ́) |
|---|---|
| Adapter forward primer | TTCCCAGGTTCCAGATGCCAGGCTGTTGTGACTCAG |
| F98-deletion reverse primer | TGACCTTGGTTCCTCCACCGAACACCCAATGGTTGCTGTA |
| T76-mutation reverse primer | CCTTGGTTCCTCCACCGAACACCCAGAAATGGTTGCTGTACCATAG |
| Adapter reverse primer | GGTTGGCCTTGGGCTGACCTAGGACAGTGACCTTGG |
图 3
图 3
鼠源抗体轻链单个氨基酸改变的质粒的构建
Fig 3
Construction of plasmids for mouse-origin antibody light chain with single amino acid change
1.2.7 不同抗体的亲和力以及中和能力检测
以前述步骤筛选到的具有最高亲和力的人鼠嵌合抗体(41号抗体)、轻链V区为鼠源胚系抗体基因编码的人鼠嵌合抗体(40号抗体)及构建的一系列轻链仅保留1个氨基酸变化的抗体为对象,分别采用ELISA(以SARS-CoV-2 S-trimer蛋白作为抗原)、假病毒中和实验对抗体与抗原的结合能力、各抗体的中和能力进行检测,其中以HIV的抗体VRC01[5]作为阴性对照。计算每种抗体的半数抑制浓度(half maximal inhibitory concentration,IC50),IC50越小表示其中和能力越强;当IC50<1 ng/μL为很强,1 ng/μL≤IC50<10 ng/μL为较强,10 ng/μL≤IC50<100 ng/μL为较弱,IC50>100 ng/μL为无中和能力。
2 结果
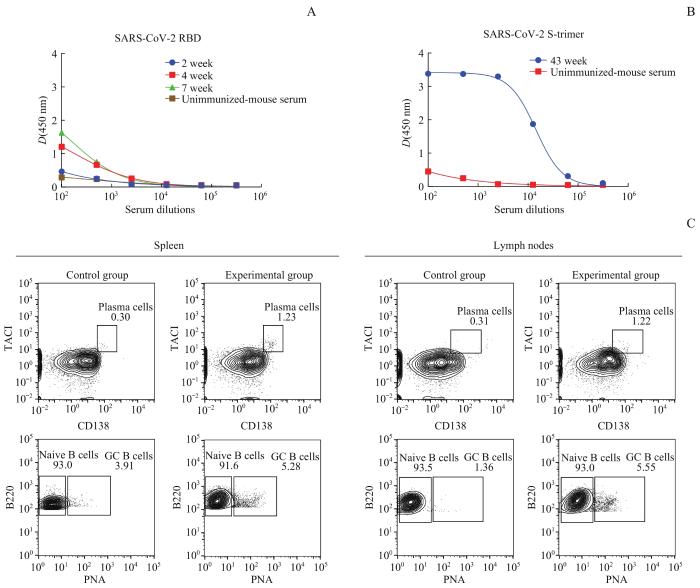
2.1 小鼠血清中抗体滴度以及各类B细胞比例变化
图 4
图 4
2组小鼠的血清抗体水平及各类B细胞水平分析
Note:A. Detection of serum antibody titer using ELISA with SARS-CoV-2 RBD antigen. B. Detection of serum antibody titer using ELISA with SARS-CoV-2 S-trimer antigen. C. Detection of the proportions of different types of B cells in the spleen and lymph nodes of the two groups by flow cytometry.
Fig 4
Analysis of serum antibody levels and different types of B cell levels in the two groups of mice
对第7次免疫1周后的小鼠的各B细胞群进行分析,结果(图4C)显示:与对照组相比,实验组小鼠的幼稚B细胞群的比例无变化,但浆细胞、GC B细胞的比例均有所增加;在脾脏和淋巴结中,实验组小鼠的浆细胞比例约是对照组的4倍,GC B细胞比例则分别是对照组的1.4倍和4.1倍。
2.2 高亲和力的人鼠嵌合抗体的筛选分析
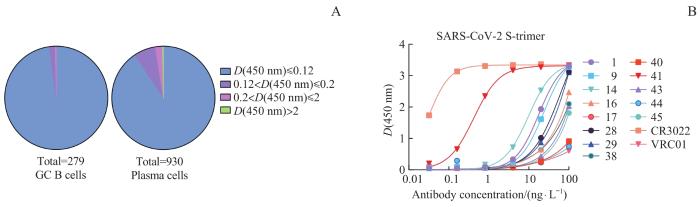
采用ELISA对构建的鼠源抗体轻链基因文库表达的嵌合抗体进行初轮筛选,结果(图5A)显示在由裂解自淋巴结的浆细胞、GC B细胞构建的抗体轻链基因文库表达组成的嵌合抗体中,所有抗体的D(450 nm)均小于0.12;而由裂解自脾脏的浆细胞、GC B细胞构建的抗体轻链基因文库表达组成的嵌合抗体中,仅少数抗体的D(450 nm)>0.2,其中1个来自GC B细胞、2个来自浆细胞的抗体轻链组成的嵌合抗体的D(450 nm)>2。随后,对所有D(450 nm)>0.2的嵌合抗体(部分抗体未成功纯化)行第2轮筛选,结果(图5B)显示大多数嵌合抗体的亲和力较低,其中来自脾脏GC B细胞文库的41号嵌合抗体具有最高的亲和力,同样来自该文库的40号嵌合抗体的亲和力较低,与阴性对照相近。
图 5
图 5
ELISA筛选人鼠嵌合抗体的亲和力
Note:A. First-round screening of human-mouse chimeric antibodies. B. Second-round screening of human-mouse chimeric antibodies.
Fig 5
Screening for affinity of human-mouse chimeric antibodies by ELISA
2.3 高亲和力人鼠嵌合抗体轻链的氨基酸位点改变分析及T76-mutation、F98-deletion嵌合抗体的纯化
对上述两轮筛选得到的抗体的轻链表达质粒进行Sanger测序并结合密码子表进行分析,结果(图6A)显示41号抗体、40号抗体的轻链均由鼠源V基因(IGLV1*01)和J基因(IGLJ1*01)编码;其中,40号抗体轻链的基因序列上不具有任何突变,而41号抗体轻链的基因序列上有1处突变和1处缺失,其氨基酸序列表现为FR3处第76位苏氨酸被异亮氨酸替换、CDR3处第98位苯丙氨酸发生缺失。通过比较40号抗体和41号抗体的轻链氨基酸序列并结合两轮筛选结果,我们发现鼠源轻链同时具有上述2个氨基酸改变或可使嵌合抗体亲和力升高。
图 6
图 6
高亲和力人鼠嵌合轻链上单个氨基酸位点的改变分析以及单个氨基酸改变的抗体的纯化
Note:A. Display of amino acid sequences of the screened chimeric antibodies and antibodies with single amino acid changes in light chains. B. SDS-PAGE results for chimeric antibodies purification.
Fig 6
Analysis of single amino acid site changes in the light chain of high-affinity human-mouse chimeric antibody and purification of antibodies with single amino acid changes
通过上述分析,我们分别构建了轻链单个氨基酸改变的质粒,并纯化了由该质粒表达的抗体;其中,将轻链上第76位苏氨酸被异亮氨酸替换的嵌合抗体命名为T76-mutation,将轻链上第98位苯丙氨酸缺失的嵌合抗体命名为F98-deletion。结果(图6B)显示该2个抗体均得以成功纯化。
2.4 单个氨基酸改变对高亲和力人鼠嵌合抗体的亲和力及中和能力的影响
分别采用ELISA、假病毒中和实验对40号抗体、41号抗体、T76-mutation和F98-deletion的亲和力、中和能力进行分析。ELISA结果(图7A)显示,41号抗体具有较强的结合能力,40号抗体、F98-deletion结合能力较弱,而T76-mutation的结合能力介于40号抗体和41号抗体之间。假病毒中和实验的结果(图7B)显示,在这4个抗体中,41号抗体具有很强的中和能力,IC50为0.995 ng/μL;T76-mutation的中和能力较强,IC50为1.724 ng/μL;40号抗体、F98-deletion的中和能力较弱,IC50分别为42.06 ng/μL和71.05 ng/μL。
图 7
图 7
单个氨基酸改变对高亲和力的人鼠嵌合抗体的亲和力及中和能力的影响
Note: A. Analysis of antibody binding affinity by ELISA. B. Analysis of antibody neutralizing ability by pseudovirus neutralization assay.
Fig 7
Effect of single amino acid changes on the affinity and neutralization ability of high-affinity human-mouse chimeric antibodies
结合上述2个实验的结果我们发现,在41号抗体轻链的2个氨基酸改变中,第76位苏氨酸替换为异亮氨酸这一单个氨基酸变化可提高嵌合抗体的亲和力及中和能力,第98位苯丙氨酸缺失的单个氨基酸变化对提高嵌合抗体的亲和力及中和能力的作用较小。
3 讨论
有研究提出抗体重链对于抗体轻链具有选择性,是决定B细胞克隆选择的关键[20-21],而有研究则提出某抗体的轻链是阻止疟原虫入侵的关键[22]。在针对SARS-CoV-2的抗体中,已有研究发现某些抗体重链上的突变具有关键作用[10-12],但抗体轻链对其中和能力有何影响,是否存在影响中和能力的关键突变,是值得探讨的问题。本研究筛选获得了一个针对SARS-CoV-2具有中和能力的人鼠嵌合抗体,发现仅需要抗体轻链FR3处的一个关键改变就可以使中和能力弱的抗体变成中和能力很强的抗体。既往研究认为,CDR的改变会直接影响抗体与抗原分子间的接触,从而决定抗体的亲和力和中和能力[23]。然而CDR的改变也可能增加抗体分子的热不稳定性,因此需要FR的相应改变以保持抗体分子的稳定性,使抗体具有更强的中和能力[24]。此外,抗体重链FR的改变可能通过依赖FR之间的同型相互作用的别构抑制等机制来增加抗体的亲和活性[9,25]。综合上述研究我们推测,本研究发现的位于抗体轻链FR3的关键氨基酸改变可能通过类似的机制,使完整的嵌合抗体分子更加稳定,从而增强了该嵌合抗体的亲和力和中和能力。
考虑到小鼠体内同时拥有重链和轻链突变的抗体可能具有更强的亲和力,本研究仅使用固定未突变的人源抗体重链基因与在体内积累SHM的鼠源轻链配对进行嵌合抗体筛选,而并未筛选在体内积累SHM的重链基因,但这可能导致筛选到的抗体并非小鼠体内具有最强中和能力的抗体。因此,若要筛选同时具有重链和轻链SHM的抗体,应使用如单细胞BCR测序、单个B细胞RT-PCR等技术,以获得来自同一个B细胞的具有SHM的抗体重链和轻链,从而达到筛选中和能力最强的嵌合抗体的目的。
综上,本研究筛选到了针对SARS-CoV-2具有中和能力的人鼠嵌合抗体,并发现了其轻链上存在1处对于该抗体中和能力具有决定作用的氨基酸位点改变,从而揭示了抗体轻链单个位点氨基酸改变对抗体中和能力同样具有关键作用。本研究的结果或将为抗体的优化提供一种的新思路。
AUTHOR's CONTRIBUTIONS
The study was designed by YEAP Lengsiew. The experiments operation and data analysis were done by YIN Zi, LIAN Chaoyang, GAO Bo and TIAN Ying. The manuscript was drafted and revised by YIN Zi, LIAN Chaoyang, HAO Qian and YEAP Lengsiew. All the authors have read the last version of paper and consented for submission.
作者贡献声明
叶菱秀设计了本研究,殷姿、廉朝阳、高波、田莹参与了实验操作和数据整理,殷姿、廉朝阳、郝茜、叶菱秀参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献