细胞自噬(autophagy)是一种高度保守的细胞内选择性降解机制,主要通过溶酶体途径降解和回收受损的细胞器或有害病原体,旨在维持细胞稳态[3]。该过程由多种蛋白调控。其中Bcl-2 相互作用蛋白(Bcl-2 interacting coiled-coil protein 1,Beclin-1)、微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)和p62是自噬的关键介质,被广泛用作监测和量化自噬活动的指标[4]。Beclin-1在自噬起始阶段发挥核心作用,诱导自噬发生。LC3则与吞噬受损物质的自噬体膜相关,在此阶段,LC3-Ⅰ转化为LC3-Ⅱ,与衔接蛋白p62结合,后者被自噬选择性降解[5]。自噬与多种生理、病理过程息息相关,早期的相关研究主要聚焦于肿瘤。后来,有研究[6]发现自噬在神经系统疾病中也扮演着重要角色。近年来,DNP患者中自噬流受损得到证实[7],因此,推测激活自噬对DNP有一定的治疗作用。
Kelch样ECH关联蛋白(Kelch-like ECH-associated protein 1,Keap1)/核因子E2相关因子(nuclear factor erythroid-derived-2-like 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)通路是一条经典的抗氧化应激通路,通过诱导细胞保护性基因的表达维持机体氧化还原平衡,并消除有毒有害物质的损伤作用。Keap1是Nrf2的负调控因子,静息状态下,Keap1基于Cullin3的E3泛素连接酶的衔接子亚基调节Nrf2活性,允许Nrf2在胞浆中积聚[8]。氧化应激发生时,Keap1构象改变,释放Nrf2入核与抗氧化原件(antioxidant responsive element,ARE)结合,诱导一系列细胞保护基因转录,抵抗氧化应激[9]。目前,关于Nrf2和神经病理性疼痛的研究并不多。LI等人[10]发现,使用Nrf2激动剂能够显著改善部分坐骨神经结扎导致的大鼠痛觉超敏。FRIAS等[11]的研究显示,Nrf2能够正向调节支气管上皮细胞中的自噬。此外,Nrf2激活的HO-1是一种微粒体酶,相较于Nrf2其他下游靶标具有更显著的细胞保护作用,能够缓解神经病理性疼痛,并被报道可以调控多种细胞的自噬[12]。因此,推测Keap1/Nrf2/HO-1通路对自噬的调控有至关重要的作用。
18 kDa转位分子蛋白(translocator protein,TSPO)是一种定位于线粒体外膜的、高度保守的疏水性蛋白,在甾体合成相关的组织中高度表达,其中就包括神经系统。TSPO作为一种应激蛋白,被视作神经炎症的标志物,与多种神经系统疾病密切相关[13]。既往研究[14]发现TSPO激动剂Ro5-4864能够缓解由脊神经结扎导致的神经病理性疼痛,其机制与它对脊髓背角中星形胶质细胞自噬的正向调节有关。因此,推测TSPO激动剂也能够通过调节自噬缓解DNP。另有研究[15]证明TSPO能够激活视网膜中的Keap1/Nrf2/HO-1通路。因而在假设Keap1/Nrf2/HO-1通路能够调节自噬的前提下,推测TSPO受体激动剂是经由Keap1/Nrf2/HO-1通路激活自噬来缓解DNP。本研究旨在观察DNP大鼠坐骨神经中Keap1/Nrf2/HO-1通路和自噬相关指标的变化规律,以及鞘内注射TSPO激动剂或Nrf2抑制剂后对其的影响。
1 材料与方法
1.1 实验动物及分组
本研究所用实验动物为雄性Sprague-Dawley大鼠,体质量为180 g±20 g,由上海交通大学医学院附属新华医院动物房提供。通过数字表将24只大鼠随机分配为4组,每组6只:假手术组[Sham组,正常饮食并腹腔注射柠檬酸钠缓冲液,鞘内注射20%二甲基亚砜(dimethyl sulfoxide,DMSO)]、DNP模型组(DNP组,高脂饮食并腹腔注射链脲佐菌素,鞘内注射20% DMSO)、TSPO激动剂Ro5-4864组(Ro组,高脂饮食并腹腔注射链脲佐菌素,鞘内注射Ro5-4864)、TSPO激动剂Ro5-4864合用Nrf2抑制剂ML385组(Ro+ML385组,高脂饮食并腹腔注射链脲佐菌素,鞘内注射Ro5-4864合用ML385)。
1.2 主要试剂
TSPO激动剂Ro5-4864[7-chloro-5-(4-chlorophenyl)-1-methyl-3H-1,4-benzodiazepin-2-one],Nrf2抑制剂ML385[N-(4-(2,3-dihydro-1-(2-methylbenzoyl)-1H-indol-5-yl)-5-methyl-2-thiazolyl)-1,3-benzodioxol-5-yl-acetamide],链脲佐菌素(streptozotocin,STZ)和DMSO均购买自美国Sigma-Aldrich公司。柠檬酸钠缓冲液购买自北京索莱宝科技有限公司。
此外,实验中所用抗体LC3 A/B(兔源)、p62(兔源)、Beclin-1(兔源)、Nrf2(兔源)、HO-1(兔源)均购买自美国Cell Signaling Technology公司,actin(兔源)和Lamin A/C则购买自武汉爱博泰克生物科技有限公司。
1.3 2型糖尿病模型的建立
为建立2型糖尿病(type 2 diabetes mellitus,T2DM)模型,对大鼠进行连续2周的高脂饮食喂养诱导胰岛素抵抗。而后,将STZ溶于0.1 mol/L pH=4.5的柠檬酸钠缓冲液中,浓度为1%,经腹腔以30 mg/kg的剂量注射给大鼠,连续给药2 d[16]。在此后的第3天,经心脏穿刺采血,使用大鼠胰岛素ELISA试剂盒(碧云天生物技术有限公司,PI606)检测空腹胰岛素水平,同时测量其空腹血糖水平,计算大鼠的胰岛素抵抗指数[homeostasis model assessment-insulin resistance,HOMA-IR;计算公式为HOMA-IR
1.4 行为学检测
50%机械缩足反射阈值(paw 50% mechanical withdrawal threshold,50% PMWT)测量:采用up-down法,测量时间点选取高脂饮食处理前(baseline),STZ后第3天(D3)、第7天(D7)、第14天(D14)、第21天(D21)和第28天(D28)。将大鼠放置于专用笼盒中,等待15 min左右,待大鼠适应陌生环境后,分别用不同的Von Fery hair作用于大鼠后足掌跖处,用力使Von Fery hair呈“S”或“C”型,持续6~8 s,出现快速抬足或舔足视为阳性,反之为阴性。根据预实验,Von Frey hair选用范围为0.40~26 g,根据CHAPLAN等[17]所描述的方法进行计算。50% PMWT较基值下降超20%的T2DM大鼠被认为DNP造模成功。
1.5 鞘内给药
2%戊巴比妥钠40 mg/kg经腹腔注射麻醉大鼠,取俯卧位,在大鼠腹下垫支撑物使椎间隙尽量舒展以便给药。平大鼠髂棘连线L5~L6间隙以10 μL微量进样器进行椎管穿刺,见大鼠甩尾为穿刺成功,注射后短暂停留保证药液充分进入后拔出。Ro组给予溶于20% DMSO的Ro5-4864 4 μg(剂量为10 μL/只),连续3 d;Ro+ML385组在给予Ro5-4864的同时合用20 μg ML385,同样溶于20% DMSO,剂量为10 μL/只,连续3 d。Sham组和DNP组仅给予同体积同浓度的DMSO。
1.6 免疫荧光
在第28天收集坐骨神经。大鼠麻醉后开胸经左心室先后灌注300 mL生理盐水和300 mL 4%多聚甲醛,取出坐骨神经后继续浸泡于多聚甲醛中进行后固定,而后在20%及30%蔗糖中梯度脱水,包埋于最佳切割温度复合物(optimal cutting temperature compound,OCT)包埋剂中。使用冰冻切片机将样本横向切成15 μm的薄片。经透膜、封闭后使用一抗LC3 A/B(φ=1∶200)和Nrf2(φ=1∶100)4 ℃孵育过夜。二抗避光室温孵育1 h后封片,使用荧光显微镜扫描拍片。
1.7 Western blotting检测
在第28天,麻醉及经左心室灌注300 mL生理盐水后收集坐骨神经。使用碧云天生物技术有限公司蛋白提取试剂盒(P0028)分别提取胞浆蛋白和胞核蛋白,定量后用于Western blotting。按20 μg/孔上样,根据分子量选用12.5%或7.5%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-poly-acrylamide gel electrophoresis,SDS-PAGE)分离目标蛋白后转膜,封闭后使用相应一抗4 ℃孵育过夜。p62、Beclin-1、LC3 A/B、Nrf2和HO-1按φ=1∶1 000进行稀释。经TBST冲洗后,辣根过氧化物酶标记二抗室温孵育1 h,actin和Lamin A/C按φ=1∶10 000进行稀释。再次TBST清洗后经ECL法显色曝光,Image J对结果进行分析。
1.8 统计学分析
采用SPSS 26.0软件进行分析。定量资料以x±s表示。对50% PMWT首先使用重复测量的方差分析进行分析,后进行多变量方差分析和Tukey检验,比较不同组别同一时间点的机械痛阈;对免疫荧光和Western blotting结果则进行单因素方差分析和Tukey检验。P<0.05表示差异有统计学意义。
2 结果
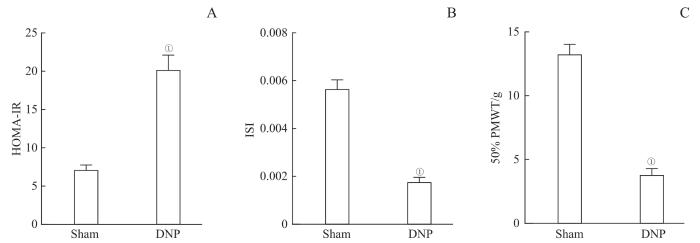
2.1 T2DM大鼠并发神经病理性疼痛
图1
图1
2型糖尿病大鼠并发神经病理性疼痛 (n=6)
Note:A/B. The levels of HOMA-IR (A) and ISI (B) of the Sham group and the DNP group 3 d after STZ injection. C. 50% PMWT of the Sham group and the DNP group 3 d after STZ injection. ①P=0.000, compared with the Sham group.
Fig 1
T2DM rats showed pain hypersensitivity (n=6)
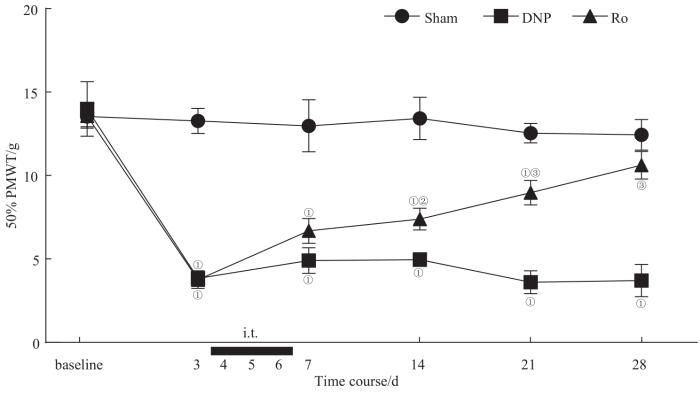
2.2 鞘内注射TSPO激动剂Ro5-4864对DNP大鼠机械痛阈的影响
如图2所示,DNP组在整个实验观察周期中(DNP造模后第3~28天),其50% PMWT较Sham组明显降低(均P=0.000),且无改善趋势。Ro组在STZ后第4天经鞘内注射4 μg/只Ro5-4864,连续3 d,自第7天开始50% PMWT明显改善,随时间作用愈发明显,与DNP组相比差异具有统计学意义(第14天,P=0.039;第21、28天,均P=0.000)。
图2
图2
鞘内注射TSPO激动剂Ro5-4864对DNP大鼠50% PMWT的影响 (n=6)
Note:①P=0.000, compared with the Sham group; ②P=0.039, ③P=0.000, compared with the DNP group.
Fig 2
Effects of TSPO agonist Ro5-4864 on the 50% PMWT in DNP rats (n=6)
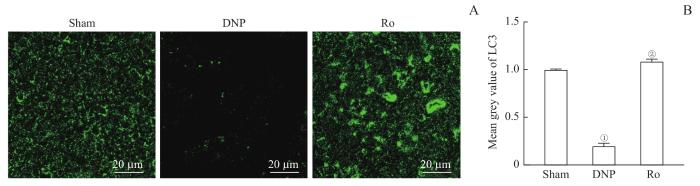
2.3 鞘内注射TSPO激动剂Ro5-4864对DNP大鼠坐骨神经自噬相关蛋白的影响
为观察坐骨神经中LC3荧光强度的变化,采用了免疫荧光检测方法。结果如图3所示,DNP组中LC3荧光信号较Sham组明显减弱(P=0.000),约为Sham组的19.9%。Ro组给予Ro5-4864后,坐骨神经中LC3信号增强(P=0.000),提升至Sham组的108.7%。
图3
图3
鞘内注射TSPO激动剂Ro5-4864对DNP大鼠坐骨神经中LC3表达变化的影响 (n=3)
Note: A. Representative immunofluorescent pictures of single staining of LC3 in the sciatic nerves of the rats. B. Quantitative analysis of LC3 signal intensity. ①P=0.000, compared with the Sham group; ②P=0.000, compared with the DNP group.
Fig 3
Effects of TSPO agonist Ro5-4864 on the change of LC3 expression in the sciatic nerves of DNP rats (n=3)
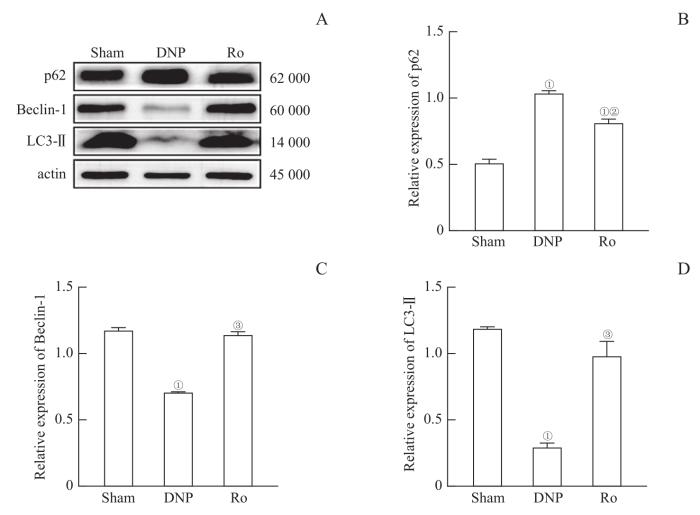
如图4所示,坐骨神经样本Western blotting检测显示,与Sham组相比,DNP组中Beclin-1和LC3-Ⅱ蛋白含量显著降低(均P=0.000),p62蛋白则显著增加(P=0.000)。鞘内注射Ro5-4864后,Beclin-1和LC3-Ⅱ蛋白含量增加(均P=0.000),p62蛋白含量降低(P=0.001)。
图4
图4
鞘内注射TSPO激动剂Ro5-4864改善DNP大鼠坐骨神经中自噬相关蛋白表达的变化 (n=3)
Note:A. Representative immunoblots of p62, Beclin-1 and LC3-II in the sciatic nerves of the rats. B‒D. Illustration of the relative expression of p62 (B), Beclin-1 (C), and LC3-Ⅱ (D). ①P=0.000, compared with the Sham group; ②P=0.001, ③P=0.000, compared with the DNP group.
Fig 4
TSPO agonist Ro5-4864 improved the changes in the expression of autophagy-related proteins in the sciatic nerves of DNP rats (n=3)
2.4 鞘内注射TSPO激动剂Ro5-4864对DNP大鼠坐骨神经Keap1/Nrf2/HO-1信号通路的影响
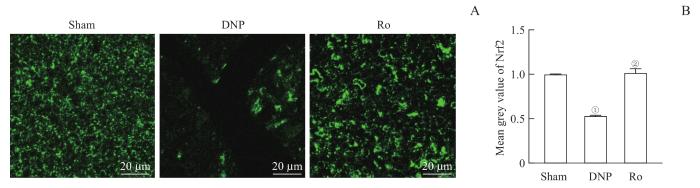
为观察Nrf2荧光信号的变化,再次对坐骨神经进行免疫荧光检测,结果如图5所示。DNP大鼠坐骨神经中Nrf2荧光强度明显减弱(P=0.000),约为Sham组的53.2%。而给予Ro5-4864后被改善(P=0.000),增加至Sham组的101.6%。
图5
图5
鞘内注射TSPO激动剂Ro5-4864改善DNP大鼠坐骨神经Nrf2表达的降低 (n=3)
Note:A. Representative immunofluorescent pictures of single staining of Nrf2 in the sciatic nerves of the rats. B. Quantitative analysis of Nrf2 signal intensity. ①P=0.000, compared with the Sham group; ②P=0.000 compared with the DNP group.
Fig 5
TSPO agonist Ro5-4864 blocked the decrease in the expression of Nrf2 in the sciatic nerves of DNP rats (n=3)
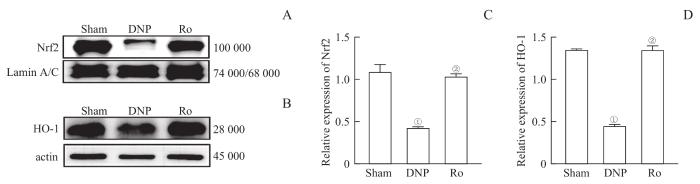
Western blotting结果如图6所示,DNP组的坐骨神经中HO-1和核Nrf2蛋白表达水平显著低于Sham组(均P=0.000)。这一变化在Ro组被逆转(均P=0.000)。
图6
图6
鞘内注射TSPO激动剂Ro5-4864对DNP大鼠坐骨神经中Keap1/Nrf2/HO-1通路相关蛋白表达的影响 (n=3)
Note:A/B. Representative immunoblots of nuclear Nrf2 (A) and HO-1 (B). C/D. Illustration of the relative expression of nuclear Nrf2 (C) and HO-1 (D). ①P=0.000, compared with the Sham group; ②P=0.000, compared with the DNP group.
Fig 6
Effects of TSPO agonist Ro5-4864 on the expression of Keap1/Nrf2/HO-1 signaling-related proteins in the sciatic nerves of DNP rats (n=3)
2.5 合用Nrf2抑制剂ML385对TSPO激动剂Ro5-4864作用的影响
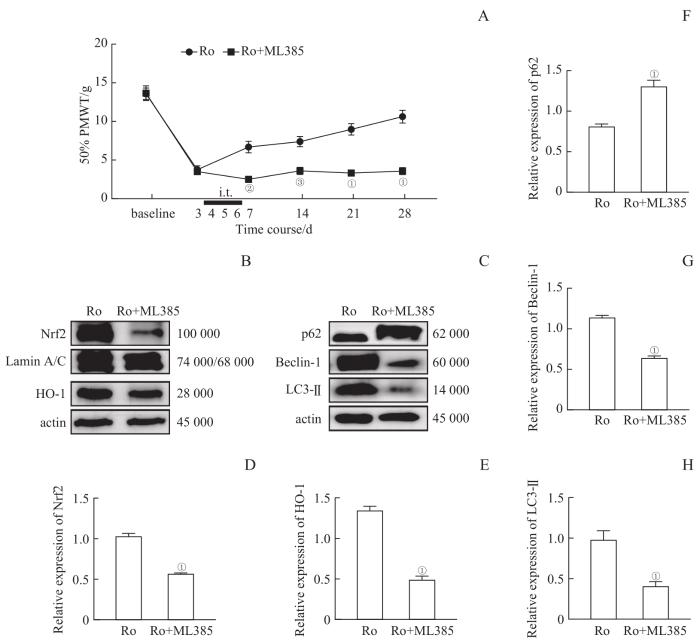
为了探讨Keap1/Nrf2/HO-1通路在Ro5-4864激活自噬中的作用,对Ro组和Ro+ML385组的大鼠进行行为评估。结果显示,合用ML385后,该组大鼠的50% PMWT始终维持在低水平,各时间点上与Ro组的差异都具有统计学意义(第7天,P=0.006;第14天,P=0.003;第21、28天,均P=0.000;图7A)。
图7
图7
Nrf2抑制剂ML385对TSPO激动剂Ro5-4864作用的影响
Note:A. Effects of Nrf2 inhibitor ML385 on the 50% PMWT of the rats (n=6). B. Representative immunoblots of nuclear Nrf2 and HO-1 in the sciatic nerves (n=3). C. Representative immunoblots of p62, Beclin-1 and LC3-Ⅱ (n=3). D/E. Illustration of the relative expression of nuclear Nrf2 (D) and HO-1 (E). F‒H. Illustration of the relative expression of p62 (F), Beclin-1 (G), LC3-Ⅱ (H). ①P=0.000, ②P=0.006, ③P=0.003, compared with the Ro group.
Fig 7
Effects of Nrf2 inhibitor ML385 on the changes induced by TSPO agonist Ro5-4864 in DNP rats
Western blotting结果显示,与Ro组相比,Ro+ML385组中核Nrf2和浆HO-1、Beclin-1、LC3-Ⅱ的蛋白含量均降低,p62蛋白含量再次大幅增加(均P=0.000,图7B~H)。
3 讨论
本研究发现2型糖尿病发生时,大鼠出现神经病理性疼痛,即糖尿病神经病理性疼痛,同时坐骨神经中自噬和Keap1/Nrf2/HO-1通路受损。鞘内注射TSPO激动剂Ro5-4864后,DNP大鼠的痛觉过敏得到缓解,这归功于它对自噬的激活,其中的机制可能与TSPO对Keap1/Nrf2/HO-1通路的正向调节有关。因此,为了探讨Keap1/Nrf2/HO-1通路在这其中扮演的角色,Nrf2抑制剂ML385被使用,结果显示在Keap1/Nrf2/HO-1通路被阻断后,Ro5-4864对自噬的激活作用消失,行为学上对大鼠痛觉过敏的缓解作用也被抵消。
TSPO作为最广为人知的神经炎症标记物,其作用多种多样,包括调节类固醇生成、线粒体生物发生、细胞增殖和凋亡、卟啉合成和免疫调节等[18]。有研究指出TSPO的激活是机体面对应激状态的一种内源性补偿机制,但通常情况下活化不足,因此外源性增强TSPO活性可以强化机体自身的抗伤害补偿机制[19]。比如,BLOMS-FUNKE等[20]认为激活TSPO能够缓解糖尿病导致的机械性痛觉超敏,并且能够抑制疼痛的慢性化。本课题组的既往研究[19]也证实使用TSPO激动剂能够缓解脊神经结扎导致的神经病理性疼痛。在本研究中,同样发现鞘内注射TSPO激动剂Ro5-4864能够缓解DNP,但这其中的机制仍需进一步研究。MARINELLI等[21]的研究指出,使用自噬激动剂雷帕霉素(Rapamycin,RAPA)能够缓解坐骨神经缩窄造成的神经病理性疼痛。基于此,本研究假设Ro5-4864对DNP的缓解作用是由于它对自噬的激活。因此,本研究使用免疫荧光和Western blotting检测自噬相关蛋白Beclin-1、LC3-Ⅱ和p62的表达情况,结果显示:DNP大鼠坐骨神经中Beclin-1和LC3-Ⅱ表达降低,p62表达增加,这表明DNP发生时,大鼠坐骨神经中自噬受损。鞘内注射Ro5-4864后的DNP大鼠坐骨神经中Beclin-1、LC3-Ⅱ表达增加,p62减少,这说明受损的自噬被激活,自噬过程流畅。免疫荧光结果也充分印证了这一点。以上结果与本研究的预想一致,简言之,TSPO通过激活坐骨神经中的自噬缓解了DNP。
Keap1/Nrf2/HO-1通路是一条经典的内源性保护机制。既往研究表明,在坐骨神经缩窄模型中,可以观察到坐骨神经的Nrf2信号减弱[22],Nrf2信号通路对神经保护至关重要[23]。本研究发现,DNP大鼠坐骨神经中HO-1和核Nrf2蛋白表达降低,说明该通路被抑制。而鞘内注射Ro5-4864后这种损伤被逆转,可见2种蛋白表达水平的显著提升。这表明Keap1/Nrf2/HO-1通路在TSPO缓解DNP中也扮演了重要角色。为了探明Keap1/Nrf2/HO-1通路的具体作用,本研究使用了Nrf2抑制剂ML385。结果显示,合用ML385后,HO-1和核Nrf2的表达水平重新回到低水平,同时自噬相关蛋白Beclin-1和LC3-Ⅱ蛋白水平也被抑制,p62含量重新增加,大鼠的50% PMWT也降低至DNP水平。这表明在Keap1/Nrf2/HO-1通路被抑制的情况下,Ro5-4864对DNP的缓解作用和对自噬的激动作用都无法实现。换言之,TSPO激动剂Ro5-4864是通过Keap1/Nrf2/HO-1通路调节自噬而发挥缓解DNP作用的。
本研究仍有一些不足:研究中采用了鞘内给药方式,却使用坐骨神经作为研究样本,因而无法说明TSPO激动剂Ro5-4864是通过中枢还是外周神经系统发挥作用的,这需要使用外周给药方式进行验证。
综上所述,本研究证实了给予DNP大鼠TSPO激动剂Ro5-4864能够缓解痛觉过敏,这归功于Ro5-4864通过激活Keap1/Nrf2/HO-1通路对自噬的正向调节。事实上,TSPO在临床上已然展现出了多方面的作用,比如作为示踪剂通过PET-CT检测神经系统,成为神经系统疾病诊断和治疗的依据[13]。本研究希望为DNP的治疗提供新的思路。
作者贡献声明
高楠和郝璨负责实验设计与结果收集,马冰洁和靳天负责结果分析,马柯和刘晓明负责论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
Both the study designation and the results collection were completed by GAO Nan and HAO Gem, MA Bingjie and JIN Tian performed the data analyses, and MA Ke and LIU Xiaoming were in charge of drafting and revising. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献