国内外的哮喘指南和专家共识将“依从性好且吸入技术正确,经优化的高剂量吸入糖皮质激素(inhaled corticosteroid,ICS)+长效β2受体激动剂(long-acting β2-agonist,LABA)治疗后仍未控制,或需要高剂量ICS/LABA才能维持控制者”称为重症哮喘(severe asthma,SA)患者,将“经过第1级、第2级治疗能达到完全控制者”称为轻度哮喘患者,“经过第3级治疗能达到完全控制者”称为中度哮喘患者[4]。重症哮喘患者虽只占哮喘总人数的5%~10%,但其疾病恶化风险更高,急诊就医率和住院率是轻度、中度哮喘患者的15~20倍,且具体机制尚未明确[5-6]。
微塑料是指粒径小于5 mm的塑料颗粒,其中粒径小于100 nm的称为纳米塑料(nanoplastics,NPs)。微塑料作为细颗粒物(particulate matter 2.5,PM2.5)的组成成分之一,在空气中广泛存在。西班牙的一项研究[7]发现,在大气收集的PM10和PM2.5中分别检测到了2.09 ng/m3和1.81 ng/m3的聚苯乙烯微塑料(polystyrene microplastics)。在兰州、西安、北京、长春、武汉、成都、上海、广州8个城市的道路扬尘PM2.5中均检测出不同浓度的微塑料存在[8]。微塑料可通过气道吸入,在人体肺组织中沉积[9],并与肺功能下降、间质性肺炎、肺癌、支气管炎等多种呼吸系统疾病的发生密切相关,但微塑料尤其是NPs暴露对重症哮喘患者的潜在危害及其作用机制尚不明晰。因此,本研究拟通过构建重症哮喘小鼠模型,探讨NPs对重症哮喘发生发展的影响及可能机制,以期为评估NPs暴露的潜在环境风险及制定儿童哮喘防治策略提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源
肺泡Ⅱ型上皮细胞(alveolar type Ⅱ epithelial cells,AT2 cells)MLE-12细胞系,从复旦大学生物医学研究院(Institutes of Biomedical Sciences,IBS)细胞资源中心(Fudan IBS Cell Center,FDCC)获得,并严格遵循FDCC给出的培养条件和指导方针。使用MLE-12完全培养基,细胞培养箱条件为37 ℃、5%CO2,并保持湿润。
1.1.2 实验动物
SPF级C57BL/6雌性小鼠,6~8周龄,购自上海斯莱克公司,实验动物生产许可证号为SCXK(沪)2022-0004,使用许可证号为SYXK(沪)2022-0012。饲养于复旦大学附属儿科医院SPF级动物房,环境温度22 ℃,光照12 h/黑暗12 h,无噪声。饲以标准饲料,自由摄食和饮水。
1.1.3 主要试剂及仪器
屋尘螨(house dust mite,HDM)提取物(GREER Labora,美国),脂多糖(lipopolysaccharide,LPS)(Invitrogen,美国)。地塞米松(dexamethasone,DEX)、荧光蓝胺改性聚苯乙烯乳胶微球L0780(Sigma-Aldrich,美国)。荧光标记抗磷酸化γ-H2A.X抗体、抗p53抗体、抗Chk1抗体(Abcam,美国)。抗磷酸化Chk1抗体、抗磷酸化p53抗体(CST,美国)。抗GAPDH兔多克隆抗体(Sangon Biotech,中国),抗ATR多克隆抗体(武汉三鹰生物技术有限公司,中国)。别藻蓝蛋白(APC)荧光抗Ly-6G/Ly-6C抗体、PerCP-Cy5.5荧光抗CD3ε单克隆抗体(Invitrogen,美国)。异硫氰酸荧光素(FITC)荧光抗CD107b抗体、藻红蛋白(PE)荧光抗CD170抗体、PerCP-Cy5.5荧光抗CD19抗体(BioLegend,美国)。抗Ly-6G抗体(Signalway Antibody,美国),抗表面活性物质相关蛋白C(surfactant-associated protein C,SFTPC)多克隆抗体(武汉三鹰生物技术有限公司,中国)。苏木精-伊红(hematoxylin-eosin,H-E)染色试剂盒、过碘酸希夫(periodic acid-Schiff,PAS)染色试剂盒(武汉博士德,中国)。CCK-8细胞计数试剂盒(Dojindo,日本)。荧光素异硫氰酸酯/膜联蛋白Ⅴ凋亡检测试剂盒(BD,美国)。Ceralasertib(Selleck,美国)。胎牛血清(fetal bovine serum,FBS)(Gibco,美国)。MLE-12培养基(上海富衡,中国)。SYBR® PrimeScript™反转录试剂盒、SYBR® Green PCR试剂盒(TaKaRa,日本),RNA引物[生工生物工程(上海)股份有限公司]。7500实时荧光定量PCR系统,FACS Calibur流式细胞仪(BD,美国)。台式高速低温离心机(Eppendorf,德国),台式高速冷冻离心机(卢湘仪离心机仪器,中国),相差倒置生物显微镜(Leica,德国)。
1.2 实验方法
1.2.1 动物模型构建
(1)重症哮喘小鼠模型构建
参考既往文献[10-12],使用HDM和LPS建立重症哮喘小鼠模型,以1×磷酸盐缓冲液(phosphate buffered saline,PBS)作为对照。将C57BL/6小鼠随机分为4组,每组5只:空白对照组(PBS/PBS/PBS)、轻度中度哮喘组(HDM/PBS/PBS)、重症哮喘组(HDM/LPS/PBS)及重症哮喘地塞米松治疗组(HDM/LPS/DEX)。实验第1~3日,轻度中度哮喘组、重症哮喘组及地塞米松治疗组小鼠每日气道滴注50 μL的HDM溶液(1 mg/mL)致敏,空白对照组通过相同方式给予同体积PBS;第14~17日,上述3组每日气道滴注50 μL的HDM溶液(0.1 mg/mL)激发,空白对照组给予PBS;第19、20、22日,重症哮喘组及地塞米松治疗组小鼠每日气道滴注50 μL的LPS(5 μg/mL),轻度中度哮喘组及空白对照组小鼠给予等体积PBS处理,间隔6 h后,予重症哮喘地塞米松治疗组小鼠腹腔注射100 μL地塞米松溶液(125 μg/mL),其余组小鼠腹腔注射同体积PBS。若重症哮喘组小鼠的气道炎症显著强于轻度中度哮喘组,且地塞米松治疗组结果显示该组小鼠的气道炎症不能被地塞米松抑制则认为模型构建成功。
(2)暴露于聚苯乙烯纳米塑料的重症哮喘小鼠模型构建及分组
使用粒径50 nm的荧光蓝胺改性聚苯乙烯乳胶微球作为聚苯乙烯纳米塑料(polystyrene nanoplastics,PS-NPs)单体进行后续实验。在重症哮喘模型基础上,通过气道滴注的方式构建暴露于PS-NPs的重症哮喘小鼠模型。将小鼠随机分为4组,每组5只:空白对照组(PBS/PBS/PBS)、PS-NPs组(PBS/PBS/PS-NPs)、重症哮喘组(HDM/LPS/PBS)及重症哮喘+PS-NPs组(HDM/LPS/PS-NPs)。实验第1~3日和第14~17日,PS-NPs组及重症哮喘+PS-NPs组小鼠首先每日气道滴注50 μL PS-NPs(1 μg/μL),至少间隔6 h后再次滴注HDM;空白对照组及重症哮喘组小鼠不滴注PS-NPs而以同样方式给予同体积的PBS,至少间隔6 h后再次滴注HDM。第19、20、22日,重症哮喘+PS-NPs组及重症哮喘组小鼠每日气道滴注50 μL的LPS(5 μg/mL),PS-NPs组及空白对照组小鼠气道滴注同体积的PBS处理,HDM剂量同“1.2.1(1)”。
1.2.2 支气管肺泡灌洗液炎症细胞分类计数
模型构建后,予所有实验小鼠气管插管并注入4 ℃ 0.8 mL无菌PBS,回抽支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)约0.5 mL,重复1次,共收集BALF约1 mL。使用1 mL FACS buffer重悬细胞沉淀,取50 μL用于计数,剩余BALF离心,弃上清液,取细胞沉淀。加入100 μL按比例混合的PE荧光抗CD170抗体(1∶200)、FITC荧光抗CD107b抗体(1∶200)、PerCP-Cy5.5荧光抗CD19抗体(1∶250)、PerCP-Cy5.5荧光抗CD3ε单克隆抗体(1∶100)和APC荧光抗Ly-6G抗体(1∶200),4 ℃避光孵育40 min。加入1 mL FACS buffer洗涤后固定,进行流式细胞术检测。
1.2.3 肺组织切片染色
模型构建后,分离所有实验小鼠左肺,4%多聚甲醛固定后,经常规脱水、透明,石蜡包埋切片、烘干。
(1)H-E染色
取肺组织切片,脱蜡、水化、抗原修复、洗涤后行H-E染色,评估气道炎症严重程度。炎症分级如下:0级(气管周围正常、无炎症细胞浸润),1级(仅有少量炎症细胞浸润),2级(气管周围一圈一层细胞厚的炎症细胞环),3级(2~4层细胞厚的炎症细胞环),4级(大多数支气管或血管被4层细胞厚的炎症细胞环包围)。
(2)PAS染色
取肺组织切片,脱蜡、水化等步骤同前。行PAS染色,评估气道黏液分泌情况。根据5级制评分系统(0~4分)对病理变化进行量化:0分(PAS阳性细胞<5%),1分(PAS阳性细胞5%~25%),2分(PAS阳性细胞26%~50%),3分(PAS阳性细胞51%~75%)和4分(PAS阳性细胞>75%)。
(3)免疫组织化学染色
取肺组织切片,脱蜡、洗涤等步骤同前。将玻片置于30 mg/mL H2O2溶液中,室温避光25 min以阻断内源性过氧化物酶,洗涤。3%牛血清白蛋白(bovine serum albumin,BSA)溶液室温封闭30 min,甩掉封闭液后滴加PBS稀释的Ki67一抗(1∶500),4 ℃孵育过夜;PBS洗涤3次,在切片上滴加相应的二抗(1∶2 000),室温避光孵育1 h;PBS洗涤3次,滴加现配的二氨基联苯胺(diaminobenzidine,DAB)辣根过氧化物酶显色液,1 min后洗涤切片并复染细胞核,脱水封片、晾干后,中性树胶封片。
每组小鼠随机选5个样本,每张切片随机选取不重叠的3个视野观察肺组织病理改变。采用图像处理软件ImageJ计算切片视野内的所有肺泡数(单位:个/mm2)和肺泡平均面积(单位:μm2)。
(4)脱氧核糖核苷酸末端转移酶介导的缺口末端标记法染色
取肺组织切片,脱蜡、洗涤等操作同前。甩干切片,在组织周围滴加100 μL稀释的蛋白酶K工作液(200 μg/mL),37 ℃温箱孵育22 min,洗涤3次后滴加50 μL脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal dexynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)检测液,37 ºC避光孵育60 min,洗涤3次;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)复染,洗涤3次;抗荧光淬灭封片液封片后荧光显微镜下观察。
(5)酪胺信号放大多重荧光染色
取肺组织切片,脱蜡、抗原修复等操作同前;加一抗抗SFTPC多克隆抗体(1∶1 000),加相应的二抗孵育,洗涤。第一次荧光染色:去除洗液,向组织上滴加适量1×酪胺信号放大(Tyramide signal amplification,TSA)染料工作液(1∶100 ddH2O稀释),室温避光孵育10 min,洗涤3次;微波加热,室温冷却,洗涤3次;重新封闭,加一抗(抗p53抗体,1∶500;抗ATR多克隆抗体,1∶500)、加二抗孵育,洗涤。第二次荧光染色,操作同第一次荧光染色直至室温冷却洗涤,清洗结束DAPI染核及封片。
1.2.4 细胞免疫荧光染色
使用免疫荧光法标记细胞吞噬PS-NPs后的DNA损伤。从Sigma-Aldrich定制包埋有Alexa Fluor 488的50 nm胺修饰聚苯乙烯乳胶珠。将1×104个MLE-12细胞接种到预先放置有爬片的24孔板中,PS-NPs刺激12 h后,PBS浸洗3次,每次5 min;室温静置固定15 min,PBS浸洗3次。随后滴加适量0.1% Triton通透10 min后,PBS浸洗10 min,重复3次。将FBS以3%浓度稀释于0.1% Triton中制备3% FBST,3% FBST室温静置封闭1 h后加入荧光标记抗磷酸化γ-H2A.X抗体(1∶200),4 ℃孵育过夜。次日,PBST漂洗细胞爬片3次,每次5 min。DAPI复染细胞后,滴加适量荧光抗淬灭剂并封片。将载玻片置于共聚焦显微镜下观察各组细胞吞噬PS-NPs情况及各组DNA损伤差异。
1.2.5 CCK-8实验检测细胞增殖
(1)PS-NPs抑制AT2细胞增殖
将MLE-12细胞接种于96孔板中,密度5×103个/孔,并划分为对照组和实验组(PS-NPs组)。隔日细胞贴壁后,实验组更换为含0、5、10、20、40 μg/mL不同浓度PS-NPs的培养基,对照组更换为不含PS-NPs的培养基。分别于0、24、48 h,将对应96孔板更换含10% CCK-8试剂的培养基,置于细胞培养箱避光孵育2 h,于450 nm处酶标仪检测吸光度。
(2)ATR抑制剂对PS-NPs抑制细胞增殖的恢复作用
将分装有5 mg Ceralasertib粉末的2 mL微型离心管以4 ℃ 1 500×g离心5 min,随后每管中加入121.2 μL二甲基亚砜(DMSO)吹打振荡至完全溶解,得到100 mmol/L Ceralasertib溶液,置于-20 ℃冰箱储存。准备好接种有MLE-12细胞的96孔板,方法同“1.2.5(1)”,分为空白对照组、PS-NPs组、iATR组和PS-NPs+iATR组,隔日贴壁;在CCK-8实验前预解冻100 mmol/L Ceralasertib溶液。分别制备含有0.1 μmol/L Ceralasertib的培养基,及不含Ceralasertib但含有同等浓度DMSO的培养基;PS-NPs+iATR组及iATR组在PS-NPs暴露前,在含有0.1 μmol/L Ceralasertib的培养基中预处理2 h,其他组给予含有同等浓度DMSO的培养基作为对照;2 h后,PS-NPs+iATR组及PS-NPs组更换为含20 μg/mL PS-NPs的培养基,空白对照组、iATR组更换为不含PS-NPs的培养基,后续CCK-8孵育、检测同“1.2.5(1)”。
1.2.6 Annexin Ⅴ-FITC/PI双染色流式细胞术检测细胞凋亡
(1)PS-NPs诱导AT2细胞凋亡
将MLE-12细胞接种于12孔板上,密度1×105个/孔,并划分为对照组和实验组(PS-NPs组)。隔日使用含有10 μg/mL PS-NPs和200 μmol/L H2O2的培养基处理实验组细胞,用只含200 μmol/L H2O2的培养基处理对照组细胞。12 h后,使用无乙二胺四乙酸(EDTA)胰酶消化制备单细胞悬液,1 500×g离心3 min,弃上清液。4 ℃预冷PBS洗涤细胞后,再次离心弃上清液,随后加入500 μL的1×binding buffer重悬细胞,再分别加5 μL的Annexin Ⅴ-FITC和碘化丙啶(propidium iodide,PI)染液混匀,室温、避光条件下孵育15 min。30 min内进行流式细胞术检测。
(2)ATR抑制剂对PS-NPs诱导细胞凋亡的恢复作用
准备好接种有MLE-12细胞的12孔板,方法同“1.2.6(1)”,分为空白对照组、PS-NPs组和iATR+PS-NPs组,隔日贴壁;将“1.2.5(2)”中制备的100 mmol/L Ceralasertib预解冻;分别制备含有0.3 μmol/L Ceralasertib的培养基,及不含Ceralasertib但含有同等浓度DMSO的培养基;将PS-NPs+iATR组在PS-NPs暴露前,在含有0.3 μmol/L Ceralasertib的培养基中预处理2 h,其他组给予含有同等浓度DMSO的培养基作为对照;2 h后,PS-NPs+iATR组及PS-NPs组更换为含10 μg/mL PS-NPs的培养基,空白对照组、iATR组更换为不含PS-NPs的培养基,处理12 h,后续消化、染色、检测等操作同“1.2.6(1)”。
1.2.7 实时荧光定量聚合酶链反应
将MLE-12细胞接种于24孔板上,密度2×104个/孔,并划分为对照组和实验组(PS-NPs组)。隔日使用含有15 μg/mL PS-NPs的培养基处理实验组细胞,用不含PS-NPs的培养基处理对照组细胞。12 h后,Trizol试剂提取总RNA,并按照反转录试剂盒说明书将其反转录为cDNA。引物序列见表1。根据说明书使用SYBR® Green PCR试剂盒进行实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,qPCR)。按照每个样本2个复孔,每孔5 μL,将反应体系加至384孔板上,在7500实时荧光定量PCR系统中进行定量检测。设置如下反应程序:95 ℃ 0 s(20 ℃/1 s)→65 ℃ 15 s(20 ℃/1 s)→95 ℃ 0 s(20 ℃/1 s),循环数为40次。以β-actin为内参,采用
表1 qPCR引物序列
Tab 1
1.2.8 Western blotting检测蛋白表达
将MLE-12细胞接种于6孔板上,密度5×105个/孔,并划分为对照组和实验组(PS-NPs组)。隔日使用含有15 μg/mL PS-NPs的培养基处理实验组细胞,用不含PS-NPs的培养基处理对照组细胞。24 h后弃去培养基,PBS洗涤后,加入70 μL RIPA裂解液,4 ℃裂解15 min后离心,吸取上清液,并使用BCA蛋白试剂盒定量,加入SDS-PAGE蛋白上样缓冲液,95 ℃金属浴中加热5 min。经12% SDS-PAGE凝胶电泳、半干法转PVDF膜、5% BSA封闭,洗膜,加入对应一抗(工作浓度1∶1 000),4 ℃孵育过夜,加入1∶2 000稀释的HRP标记的二抗,室温孵育2 h,滴加ECL显影液,曝光显影。采用ImageJ软件进行灰度分析。
1.3 统计学分析
采用GraphPad Prism 9.0软件进行统计分析。每个结果来自3次独立的重复实验。数据采用x±s表示,采用Student t-test检验分析2组间差异,比较2组以上的差异采用ANOVA检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 成功构建重症哮喘小鼠模型
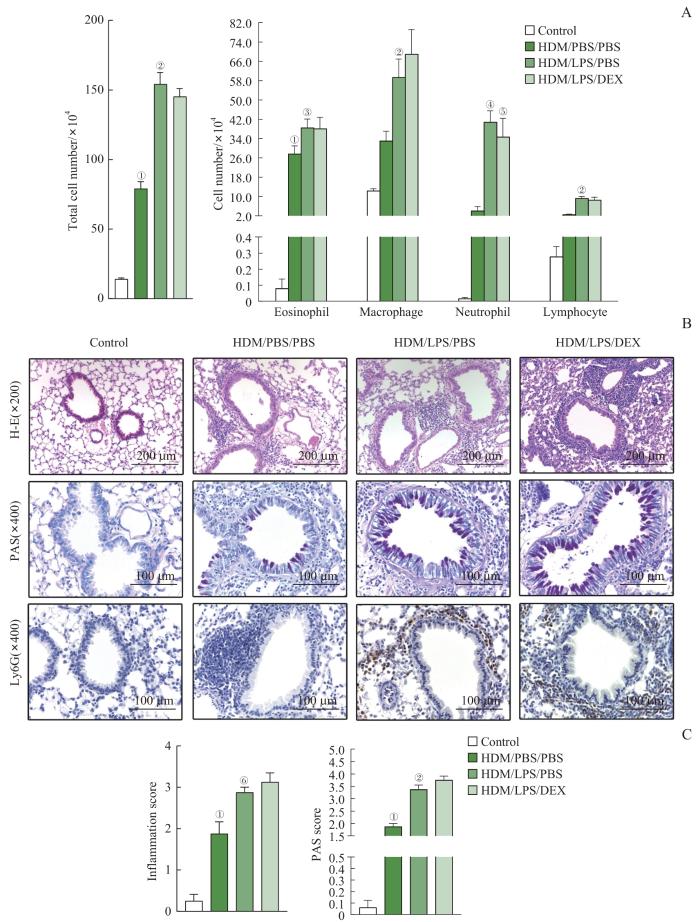
相比于空白对照组,轻度中度哮喘组(HDM/PBS/PBS)在气道滴注HDM后,BALF炎症细胞总数及嗜酸性粒细胞数量明显上升(均P<0.001);而与轻度中度哮喘组相比,重症哮喘组(HDM/LPS/PBS)BALF中炎症细胞总数及嗜酸性粒细胞、巨噬细胞、淋巴细胞数量显著增加,特别是中性粒细胞数量增加明显(均P<0.05),并且地塞米松治疗(HDM/LPS/DEX)未能降低重症哮喘小鼠的气道炎症细胞数量(图1A)。
图1
图1
BALF炎症细胞计数、肺组织病理切片及组织病理学评分结果
Note: A. The flow cytometry results of the inflammatory cell counts (eosinophils, lymphocytes, macrophages and neutrophils) in the BALF of mice in each group. B. Pathological sections of mouse lung tissue: H-E staining (×200), PAS staining (×400), Ly6G immunohistochemical staining (×400). C. Eosinophil and airway inflammation scores. ①P<0.001, ④P=0.010, compared with the control group; ②P<0.001, ③P=0.025, ⑤P=0.005, ⑥P=0.023, compared with the HDM/PBS/PBS group.
Fig 1
Results of BALF inflammatory cell counts, lung tissue pathological sections and histopathological scores
肺组织病理切片结果显示,与空白对照组相比,轻度中度哮喘小鼠支气管及血管周围有大量的炎症细胞浸润,气道黏液分泌显著增加;与轻度中度哮喘小鼠相比,重症哮喘小鼠气道炎症更为严重,炎症细胞浸润及黏液分泌显著增加,气道周围还可见大量中性粒细胞聚集,气道炎症评分显著上升(均P<0.05),同时地塞米松治疗后炎症水平和气道黏液分泌无明显改善(图1B、C)。上述结果表明,重症哮喘小鼠模型构建成功。
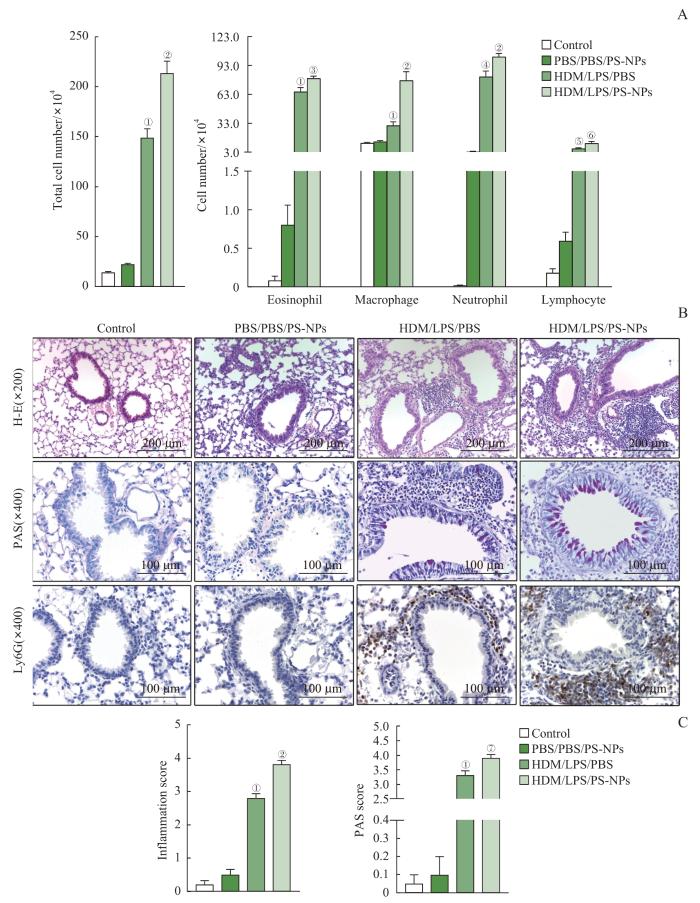
2.2 PS-NPs加重重症哮喘小鼠气道炎症反应和肺组织损伤
图2
图2
暴露于PS-NPs对重症哮喘小鼠BALF炎症细胞计数、肺组织病理切片及组织病理学评分结果的影响
Note: A. The flow cytometry results of the inflammatory cell (eosinophils, lymphocytes, macrophages and neutrophils) counts in the BALF of mice in each group after exposure to PS-NPs. B. Pathological sections of mouse lung tissue, including H-E staining (×200), PAS staining (×400), Ly6G immunohistochemical staining (×400). C. Eosinophil and airway inflammation scores. ①P<0.001, ④P=0.035, ⑤P=0.002, compared with the control group; ②P<0.001, ③P=0.001, ⑥P=0.008, ⑦P=0.002, compared with the HDM/LPS/PBS group.
Fig 2
Effect of exposure to PS-NPs on BALF inflammatory cell counts, lung tissue pathological sections and histopathological scores in mice with severe asthma
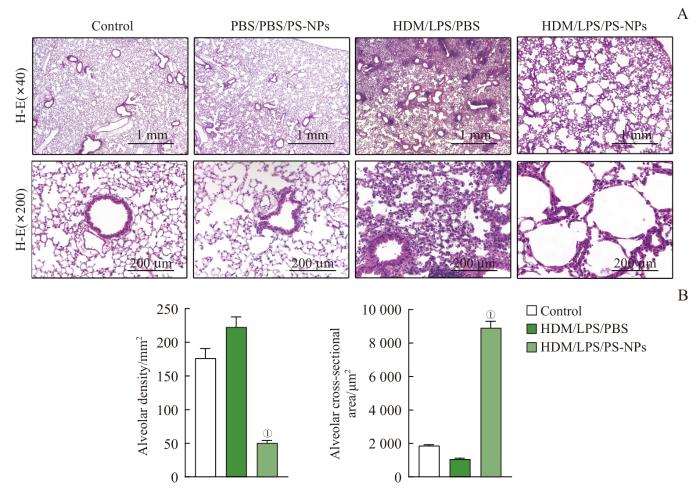
此外,肺组织切片H-E染色发现,空白对照组肺组织病理形态无异常改变,肺泡结构完整清晰、分布均匀,肺泡腔彼此分离、大小正常、无断裂、融合,肺泡内及肺泡周围均无炎症细胞浸润;PS-NPs组肺泡腔内及肺间质中有少量炎症细胞浸润,但肺泡仍然维持正常的结构;重症哮喘组肺泡腔内及肺间质中出现大量炎症细胞浸润,肺组织充血水肿,少部分肺泡塌陷,肺泡壁断裂水肿。计算肺泡截面积和单位面积肺泡数量发现,重症哮喘组的肺泡截面积[(1 066.85±55.93)μm2]相比于空白对照组[(1 868.69±49.94)μm2]略有下降,但差异无统计学意义;而重症哮喘+PS-NPs组小鼠的肺泡结构紊乱,肺泡腔明显扩大且肺泡壁断裂,相互融合成肺大泡,相比于空白对照组[(1 868.69±49.94)μm2]及重症哮喘组[(1 066.85±55.93)μm2],重症哮喘+PS-NPs组的平均肺泡截面积[(8 899.09±402.77)μm2]显著增加,而肺泡数量[(50.41±3.69)个/mm2]也显著少于空白对照组[(176.30±14.73)个/mm2]及重症哮喘组[(222.53±15.13)个/mm2]。这表明暴露于NPs会引起重症哮喘小鼠肺泡损伤,但不会对正常小鼠的肺泡造成显著的破坏(图3)。
图3
图3
暴露于PS-NPs对重症哮喘小鼠肺泡结构的影响
Note: A. Mouse lung alveolar pathological sections stained with H-E (×40, ×200). B. Analysis of alveolar density and alveolar cross-sectional area. ①P<0.001, compared with the HDM/LPS/PBS group.
Fig 3
Histopathological changes of mice lung alveolars among various groups after exposure to PS-NPs
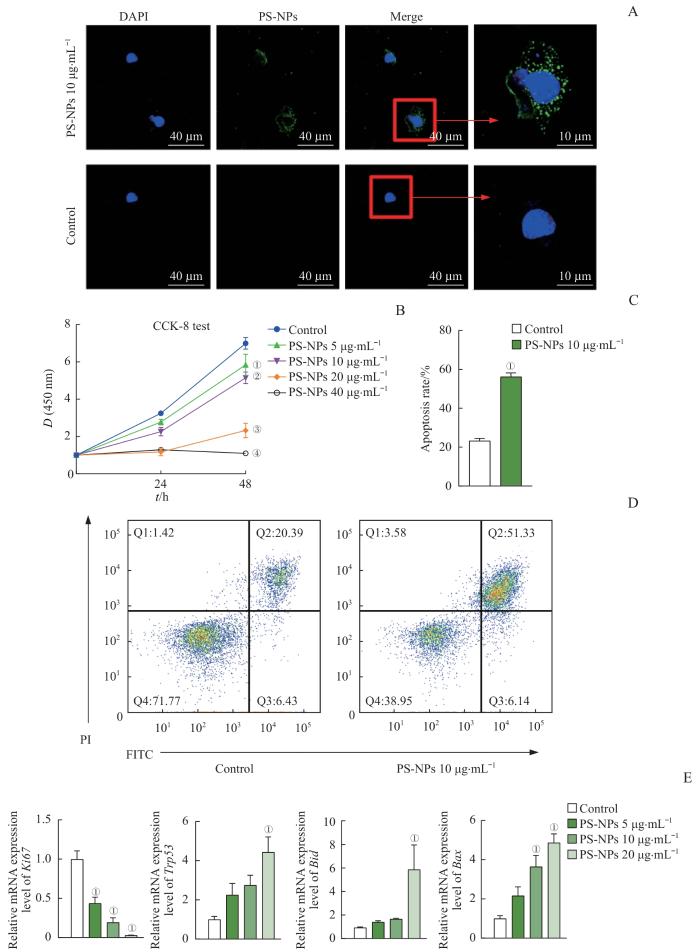
2.3 PS-NPs抑制AT2细胞增殖并促进其凋亡
图4
图4
PS-NPs对AT2细胞增殖、凋亡及相关基因mRNA表达水平的影响
Note: A. Confocal microscopy shows the distribution of PS-NPs in MLE-12 cells, namely AT2 cells (×1 000, ×4 000). AT2 cells were stained with PS-NP (green) and DAPI (blue). B. The effect of PS-NPs (5, 10, 20, 40 μg·mL-1) on the proliferation of AT2 cells after 0, 24 or 48 h. C/D. Analysis of the effect of PS-NPs on apoptosis of AT2 cells by Annexin-Ⅴ FITC/PI staining. E. The effect of PS-NPs exposure on the expression levels of proliferation and apoptosis-related genes Ki67, Bax, Bid, and Trp53 in AT2 cells. ①P<0.001, compared with the control group; ②P=0.025, compared with the PS-NPs 5 μg·mL-1 group; ③P<0.001, compared with the PS-NPs 10 μg·mL-1 group; ④P<0.001, compared with the PS-NPs 20 μg·mL-1 group.
Fig 4
Effects of PS-NPs on the proliferation, apoptosis and mRNA expression levels of related gene of AT2 cells
随后CCK-8实验结果显示,与对照组相比,当PS-NPs高于10 μg/mL时,细胞增殖活力随着PS-NPs暴露浓度增加而降低。在相同剂量下,PS-NPs达到20 μg/mL及以上时,干预48 h时的MLE-12细胞活力的下降相比于干预24 h时更为显著;当PS-NPs为40 μg/mL时,MLE-12的细胞活力几乎完全丧失(图4B)。以上结果证明PS-NPs能够抑制AT2细胞增殖,并表现出浓度和时间依赖性。根据这一结果,我们选择10、20 μg/mL这2个浓度进行后续实验。Annexin-Ⅴ FITC/PI双染色流式细胞术结果显示,PS-NPs组MLE-12细胞凋亡率为(56.20±3.84)%,与对照组[(23.22±2.52)%]相比,细胞凋亡率明显升高(P<0.001)(图4C、D)。
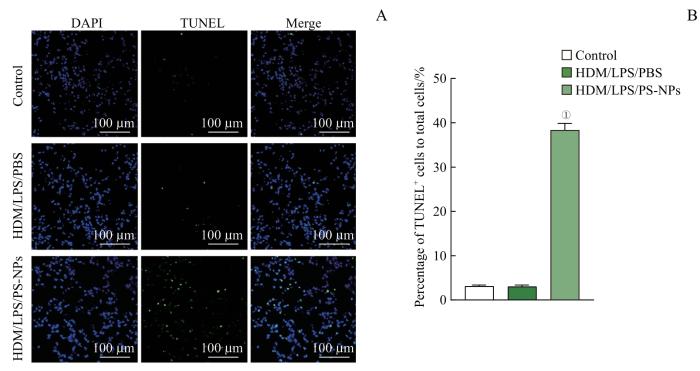
此外,TUNEL染色结果也证明,与空白对照组和重症哮喘组小鼠相比,PS-NPs暴露促进了重症哮喘小鼠肺组织细胞凋亡(图5)。上述结果表明,PS-NPs暴露抑制了重症哮喘小鼠AT2细胞增殖并进一步促进其凋亡,但具体机制尚不明确。
图5
图5
PS-NPs暴露后重症哮喘小鼠肺组织的细胞凋亡水平
Note: A. TUNEL staining of mouse alveolar pathological sections (×400). AT2 cells were stained with TUNEL (green) and DAPI (blue). B. The results of apoptosis rates in each group. ①P<0.001, compared with the HDM/LPS/PBS group.
Fig 5
Level of cellular apoptosis in lung tissue of severe asthma mice after PS-NPs exposure
2.4 PS-NPs通过ATR/Chk1/p53信号通路加重重症哮喘
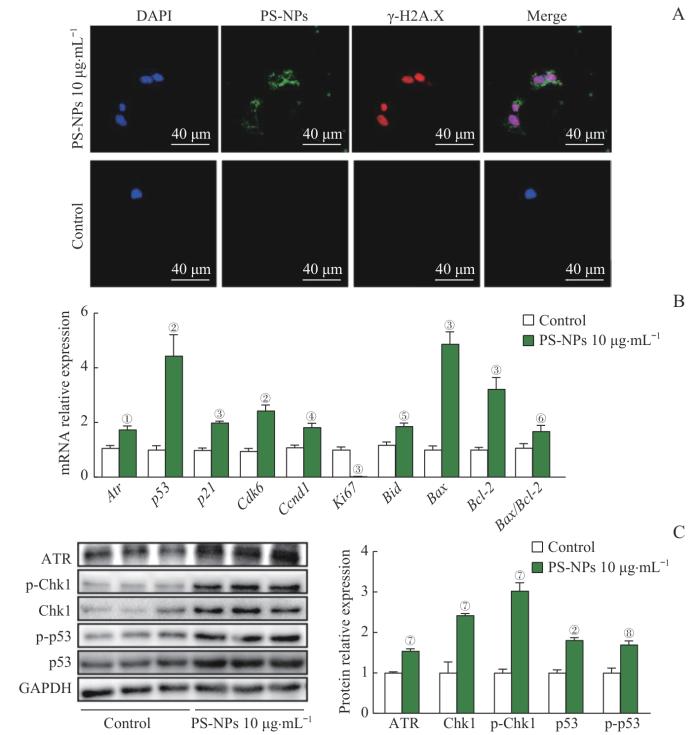
已有研究证实,空气污染物如PM2.5[18-19]、PM10[20]、香烟烟雾[21-22]等均能引起上皮细胞DNA损伤从而激活毛细血管共济失调突变基因(ataxia-telangiectasia mutated,ATM)/细胞周期检测点激酶2(cell cycle checkpoint kinase 2,Chk2)信号通路或ATM与Rad3相关蛋白激酶(ATM and Rad3-related kinase,ATR)/Chk1/p53信号通路,上调p53表达,引起细胞凋亡增加。γ-H2A.X为DNA损伤的标志物[23]。因此,我们通过免疫荧光技术检测PS-NPs暴露后γ-H2A.X的免疫荧光染色,发现在MLE-12细胞内吞PS-NPs之后,γ-H2A.X染色结果呈阳性,表明PS-NPs可能通过DNA损伤介导细胞凋亡的发生(图6A)。
图6
图6
体外实验证实PS-NPs暴露引起AT2细胞DNA损伤并上调ATR/Chk1/p53信号通路
Note: A. Immunofluorescence method to detect the effect of PS-NPs on DNA damage of AT2 cells (×1 000). AT2 cells were co-stained with γ-H2A.X (red) and PS-NPs (green) and DAPI (blue). B. qPCR analysis of the expression of ATR/Chk1/p53 signaling pathway and apoptosis-related genes in MLE-12 cells after exposure to PS-NPs. C. Western blotting analysis of the expression and phosphorylation of ATR, Chk1, and p53 proteins after exposure to PS-NPs. ①P=0.013, ②P=0.001, ③P=0.000, ④P=0.006, ⑤P=0.007, ⑥P=0.042, ⑦P=0.004, ⑧P=0.012, compared with the control group. GAPDH—glyceraldehyde-3-phosphate dehydrogenase.
Fig 6
In vitro experiments confirmed the DNA damage induction and the upregulation of the ATR/Chk1/p53 signaling pathway in AT2 cells after PS-NPs exposure
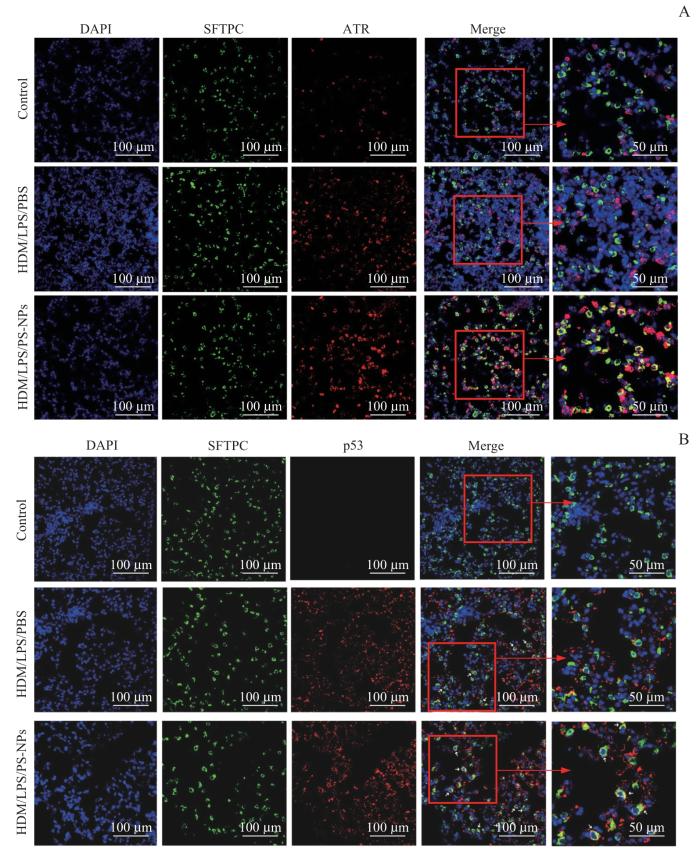
图7
图7
体内实验证实PS-NPs暴露上调重症哮喘小鼠 Sftpc+AT2中ATR、p53表达水平
Note: A. AT2 cells from lung tissues were co-stained with ATR (red) and SFTPC (green) and DAPI (blue) (×400, ×800). B. AT2 cells from lung tissues were co-stained with p53 (red) and SFTPC (green) and DAPI (blue) (×400, ×800).
Fig 7
In vivo experiments confirmed that the upregulated expression levels of ATR and p53 in Sftpc+ AT2 cells of severe asthma mice after PS-NPs exposure
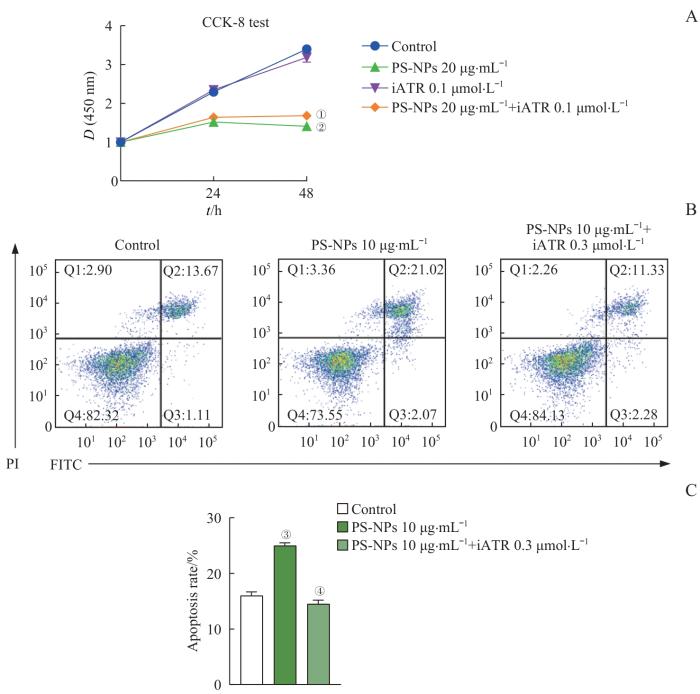
为进一步验证PS-NPs通过ATR/Chk1/p53信号通路调控AT2细胞的增殖和凋亡,我们选择Ceralasertib作为ATR激酶的特异性抑制剂重复相关实验。CCK-8实验结果表明,Ceralasertib可以明显减轻PS-NPs对
图8
图8
Ceralasertib对PS-NPs诱导的AT2细胞增殖、凋亡的恢复作用
Note: A. Ceralasertib restores the proliferation of AT2 cells after 0, 24 or 48 h. B/C. Ceralasertib restores the apoptosis rate of AT2 cells induced by PS-NPs. ①P=0.010, compared with the PS-NPs (20 μg·mL-1) group; ②P=0.001, ③P<0.001, compared with the control group; ④P<0.001, compared with the PS-NPs (10 μg·mL-1) group.
Fig 8
Ceralasertib restores the effects induced by PS-NPs on proliferation and apoptosis of AT2 cells
3 讨论
NPs可能参与了重症哮喘的发生发展。气道中性粒细胞的浸润与活化被认为与重症哮喘发生密切相关[25-27]。还有少数研究表明,吸入微塑料会增加哮喘的发病率和死亡率[24,28-29],并引起气道炎症和肺损伤[30-31]。但始终没有研究聚焦微塑料能否引起重症哮喘中的中性粒细胞数量变化。本研究发现在暴露于PS-NPs(50 μg/d,共7 d)后,重症哮喘小鼠中性粒细胞浸润显著增加,同时气道炎症明显加重,提示NPs可能通过中性粒细胞参与重症哮喘的发生发展。此外,本研究还发现未致敏小鼠暴露于PS-NPs后,其BALF中炎症细胞数量和肺组织切片染色结果均无显著变化,推测低剂量的NPs暴露可能对没有呼吸系统疾病的人群无显著影响。
研究表明,AT2细胞能够通过细胞自噬、Ras基因家族同源物A(ras homolog gene family member A,RhoA)/溶质转运蛋白家族26成员4(solute carrier family 26 member 4,SLC26A4)轴等抑制由过敏原诱导的哮喘气道炎症[32-33],对于哮喘的疾病进展有保护作用。因此我们猜测PS-NPs暴露造成了AT2细胞数量的损失,进而加重重症哮喘。CCK-8实验证实,PS-NPs显著抑制MLE-12细胞系的细胞增殖;我们还通过Annexin Ⅴ-FITC/PI双染色法、qPCR实验、TUNEL染色实验证明PS-NPs在体内或体外均可促进细胞凋亡。为进一步探究PS-NPs的作用机制,我们查阅文献得知其他空气污染物,如PM2.5[18-19]、PM10[20]、香烟烟雾[21-22]、柴油机尾气颗粒物[34]等,均能引起上皮细胞DNA损伤从而启动DNA损伤修复反应(DNA damage response,DDR),激活ATR/Chk1/p53或ATM/Chk2/p53通路,从而引起细胞凋亡增加[23]。我们首先通过γ-H2A.X免疫荧光染色证明了PS-NPs诱导DNA损伤。接着,通过qPCR及Western blotting证明了PS-NPs在体外激活ATR/Chk1/p53信号通路。为进一步明确PS-NPs在体内对AT2细胞的影响,我们使用SFTPC标记AT2细胞。免疫荧光共定位结果显示,与未暴露PS-NPs的小鼠相比,PS-NPs暴露后的重症哮喘小鼠肺组织中AT2细胞的ATR及p53表达水平显著增加,确定了PS-NPs在体内同样诱导AT2细胞ATR/Chk1/p53信号通路的上调。而ATR抑制剂Ceralasertib能够恢复AT2细胞的增殖能力,减少PS-NPs诱导的细胞凋亡。结合以上实验结果可以推测,PS-NPs暴露能够造成AT2细胞DNA损伤,激活ATR/Chk1/p53信号通路,进而调控AT2细胞的增殖和凋亡,引起重症哮喘气道炎症加重和肺泡结构破坏。
与其他空气污染物的研究相比,本研究未能探究所采用的NPs在不同剂量下的作用差异。在前期摸索阶段,除暴露于PS-NPs(50 μg/d,共7 d)的重症哮喘组之外,本研究还设置了暴露于其他剂量PS-NPs(100 μg/d,共7 d或10 μg/d,共7 d)的重症哮喘组。然而,结果发现暴露于PS-NPs(100 μg/d,共7 d)后该组小鼠体质量明显降低,饮食及活动减少;且在HDM致敏阶段,10只小鼠已死亡2只;在HDM激发阶段,1只小鼠在给予100 μg PS-NPs后当场死亡,1只小鼠在给予HDM后当场死亡,另有2只小鼠当日给药后依然存活,但分别在第17、18日清晨检查鼠笼时发现死亡。剩余4只小鼠在LPS给药阶段中死亡2只,仅存活2只。因此该组实验数据已不能采用。在对幸存2只小鼠取肺组织切片后,我们观察到其肺部严重的纤维化和肺大泡形成,经课题组讨论认为100 μg剂量的PS-NPs毒性过强而放弃。在尝试更低剂量的PS-NPs(10 μg/d,共7 d)暴露后,亦发现该组的重症哮喘小鼠与未经PS-NPs暴露的重症哮喘小鼠仅表现出微弱的炎症增强趋势,但结果不具有统计学差异,因而放弃了在后续实验中继续设置其他的PS-NPs暴露剂量,此为本研究的不足之处。
综上所述,本研究揭示NPs可通过ATR/Chk1/p53途径调控AT2细胞的DNA损伤、增殖与凋亡,进而导致重症哮喘炎症细胞浸润增加和管腔黏液分泌显著增加。研究结果为阐明NPs诱导重症哮喘加重的分子机制提供基础,为后续研究指明方向。
作者贡献声明
施泽纶、韩晓、张晓波提出研究思路、设计实验方案;施泽纶完成实验操作;施泽纶、韩晓负责数据整理分析;施泽纶、王青、何雯、傅唯佳、王颖雯、韩晓、张晓波参与论文的写作和修改;张晓波负责审定论文。所有作者均阅读并同意了最终稿件的提交。
AUTHOR's CONTRIBUTIONS
The study was instructed and designed by SHI Zelun, HAN Xiao, and ZHANG Xiaobo. Experimental operation was conducted by SHI Zelun. The data were analyzed by SHI Zelun and HAN Xiao. The manuscript was drafted and revised by SHI Zelun, WANG Qing, HE Wen, FU Weijia, WANG Yingwen, HAN Xiao and ZHANG Xiaobo. ZHANG Xiaobo generally checked the paper. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献