分选链接蛋白(sorting nexin,SNX)家族被报道在细胞内吞、蛋白分选、细胞信号转导、膜重塑等方面起到重要作用[4]。分选链接蛋白1(sorting nexin 1,SNX1)是首个被发现的SNX家族蛋白,最初被鉴定为一种与表皮生长因子受体(epidermal growth factor receptor,EGFR)相互作用的蛋白质,在早期内体到晚期内体/溶酶体的运输中发挥重要作用[5]。研究[6]发现,在吉非替尼敏感的非小细胞肺癌细胞中沉默SNX1的表达,可以促进配体介导的EGFR内吞作用,并促进EGFR的磷酸化,增加对吉非替尼的耐药性。体外实验[7]表明,沉默SNX1会促进胃癌细胞生长、迁移和侵袭并抑制凋亡,减弱胃癌细胞对化疗药物5-氟尿嘧啶的敏感性,同时SNX1能够调节上皮-间质转化(epithelial-mesenchymal transition,EMT)经典标志物的表达。尽管有这些发现,但SNX1在其他肿瘤组织中的表达以及在肿瘤发生发展和转移中的作用仍然未知,详细的临床价值有待阐明。
本研究拟探索SNX家族在CRC中的表达情况,重点关注SNX1的表达改变,及其与肿瘤大小、分期、转移、预后等临床病理信息的相关性,初步研究其对肿瘤细胞增殖、转移的影响和潜在的分子机制,以期为CRC的诊疗提供新思路和干预靶点。
1 材料与方法
1.1 试剂与仪器
达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、RPMI 1640培养基、胎牛血清(feta bovine serum,FBS)、青霉素-链霉素双抗(Gibco,美国),SNX1、β-actin抗体(Proteintech,美国)、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG、RIPA裂解液、5X SDS蛋白上样缓冲液(上海圣尔生物科技有限公司),jetPrime转染试剂(Polyplus,法国),反转录试剂盒(Takara,日本),SYBR Green PCR Master Mix(Thermo Fisher,美国)。化学发光成像仪(Bio-Rad,美国),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)仪(ABI,美国),Aperio数字病理学切片扫描仪(莱卡,德国)。
1.2 数据收集与分析
从UCSC xena(
1.3 实验方法
1.3.1 细胞培养
本研究中所用的人胚胎肾HEK293T细胞和人结肠腺癌细胞系HCT116、HT29、SW480、Caco-2、LoVo均购自中国科学院典型培养物保藏委员会细胞库。细胞培养遵循美国细胞培养物保藏中心的培养标准。采用DMEM高糖培养基培养HEK293T、SW480、Caco-2细胞,采用RPMI 1640培养基培养HCT116、HT29、LoVo细胞,培养基中均添加10%胎牛血清和1%青霉素-链霉素双抗。所有细胞均保存在37 ℃、5% CO2的恒温培养箱中。
1.3.2 siRNA瞬时转染
分别将处于对数生长期的HT29、SW480细胞以合适的密度均匀接种到6孔板中,待细胞生长至60%~70%密度时,使用jetPrime转染试剂按照使用说明进行瞬时转染,即分别将小干扰RNA(small interfering RNA,siRNA)阴性对照(NC-siRNA)、SNX1-siRNA1、SNX1-siRNA2转染至上述2种细胞中,在37 ℃、5% CO2的恒温培养箱中继续培养12 h后更换培养基,经qPCR、蛋白质印迹法(Western blotting)验证效率后进行后续实验。实验中所用的siRNA由上海吉玛制药技术有限公司设计合成,序列信息见表1。
表1 siRNA序列
Tab 1
| siRNA | Forward (5′➝3′) | Reverse (5′➝3′) |
|---|---|---|
| NC-siRNA | UUCUCCGAACGUGUCACGUTT | ACGUGACACGUUCGGAGAATT |
| SNX1-siRNA1 | GAGGAUCAAUUUGAUUUGATT | UCAAAUCAAAUUGAUCCUCTT |
| SNX1-siRNA2 | CAGGCCAACAAUGACUUCUTT | AGAAGUCAUUGUUGGCCUGTT |
1.3.3 慢病毒包装、感染
将HEK293T细胞以合适的密度均匀接种到6孔板中,待细胞生长至40%~50%时,使用jetPrime转染试剂将SNX1过表达质粒(SNX1-vector、SNX1-OE)与辅助包装质粒(psPAX2、pMD2.G)共转染HEK293T,6 h后更换完全培养基继续培养48 h。收集细胞培养液过滤、浓缩后得到慢病毒原液。
将待转染的LoVo细胞在60 mm培养皿中培养至60%密度,分别添加SNX1-vector、SNX1-OE慢病毒原液进行感染。48 h后使用2 μg/mL的嘌呤霉素进行筛选培养,以获得稳定过表达SNX1的LoVo细胞株及空载对照。采用Western blotting实验进行过表达效率的检验。
1.3.4 qPCR
采用qPCR实验检测CRC细胞中SNX1及其他目的基因的mRNA表达水平。按照操作说明提取细胞的总RNA,使用反转录试剂盒反转录成cDNA。根据试剂盒说明使用SYBR Green PCR Master Mix配置qPCR反应体系,反应条件为:94 ℃预变性5 min;94 ℃变性30 s;58 ℃退火30 s;72 ℃延伸1 min,共计40个循环。以18 s mRNA的表达水平为标准,采用
表2 qPCR引物序列
Tab 2
| Primer | Forward (5′➝3′) | Reverse (5′➝3′) |
|---|---|---|
| 18s mRNA | TGCGAGTACTCAACACCAACA | GCATATCTTCGGCCCACA |
| SNX1 | AAGCACTCTCAGAATGGCTTC | CGGCCCTCCGTTTTTCAAG |
| MACC1 | GGGTCACAGGTGAACGAGAT | CTGGGTCCTGGCATTCTGTA |
| MET | ATTTTGCTTTGCCAGTGGTGG | AGCGATGTTGACATGCCACT |
| NOTCH1 | AGAGGCGTGGCAGACTATG | CTGGCACGATTTCCCTGACC |
| CDH1 | GGCTGGACCGAGAGAGTTTC | CGACGTTAGCCTCGTTCTCA |
| VIM | CTCCCTGAACCTGAGGGAAAC | TTGCGCTCCTGAAAAACTGC |
| SNAI1 | TAGCGAGTGGTTCTTCTGCG | TGCTGGAAGGTAAACTCTGGA |
Note: MACC1—metastasis associated in colon cancer 1; MET—mesenchymal to epithelial transition factor; NOTCH1—Notch receptor 1; CDH1—cadherin 1; VIM—vimentin; SNAI1—snail family transcriptional repressor 1.
1.3.5 Western blotting
采用Western blotting检测CRC细胞中SNX1的蛋白表达水平。将肿瘤细胞用预冷的PBS洗净,加入RIPA裂解液在冰上裂解30 min,在12 000×g、4 ℃条件下离心细胞裂解产物30 min,收集上清液,用5X SDS蛋白上样缓冲液制备蛋白样品。依照实验室标准流程进行电泳、转膜、封闭、孵育一抗和二抗(β-actin、SNX1一抗的稀释比例均为1∶1 000,HRP标记的山羊抗兔IgG二抗稀释比例为1∶10 000),最后用化学发光成像仪进行成像。
1.3.6 免疫组织化学染色
收集2008年1月—2009年12月在上海交通大学医学院附属仁济医院就诊的192例CRC患者的肿瘤组织以及癌旁组织,用4%多聚甲醛完成固定,经石蜡包埋切片制作组织芯片。采用免疫组织化学染色(immunohistochemistry staining,IHC)检测组织芯片上SNX1的蛋白表达水平,经脱蜡水化、抗原修复、冷却、清除内源性过氧化物酶、封闭、孵育一抗和二抗(SNX1一抗的稀释比例为1∶200,HRP标记的山羊抗兔IgG二抗稀释比例为1∶1 000),经DAB显色、苏木素复染、脱水、封片,使用莱卡数字病理扫描仪拍照并观察组织细胞染色情况。按照组织芯片的染色程度分为4个等级:“-”“+”“++”“+++”分别代表基本没有染色、少量染色、中等染色和强染色。
1.3.7 细胞计数试剂盒8(cell counting kit-8,CCK-8)实验
分别将瞬时转染NC-siRNA、SNX1-siRNA1、SNX1-siRNA2的HT29、SW480细胞以及稳定转染SNX1-vector、SNX1-OE的LoVo细胞以2×103个/孔均匀接种于96孔板中,在37 ℃、5%CO2的培养箱中培养。确认所有细胞均贴壁后加入含有CCK-8的培养基100 μL(90 μL完全培养基+10 μL CCK-8试剂),在37 ℃孵育1 h,使用酶标仪测定450 nm处的吸光度,每隔24 h测量1次,持续5次,根据吸光度绘制生长曲线。
1.3.8 细胞划痕实验
分别将瞬时转染NC-siRNA、SNX1-siRNA1、SNX1-siRNA2的HT29、SW480细胞,以及稳定转染SNX1-vector、SNX1-OE的LoVo细胞(密度达到80%~90%)均匀接种在6孔板中,保证过夜后刚好能在孔中形成长满的单层细胞。次日,制造划痕后,更换无血清培养基继续培养24 h,在倒置显微镜下拍照并使用ImageJ软件对细胞迁移距离进行计算。
1.3.9 Transwell实验
分别将瞬时转染NC-siRNA、SNX1-siRNA1、SNX1-siRNA2的HT29、SW480细胞以及稳定转染SNX1-vector、SNX1-OE的LoVo细胞消化离心后用无血清培养基重悬并计数,细胞悬液密度调整至1×105个/mL。孔径为8 μm的Transwell小室置于24孔板中,上室加入200 μL细胞悬液(2×104个细胞),下室加入600 μL完全培养基,置于培养箱中培养24 h。取出小室,吸走培养基,上下室均加入4%多聚甲醛固定30 min,吸走固定液,加入0.1%结晶紫染液染色15 min,PBS清洗3遍。使用棉签轻轻擦拭小室里侧,除去上室内细胞和多余染料,风干后在显微镜下随机选取5个视野拍照并计数。
1.4 统计学分析
采用R语言对下载的数据库数据进行分析处理,采用GraphPad Prism 9.0软件对实验数据进行统计分析。所有数据均采用x±s表示,2组间比较采用Student′s t检验,多组间比较采用单因素方差分析或双因素方差分析,相关性分析采用Pearson相关分析。P<0.05为差异具有统计学意义。
2 结果
2.1 SNX家族在人类肿瘤中的表达情况
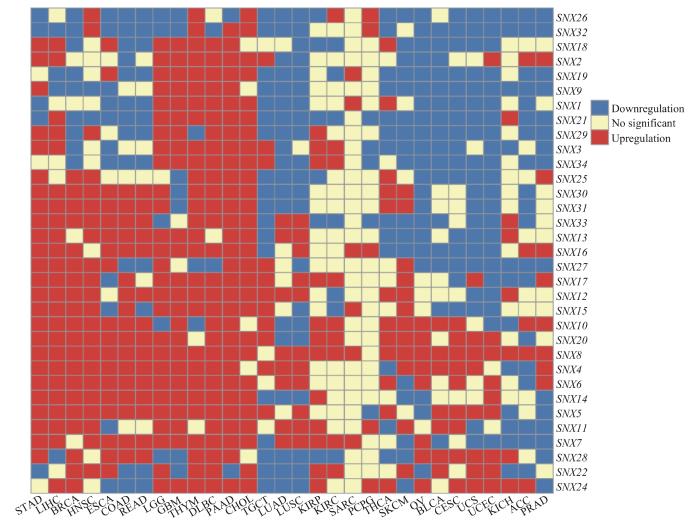
对30种人类癌症的9 018例肿瘤患者和8 160例健康对照在mRNA水平上SNX基因的表达情况进行分析和比较,发现SNX1、SNX9、SNX19、SNX21、SNX26、SNX29、SNX32、SNX33在更多的癌症中表达下调(图1)。本课题组前期已发表的研究[8]发现,SNX1在胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)中表达升高,其通过激活转化生长因子β(transforming growth factor β,TGF-β)信号通路促进PDAC细胞的增殖、迁移,并抑制凋亡。在对SNX家族的泛癌分析中发现,SNX1在CRC中表达下调,这与SNX1在PDAC中的表达改变情况相反,引起了我们的研究兴趣。
图1
图1
SNX家族在人类肿瘤中的表达情况
Note: STAD—stomach adenocarcinoma; LIHC—liver hepatocellular carcinoma; BRCA—breast invasive carcinoma; HNSC—head and neck squamous cell carcinoma; ESCA—esophageal carcinoma; COAD—colon adenocarcinoma; READ—rectum adenocarcinoma; LGG—brain lower grade glioma; GBM—glioblastoma multiforme; THYM—thymoma; DLBC—lymphoid neoplasm diffuse large B-cell lymphoma; PAAD—pancreatic adenocarcinoma; CHOL—cholangiocarcinoma; TGCT—testicular germ cell tumor; LUAD—lung adenocarcinoma; LUSC—lung squamous cell carcinoma; KIRP—kidney renal papillary cell carcinoma; KIRC—kidney renal clear cell carcinoma; SARC—sarcoma; PCPG—pheochromocytoma and paraganglioma; THCA—thyroid carcinoma; SKCM—skin cutaneous melanoma; OV—ovarian serous cystadenocarcinoma; BLCA—bladder urothelial carcinoma; CESC—cervical squamous cell carcinoma and endocervical adenocarcinoma; UCS—uterine carcinosarcoma; UCEC—uterine corpus endometrial carcinoma; KICH—kidney chromophobe; ACC—adrenocortical carcinoma; PRAD—prostate adenocarcinoma.
Fig 1
Expression levels of SNX family in human cancers
2.2 SNX1在CRC中表达情况及其与临床病理信息的相关性分析
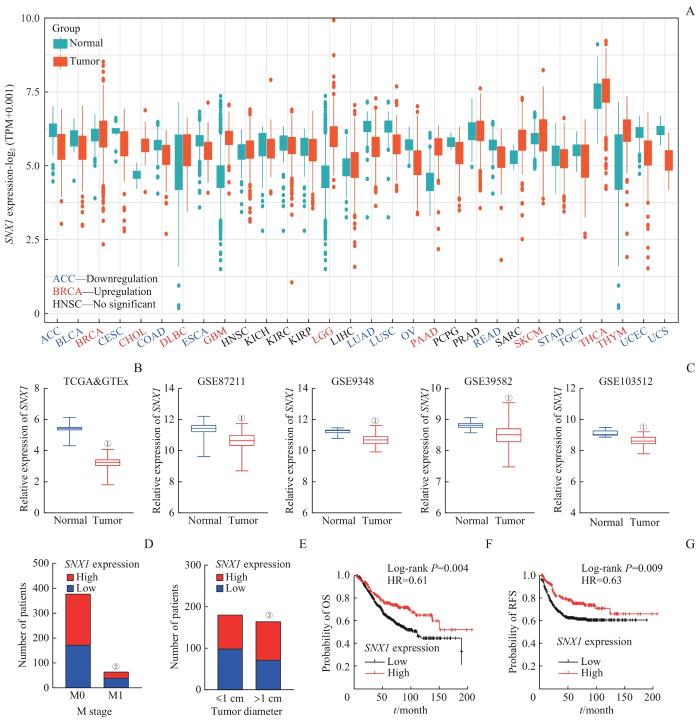
利用TCGA和GTEx数据库,比较了SNX1在30种人类癌症及相应健康组织对照中的表达情况,发现SNX1在其中的13种癌症组织中表达降低(图2A),其中包括CRC(图2B)。进一步分析了SNX1在GSE87211、GSE9348、GSE39582、GSE103512等多个GEO数据集中的表达情况,发现SNX1在CRC肿瘤组织中的表达水平相较于癌旁组织或健康组织对照均显著降低(图2C)。进一步分析了TCGA-CRC数据库中SNX1的表达水平与CRC肿瘤患者临床病理信息之间的相关性,结果显示,在发生远处转移(M1)的患者中,与未发生远处转移(M0)的患者相比,SNX1的低表达比例更高;在肿瘤直径不超过1 cm的患者中,与肿瘤直径大于1 cm的患者相比,SNX1的低表达比例同样更高(图2D、E),提示CRC中SNX1的低表达与肿瘤的生长和远处转移存在相关性。在GSE39582数据集中分析了SNX1表达水平和患者的总体生存期以及无复发生存期之间的相关性,结果显示,SNX1的mRNA表达水平降低与患者的总体生存期和无复发生存期之间呈正相关(图2F、G)。
图2
图2
SNX1 在CRC数据库中表达情况及其与临床病理信息的相关性分析
Note: A. Expression levels of SNX1 mRNA in human cancers. TPM—transcript per million. B. Expression levels of SNX1 mRNA in CRC tissues and normal colon tissues from the TCGA and GTEx databases. C. Expression levels of SNX1 mRNA in CRC tissues and normal colon tissues from the GEO databases. D. Correlation between SNX1 mRNA expression and M stage of patients from the TCGA database. E. Correlation between SNX1 mRNA expression and tumor size in patients from the TCGA database. F. Correlation between SNX1 mRNA expression and overall survival (OS) in patients from the GSE39582 database. G. Correlation between SNX1 mRNA expression and recurrence-free survival (RFS) in patients from the GSE39582 database. ①P=0.000, compared with normal colon tissues; ②P=0.022, compared with M0 groups; ③P=0.041, compared with the ≤1 cm groups.
Fig 2
Expression levels of SNX1 from the CRC database and its correlation with clinical pathological information
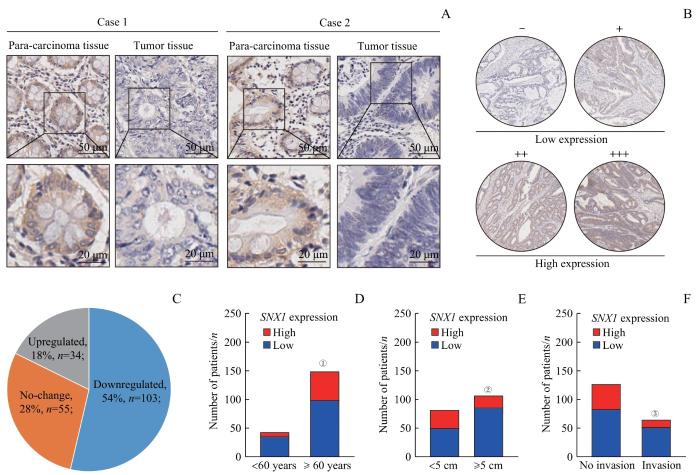
在利用TCGA、GTEx和GEO数据库进行统计分析的基础上,利用IHC检测了人CRC组织芯片上192对癌和癌旁组织中SNX1的蛋白表达,结果发现肿瘤组织中SNX1的表达水平显著低于癌旁组织(图3A)。根据SNX1的染色强度将组织染色分为4个等级(-、+、++、+++),将染色较浅的2个组别(-、+)判为SNX1低表达组,将染色较深的2个组别(++、+++)判为SNX1高表达组,据此来分析CRC组织芯片中SNX1表达水平与患者临床病理信息之间的相关性(图3B)。结果表明,在多数患者(103/192,54%)的肿瘤组织中,SNX1的表达降低(图3C);在年龄小于60岁的患者中,SNX1低表达的比例相较于年龄超过60岁的患者更高(图3D);同样,在肿瘤直径超过5 cm的患者及在发生肠壁淋巴结侵袭的患者中,SNX1低表达的比例也相较于肿瘤直径小于5 cm的患者和未发生肠壁淋巴结侵袭的患者更高(图3E、F)。以上结果表明,SNX1在CRC中表达下调,且CRC中SNX1表达水平的降低与肿瘤的侵袭和转移以及患者的不良预后显著正相关,提示SNX1可作为CRC不良预后的潜在生物标志物。
图3
图3
SNX1在CRC组织中表达情况及其与临床病理信息的相关性分析
Note: A. Expression of SNX1 detected by IHC in CRC tissues and para-carcinoma tissues from CRC patients. B. SNX1 staining was divided into four grades according to the depth of tissue microarray IHC staining. The two lower grades were grouped as the low-expression group, while the two higher grades were classified as the high-expression group. C. Expression of SNX1 was decreased in 54% of CRC tissues in tissue microarrays, by comparing IHC grades of CRC tissues with para-carcinoma tissues D. Correlation between SNX1 protein expression and age of patients in tissue microarrays. E. Correlation between SNX1 protein expression and tumor size of patients in tissue microarrays. F. Correlation between SNX1 protein expression and lymphatic invasion of patients in tissue microarrays. ①P=0.036, compared with the <60 years old group; ②P=0.005, compared with the <5 cm group; ③P=0.045, compared with the no lymphatic invasion group.
Fig 3
Expression levels of SNX1 in CRC tissues and their correlation with clinical pathological information
2.3 SNX1相关信号通路的富集分析
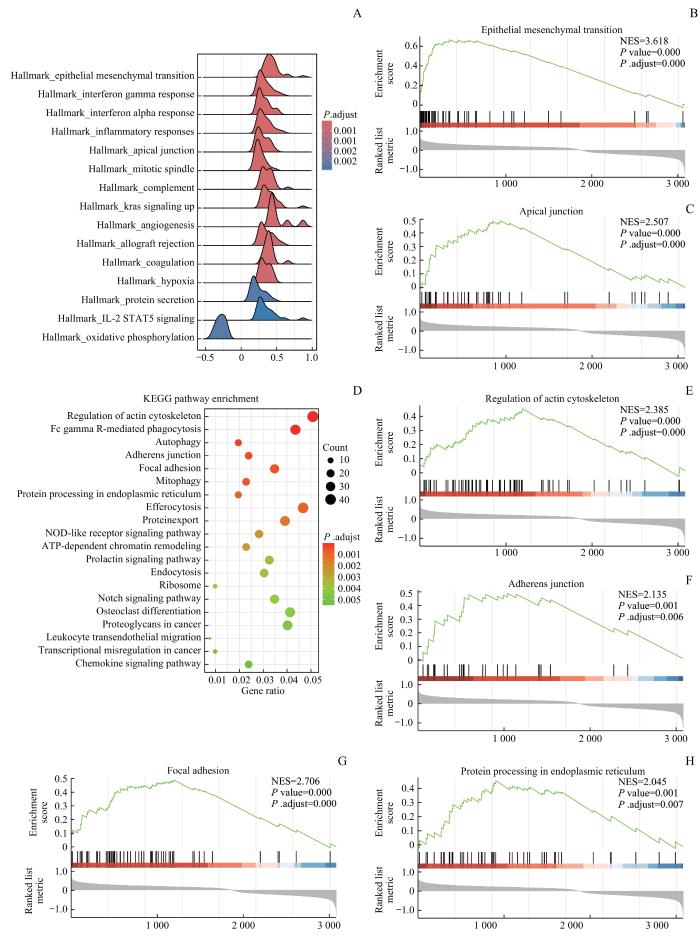
为进一步探究SNX1低表达影响CRC远处转移的潜在机制,将TCGA数据库中的CRC患者根据SNX1的mRNA表达水平进行高低分组,在GSEA中进行富集分析。首先使用Hallmark基因集进行富集分析,结果显示SNX1的表达与EMT通路、炎症反应(inflammatory response)、顶端连接(apical junction)等通路相关(图4A)。GSEA图显示EMT通路和顶端连接通路中的主要基因表达上调(图4B、C)。使用KEGG基因集进行富集分析,结果显示SNX1的表达与细胞骨架调节、自噬、紧密连接、焦点黏附、内质网蛋白传递、吞噬等通路相关(图4D)。GSEA图进一步展示了细胞骨架调节、紧密连接、焦点黏附和内质网蛋白传递通路中的主要基因表达上调,这与Hallmark基因集富集分析结果一致(图4E~H)。肿瘤细胞在EMT进程中会经历顶端极性消失、细胞黏附降低、获得间充质表型和特性,EMT赋予肿瘤细胞转移特性、增强侵袭、侵入周围组织并定植远处器官[9]。基于SNX1临床病理信息的相关性分析和通路富集分析结果共同提示,SNX1低表达对CRC侵袭和转移的影响可能是通过EMT及相关通路实现的。
图4
图4
SNX1相关信号通路的富集分析
Note: A. Ridgeline plots of Hallmark enrichment analysis based on SNX1 low-expression and high-expression groups. B/C. GSEA showed that EMT signaling pathway (B) and apical junction pathway (C) were enriched in the SNX1 low-expression group. D. Dot plots of KEGG enrichment analysis based on the SNX1 low-expression and high-expression groups. E‒H. GSEA showed that regulation of actin cytoskeleton pathway (E), adherens junction pathway (F), focal adhesion (G) and protein processing in endoplasmic reticulum pathway (H) were enriched in the SNX1 low-expression group.
Fig 4
Enrichment analysis of SNX1-related signaling pathways
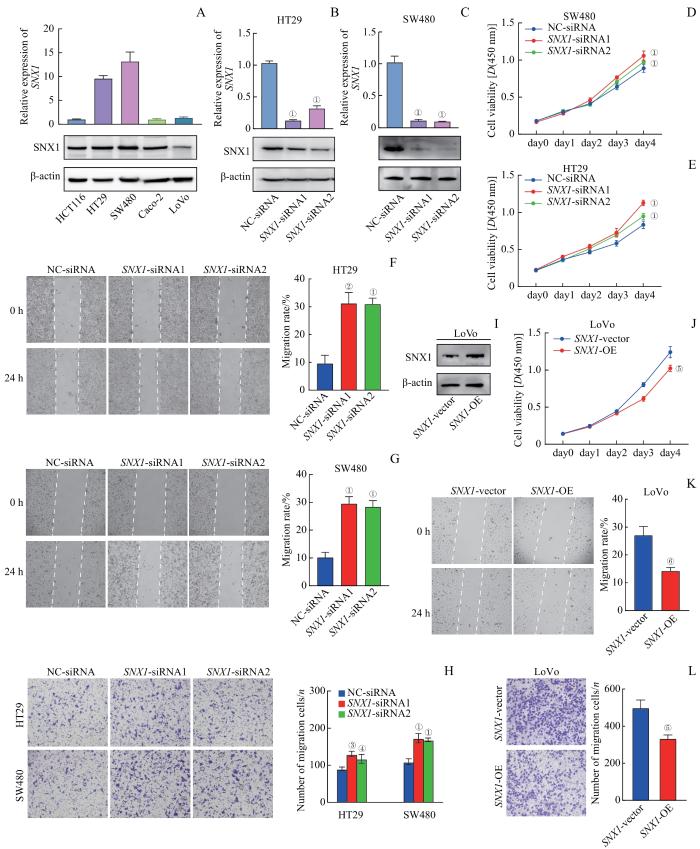
2.4 SNX1的表达水平对CRC细胞增殖和迁移的影响
为探究SNX1表达水平对CRC细胞增殖和迁移的影响,首先比较了不同CRC细胞株中SNX1的mRNA和蛋白表达情况,进一步选择在HT29和SW480细胞中进行SNX1的敲降(图5A)。经过siRNA的瞬时转染,利用qPCR和Western blotting检测SNX1-siRNA的敲降效率。结果显示,与阴性对照相比,分别转染了SNX1-siRNA1、SNX1-siRNA2的HT29、SW480细胞中,SNX1的表达均显著降低(图5B、C)。随后利用CCK-8实验对敲低SNX1的HT29、SW480细胞进行增殖能力检测(图5D、E),利用细胞划痕和Transwell实验进行迁移能力检测(图5F~H),结果显示,下调SNX1的表达会显著促进CRC细胞的增殖和迁移。
图5
图5
SNX1的表达水平对CRC细胞增殖和迁移的影响
Note: A. Expression levels of SNX1 detected by qPCR and western blotting in CRC cell lines. B/C. Transfection efficiency of SNX1-siRNA verified by qPCR (top) and western blotting (bottom) in HT29 cells (B) and SW480 cells (C). D/E. Effect of SNX1-siRNA knockdown on HT29 cell (D) and SW480 cell (E) proliferation detected by CCK-8. F/G. Effect of SNX1-siRNA knockdown on HT29 cell (F) and SW480 cell (G) migration (left) detected by wound healing assay and analysis of migration rate (right). H. Effect of SNX1-siRNA knockdown on HT29 cell (top) and SW480 cell (bottom) migration (left) detected by Transwell assay and analysis of migration cells (right). I. Overexpression efficiency of SNX1-OE verified by western blotting in LoVo cells. J. Effect of SNX1-OE overexpression on LoVo cell proliferation detected by CCK-8. K. Effect of SNX1-OE overexpression on LoVo cell migration (left) detected by wound healing assay and analysis of migration rate (right). L. Effect of SNX1-OE overexpression on LoVo cell migration (left) detected by Transwell assay and analysis of migration cells (right). ①P=0.000, ②P=0.003, ③P=0.000, ④P=0.005, compared with the NC-siRNA group; ⑤P=0.000, ⑥P=0.003, compared with the SNX1-vector group.
Fig 5
Effect of SNX1 expression on the proliferation and migration of CRC cells
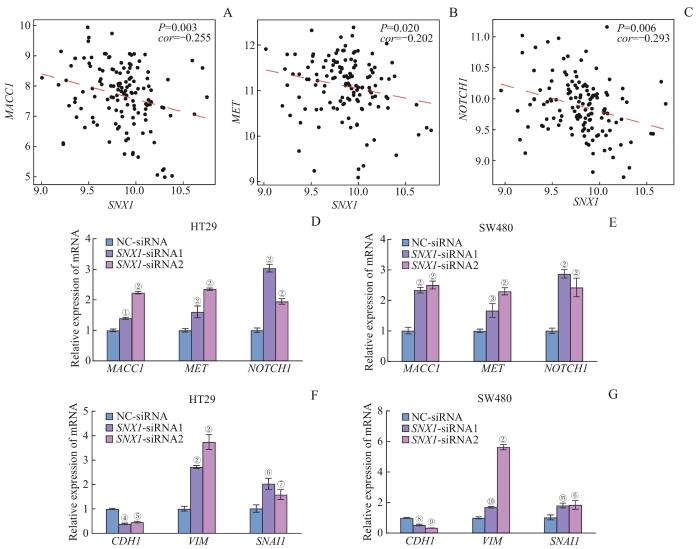
2.5 SNX1 低表达与CRC转移关键基因以及EMT相关
CRC的转移和侵袭受到多个基因和信号通路的调控,与EMT、细胞极性和细胞间黏附的改变、细胞外基质的降解等密切相关[10]。GSE41568数据库同时包含了原发CRC患者和已发生远处转移的CRC患者的转录组测序信息,利用GSE41568数据库对SNX1与CRC转移关键基因的相关性进行了探索。SNX1与多个基因表达情况的相关性分析显示,SNX1与结肠癌转移相关因子1(metastasis associated in colon cancer 1,MACC1)负相关(图6A),在进一步分析MACC1相关通路后发现,间质-上皮转换因子(mesenchymal to epithelial transition factor,MET)在CRC中的表达与SNX1负相关(图6B),这一趋势与MACC1一致,提示SNX1低表达促进CRC发生远处转移的机制可能与MACC1激活MET通路有关。在GSEA分析中,EMT通路被显著富集在SNX1低表达组,在GSE41568数据库中对其可能的作用机制进行了初步探索。相关性分析结果显示,Notch的表达与SNX1的表达呈显著负相关(图6C),这提示SNX1的低表达促进CRC的远处转移可能与Notch信号激活EMT进程有关。在SNX1敲降的HT29、SW480细胞中,qPCR结果表明,MACC1、MET和NOTCH1的表达随着SNX1的敲降而显著升高,初步证实了相关性分析的结果(图6D、E)。进一步探索了EMT标志物的表达改变,结果表明,在CRC细胞中敲低SNX1会下调钙黏蛋白(cadherin 1,CDH1)的表达,上调波形蛋白(vimentin,VIM)和Snail家族转录因子1(Snail family transcriptional repressor 1,SNAI1)的表达(图6F、G)。以上结果提示,SNX1低表达促进CRC的远处转移与MACC1-MET通路以及EMT进程的激活相关。
图6
图6
SNX1 低表达与CRC转移关键基因以及EMT相关
Note: A‒C. Correlation analysis between SNX1 and MACC1 (A), MET (B), NOTCH1 (C) in GSE41568 database. D/E. Relative mRNA expression of MACC1, MET and NOCTH1 in SNX1-konckdown and control groups in HT29 cells (D) and SW480 cells (E). F/G. Relative mRNA expression of CDH1, VIM and SNAI1 in SNX1-konckdown and control groups in HT29 cells (F) and SW480 cells (G). ①P=0.013, ②P=0.000, ③P=0.015, ④P=0.025, ⑤P=0.048, ⑥P=0.001, ⑦P=0.037, ⑧P=0.047, ⑨P=0.006, ⑩P=0.004, ⑪P=0.002, compared with the NC-siRNA group.
Fig 6
Correlation between low expression of SNX1 and key genes of CRC metastasis and EMT
3 讨论
研究[11]显示,在被诊断为CRC的患者中,20%患有转移性CRC;转移性CRC预后较差,5年生存率低于20%。多项临床试验[10]表明,根据肿瘤的分子和病理特征进行个性化治疗可提高患者总体生存期,全面解析影响CRC转移的分子机制有助于针对特定患者亚群及肿瘤的生物学特征进行治疗。细胞外基质的降解、细胞黏附性的降低、肿瘤微环境的改变都与肿瘤的转移密切相关,是多种肿瘤发展、侵袭的重要过程[12]。在GSEA分析中,发现CRC中SNX1低表达与EMT、顶端连接、紧密连接、焦点黏附相关,在肿瘤进展中以上通路的改变会显著影响肿瘤细胞的极性以及细胞间黏附,进而促进肿瘤的侵袭和转移。SNX1低表达促进CRC远处转移与上述通路之间的联系需要进一步阐明。
MACC1最初被确定为CRC中EMT的启动子,在多种肿瘤中上调,是一个重要的癌基因,可促进肿瘤增殖、侵袭和化疗耐药[13]。在已发生转移的恶性肿瘤组织中,MACC1可通过结合到MET的启动子区域,激活肝细胞生长因子(hepatocyte growth factor,HGF)/MET通路,进而促进肿瘤的增殖、EMT、肿瘤血管生成、侵袭和转移、调节细胞代谢和凋亡。MACC1作为HGF-MET信号转导的关键调节因子具有重要治疗意义[14]。在对GSE41568数据库中CRC患者RNA-seq数据的分析中,初步证明了SNX1与转移相关基因MACC1及其靶基因MET的表达负相关,提示SNX1低表达导致CRC的转移可能与MACC1激活HGF/MET通路有关。MET及其配体HGF在非小细胞肺癌中表达升高,且与非小细胞肺癌的吉非替尼耐药相关,而SNX1在对HGF刺激的MET的内吞调节中起到了抑制作用[15]。结合相关性分析以及mRNA水平上的验证,SNX1低表达促进CRC的远处转移可能是通过激活MACC1-MET通路而实现。
EMT的激活是肿瘤细胞转移的关键,在此过程中,上皮细胞获得间充质细胞的特征,细胞的运动能力和迁移能力增强[9]。在对TCGA-CRC数据库进行富集分析后,发现EMT相关信号通路被显著富集,这与SNX1低表达促进CRC转移的趋势一致。本课题组前期已发表的研究发现,SNX1在PDAC中表达升高,激活TGF-β及其下游经典的SMAD2/SMAD3通路,且TGF-β信号通路抑制剂Oxy能够回复过表达SNX1对PDAC细胞增殖和迁移的促进作用[8]。结合本次研究结果,提示在不同肿瘤中,SNX1的表达改变对TGF-β信号通路的激活以及激活后的TGF-β信号下游通路可能并不相同,SNX1在CRC中低表达对TGF-β信号通路的激活以及下游通路的影响则需要更深入的探索。
Notch信号通路参与了从极化的上皮细胞表型,如细胞间连接和细胞极性,发展为具有运动和侵袭性间充质细胞表型的复杂过程,在肿瘤发展、转移中同样扮演着重要角色[16]。Notch信号可以在体内调节TNF-α的表达,促进内皮细胞的EMT的进程[17]。在乳腺癌中,少量电离辐射即可高度激活Notch信号,驱动IL-6/JAK/STAT3信号轴来诱导EMT进程,诱发恶性肿瘤的生长和转移[18]。由于TGF-β诱导的EMT进程可以通过敲低Notch的表达来阻断,这表明Notch信号转导在EMT进程中起重要作用[19]。在CRC中,SNX1的表达与Notch表达显著负相关,敲低SNX1可以上调Notch的表达;敲低SNX1后EMT标志物的表达改变说明EMT进程的激活,提示CRC中SNX1低表达对肿瘤细胞的迁移和EMT进程的影响与Notch信号通路密切相关。
综上所述,本研究表明SNX1在CRC中表达下调,可能通过MACC1-MET和Notch信号通路影响肿瘤细胞的EMT进程,促进CRC的远处转移,提示SNX1可能是转移性CRC治疗的潜在靶点。随着研究的深入,SNX1有可能为临床预防、治疗CRC以及评估其预后带来广阔前景。
作者贡献声明
钱立恒、廖颖娜、聂惠贞参与了实验设计,钱立恒、李书鑫、温凯玲完成了实验操作,钱立恒、廖颖娜、李书鑫、温凯玲、聂惠贞参与了论文的修改和写作。所有作者均阅读并同意了最终的稿件提交。
AUTHOR's CONTRIBUTIONS
The study was designed by QIAN Liheng, LIAO Yingna and NIE Huizhen. The experimental operation was completed by QIAN Liheng, LI Shuxin and WEN Kailing. The manuscript was drafted and revised by QIAN Liheng, LIAO Yingna, LI Shuxin, WEN Kailing and NIE Huizhen. All the authors have read the last version of paper and consented for submission.
利益冲突声明
所有作者声明不存在利益冲突。
COMPETING INTERESTS
All authors disclose no relevant conflict of interests.
参考文献